三七皂苷R1对脑动脉硬化大鼠血管内皮细胞的影响
2021-07-05孙怀艳杨晓丹张梦翔程耀堂
孙怀艳,杨晓丹,张梦翔,程耀堂
(1.安徽中医药大学第二附属医院药剂科,合肥 230061;2.安徽中医药大学第三附属医院药剂科,合肥 230061)
脑动脉硬化(CEA)是由于脑血流量减少发生的弥漫性动脉硬化,常发于中老年人,主要表现为神经衰弱、颈动脉粥样硬化(AS)和眼底动脉硬化[1]。临床主要采用降血脂药物、扩张血管药物、介入治疗和对症治疗等治疗CEA,但仍存在部分患者治疗效果并不理想[2]。研究显示[3],CEA的发病机制可能与血管内皮损伤、脂质代谢障碍和高血压等密切相关。三七皂苷R1(NR1)是从三七的根及根茎中提取的有效活性成分,具有止血定痛、活血化瘀的功效[4]以及抗炎、抗氧化、降血脂、降血压等药理学作用,可抑制AS的形成[5]。本研究探索了NR1对CEA大鼠脑组织损伤和血管内皮细胞(VEC)功能的影响及可能的机制,以期指导临床治疗CEA。
1 仪器与材料
1.1仪器 HX-Ⅱ型小动物血压测量计,北京明信通生物科技有限公司;7600型全自动生化分析仪,日本HITACHI公司。
1.2试药 三七皂苷R1(NR1)对照品,上海源叶生物科技有限公司;辛伐他汀(批号A19042301),浙江京新药业有限公司;内皮素-1(ET-1)检测试剂盒,上海晶抗生物工程有限公司;一氧化氮(NO)检测试剂盒,南京建成生物工程研究所;辣根过氧化物酶(HRP)标记羊抗兔二抗,丹麦DAKO公司;兔抗鼠P-p38MAPK、p38MAPK、诱导型一氧化氮合酶(iNOS)和内皮型一氧化氮合酶(eNOS)抗体,均购自美国Santa Cruz公司。
1.3动物 雄性SPF级SD大鼠65只,体质量为(200±20) g,由安徽实验动物中心提供,饲养于安徽中医药大学动物中心实验室,室温控制在25 ℃,所有大鼠均自由饮食饮水。
2 方法
2.1造模及给药 所有大鼠预饲养1周后,随机选取10只作为对照组,剩余55只大鼠采用双肾双夹法复制肾性高血压CEA模型[6],先行双侧肾主动脉狭窄手术复制肾性高血压模型,术后1周给予高脂乳剂10 mL·kg-1,每日1次,连续灌胃14周,制备CEA模型,造模后大鼠出现血压、血脂升高,且脑中动脉出现动脉硬化斑块为造模成功,共50只大鼠造模成功;对照组只行双侧肾动脉分离术,饲喂常规饲料。将造模成功的大鼠随机分为模型组、NR1高、中、低剂量组和辛伐他汀组,各10只。造模后NR1高、中、低剂量组分别灌胃NR1 100、50、25 mg·kg-1·d-1,每日1次;辛伐他汀组灌胃辛伐他汀2.5 mg·kg-1·d-1,连续给药4周;模型组和对照组大鼠均灌胃等体积生理盐水。
2.2各组大鼠血清相关指标的检测 治疗后,采用小动物血压测量仪通过套尾法测定收缩压(SBP)、舒张压(DBP)和平均动脉压(MAP)。分离腹主动脉血液,以3 500 r·min-1离心10 min,采用生化分析仪检测血清胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL-C)及低密度脂蛋白(LDL-C)的水平。
2.3HE染色观察脑中动脉组织的病理变化 处死大鼠,迅速分离大鼠脑中动脉,用生理盐水冲洗后,加入质量浓度为40 g·L-1的多聚甲醛进行固定,常规脱水、透明、包埋、切片、HE染色,在光学显微镜下观察大鼠脑组织的病理变化,每张切片随机取5个视野拍照。
2.4脑组织NO和ET-1水平检测 取大鼠脑皮质及海马组织,匀浆,参考试剂盒说明书采用硝酸还原酶法测定脑组织中NO水平,参考试剂盒说明书采用放射免疫直接测定法检测脑组织中ET-1水平。
2.5Western Blot法测定脑组织中p38MAPK信号通路蛋白的表达 取大鼠脑皮质及海马组织,匀浆,加入1 mL细胞裂解液,以12 000 r·min-1离心5 min,取上清液,置于-20 ℃冰箱中保存,采用二喹啉甲酸试剂盒进行蛋白定量,取50 μg提取的总蛋白样品经SDS-PAGE凝胶电泳,采用湿转法转膜至硝酸纤维素膜,加质量浓度为50 g·L-1的脱脂牛奶封闭2 h,采用洗膜缓冲液(TBST)洗膜30 min,加入一抗p38MAPK、P-p38MAPK、eNOS、iNOS(1∶500),以β-actin(1∶500)为内参,于4 ℃下孵育过夜,TBST洗膜30 min,并加HRP标记的二抗(1∶1 000),37 ℃下孵育2 h,采用电化学发光显影,采用Image J图像分析系统分析蛋白相对表达量。

3 结果
3.1NR1对CEA大鼠脑中动脉损伤的影响 见图1。由图1可知,对照组大鼠脑中动脉组织细胞排列整齐,结构完整,未见明显病变;模型组和NR1低剂量组大鼠脑中动脉壁明显增厚,内皮细胞向管腔内突出,中层平滑肌细胞增生;NR1中、高剂量组和辛伐他汀组大鼠脑中动脉病理变化明显减轻,且随着剂量的增加,病变呈减轻趋势。

图1 各组大鼠主动脉的病理变化(HE,×200)
3.2NR1对CEA大鼠血压的影响 见表1。由表1可知,模型组大鼠SBP、DBP和MAP水平明显高于对照组(P<0.05);NR1中、高剂量组和辛伐他汀组大鼠SBP、DBP和MAP水平明显低于模型组(P<0.05),且随着NR1剂量的增加,各指标水平变化愈加明显(P<0.05)。
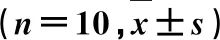
表1 NR1对CEA大鼠血压的影响
3.3NR1对CEA大鼠血脂的影响 见表2。由表2可知,与对照组比较,模型组大鼠TG、TC和LDL-C水平均明显升高(P<0.05),HDL-C水平明显下降(P<0.05);与模型组比较,NR1中、高剂量组和辛伐他汀组大鼠TG、TC和LDL-C水平明显降低(P<0.05),HDL-C水平明显升高(P<0.05),且随着NR1剂量的增加,各指标水平变化愈加明显(P<0.05)。
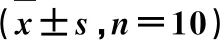
表2 NR1对CEA大鼠血脂的影响
3.4NR1对CEA大鼠脑组织NO和ET-1水平的影响 见表3。由表3可知,模型组大鼠脑组织NO和ET-1水平明显高于对照组(P<0.05);NR1中、高剂量组和辛伐他汀组大鼠脑组织ET-1水平明显低于模型组(P<0.05),且随着NR1剂量的增加,各指标水平变化愈加明显(P<0.05)。
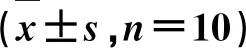
表3 NR1对CEA大鼠NO和ET-1水平的影响
3.5NR1对CEA大鼠p38MAPK信号通路的影响 见图2和表4。

图2 NR1对CEA大鼠p38MAPK信号通路的影响
由图2和表4可知,模型组和NR1中、高剂量组组大鼠脑组织P-p38MAPK/p38MAPK和iNOS的蛋白表达明显高于对照组(P<0.05),eNOS的蛋白表达明显低于对照组(P<0.05);NR1中、高剂量组和辛伐他汀组P-p38MAPK/p38MAPK和iNOS的蛋白表达明显低于模型组(P<0.05),eNOS的蛋白表达明显高于模型组(P<0.05),且随着NR1剂量的增加,各指标变化愈加明显(P<0.05)。
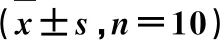
表4 NR1对CEA大鼠p38MAPK信号通路的影响
4 讨论
CEA以脑AS为主,随着病情的发展,可引起缺血性脑血管病,影响患者预后。CEA的发病机制复杂,与进行性脂质沉积、高血压和VEC损伤等有关[7]。研究显示[8],高血压及高血脂是CEA形成的主要危险因素,长期的高血压和高血脂状态可影响VEC功能,诱导动脉内膜增厚,引起脑血管管腔狭窄阻塞,影响脑局部组织血流量减少,引起脑组织缺血缺氧坏死,临床常采用高血压联合高血脂法制备大鼠CEA模型。辛伐他汀是目前常用的降脂药,可有效延缓CEA的形成[9]。NR1是从中药三七中提取的有效活性成分,具有降血压、调脂和抗氧化等多种作用,可延缓AS形成,但其具体作用机制尚不明确[10]。因此,本研究探讨了NR1对CEA大鼠脑动脉组织损伤的作用及机制,以期指导临床治疗。
本研究中,CEA大鼠脑中动脉存在明显损伤,动脉壁明显增厚,经NR1干预后,可明显减轻CEA大鼠脑中动脉组织的病理变化,降低脑中动脉壁厚度,抑制血管平滑肌增殖,还可降低血压,降低TG、TC和LDL-C水平,升高HDL-C水平,且随着浓度升高,各指标差异变化更显著,提示NR1可能呈浓度依赖性地改善AS大鼠的血压和血脂水平,抑制血管平滑肌增殖。Yao L等[11]研究显示,长期高血压可使动脉管壁增厚,形成硬化斑块。高血脂是影响CEA发生和进展的主要危险因素,血脂中的主要成分是TG和TC,LDL-C是运输内源性TC到肝外组织的主要载体,HDL-C可将肝外组织中的TC转运至肝脏组织中,进行代谢,从而降低机体的血脂水平[12]。Fernández-Friera L等[13]研究显示,血脂水平与VEC损伤密切相关,LDL-C进入血管内皮细胞后可诱导细胞氧化,促进活性氧(ROS)的产生,形成氧化修饰低密度脂蛋白(ox-LDL-C),加重VEC氧化损伤,促进CEA的形成,提示NR1可能通过机体的血压和血脂水平,减轻血管VEC的氧化应激损伤。
本研究中,NR1干预可降低CEA大鼠脑组织ET-1和NO水平,且随着浓度升高,各指标差异变化更显著。ET-1和NO是一组由VEC分泌的细胞因子,可共同作用调节血管的收缩功能,其中NO可通过多种途径抑制ET-1的分泌,扩张血管,抑制血管平滑肌细胞的增殖,还可清除机体过多的氧自由基,减轻细胞氧化应激损伤[14]。ET-1是一种强力的血管收缩因子,可通过抑制eNOS的表达而抑制NO的合成,促进血管平滑肌增殖,诱导动脉血管壁增厚,促进CEA的形成[15]。NO主要由一氧化氮合成酶(NOS)合成,包括神经元型NOS、iNOS和eNOS。研究显示,eNOS可合成并分泌少量的NO,从而抑制收缩因子ET-1的分泌,抑制血管平滑肌增殖,活化的iNOS可合成并分泌大量的NO和过氧化物,激活组织细胞的氧化应激反应,诱导VEC的氧化应激损伤[16]。李春晓等[17]研究发现,NO和ET-1水平异常升高可反映脑组织的VEC功能,诱导组织损伤,提示NR1可通过调节脑组织NO和ET-1水平变化,保护VEC功能。
丝裂原活化蛋白激酶(MAPK)信号通路包括3条途径,细胞外调节蛋白激酶1/2(ERK1/2)通路、c-Jun氨基末端激酶(JNK)通路及p38MAPK通路。近年来研究显示[18],p38MAPK信号通路被磷酸化激活后,可调节下游iNOS和eNOS的表达,参与调节VEC功能。本研究中,NR1干预可降低CEA大鼠脑组织p38的磷酸化,促进eNOS的蛋白表达,抑制iNOS的蛋白表达。孙慧琳等[19]研究显示,胰高血糖素样肽1可抑制p38MAPK的磷酸化,促进eNOS的蛋白表达,减轻VEC的氧化损伤,延缓糖尿病大鼠AS的形成。钱风华等[20]研究显示,p38MAPK抑制剂可抑制iNOS的蛋白表达,改善脓毒症大鼠的心肌损伤,提示NR1可能通过抑制p38MAPK的磷酸化,上调eNOS的蛋白表达,下调iNOS的蛋白表达及NO和ET-1水平,改善VEC功能。
综上所述,NR1可通过抑制CEA大鼠p38MAPK的磷酸化,调节eNOS、iNOS的蛋白表达及NO、ET-1水平,降低血压和血脂水平,改善VEC功能,延缓CEA发展。但本研究尚处于探索阶段,其具体机制还需进一步验证。
