颅内前循环wingspan支架内再狭窄的危险因素分析
2021-07-02邓剑平何宜轩赵振伟
王 冰 陈 虎 李 江 邓剑平 何宜轩 赵振伟
脑卒中具有发病率高、病死率高和致残率高等特点,其中缺血性脑卒中占60%~90%,严重危害人们的健康[1]。根据TOAST分型,缺血性脑卒中最常见的原因是动脉粥样硬化性狭窄,而最常累及的部位是前循环[2]。目前,血管内治疗是颅内前循环动脉粥样硬化性狭窄的有效治疗方式,包括单纯球囊扩张成形术以及球囊扩张并支架置入术。支架内再狭窄(in-stent restenosis,ISR)是支架置入术的一个主要问题[3],与术后短暂缺血发作、卒中或死亡密切相关,严重影响病人的生活质量。本文探讨颅内前循环动脉粥样硬化性狭窄支架置入术后ISR的危险因素,以期为临床提供参考。
1 资料与方法
1.1 病例入选和排除标准 纳入标准:①年龄>18岁;②符合TOAST分型中大动脉粥样硬化性狭窄;③签署治疗知情同意书;④颅内血管狭窄行球囊扩张并行wingspan支架置入术(血管狭窄程度利用WASID标准[4]);⑤在我院完成脑血管造影随访。排除标准:①合并肝、肾等器官功能严重异常;②妊娠期或哺乳期女性;③合并脑出血等出血性疾病;④精神异常;⑤临床资料不完整。
回顾性分析2011年1月至2019年6月收治的符合标准的winspan支架置入术治疗的99例颅内前循环动脉粥样硬化性狭窄病人的临床资料。
1.2 治疗方法 术前口服双重抗血小板药物[阿司匹林(100 mg/d)+氯吡格雷(75 mg/d)]3~5 d;进行血栓弹力图检测,并根据血栓弹力图结果调整抗血小板药物治疗。采用全身麻醉,全程静脉注射肝素抗凝。采用Seldinger法行股动脉穿刺,置入6F动脉鞘,把6F的导引导管头端置于颈内动脉岩段。在路图下,将300 cm微导丝通过靶病变,若血管迂曲或极重度狭窄(线样血流),应用SL-10微导管辅助微导丝通过。沿微导丝送入Gateway球囊(直径为狭窄近端正常血管管径的80%~100%,长度根据狭窄病变长度进行选择)。造影确认球囊位于狭窄病变处,压力泵扩张至命名压(或高于命名压2~3个大气压)后释放压力,球囊充盈时间至少20 s。球囊扩张后再次造影评估是否需要再次扩张。路图引导下置入wingspan支架,直径大于狭窄近端正常管径0.5 ~1 mm,长度超过狭窄长度至少6 mm(完全覆盖狭窄病变两端至少3 mm),造影确认位置无误后释放支架。撤出导丝后,再次造影确认病变部位的残余狭窄程度。若残余狭窄程度超过50%,予以球囊后扩张处理。术后3 d复查头颅CT,若出现神经功能障碍,随时复查CT。术后继续口服双重抗血小板药物3个月,并进行血栓弹力图检测,然后选择一种敏感药物终身服用(阿司匹林100 mg/d或氯吡格雷75 mg/d)。
1.3 随访 随访结束时间为2020年7月。出院后6~12个月复查DSA,确定并测量最小管腔直径。ISR定义为:支架附近(5 mm内)狭窄程度超过50%;初始治疗后残留狭窄程度在30%~50%的病例中,绝对管腔直径减少20%[5]。
1.4 统计学方法 应用SPSS 25.0 软件进行分析;正态分布定量资料用±s表示,采用t检验;非正态分布定量资料用中位数及四分位间距表示,采用Mann-Whitney U检验;定性资料采用χ2检验;采用多因素logistic回归分析检验ISR的独立危险因素;以P<0.05 为差异有统计学意义。
2 结果
2.1 ISR发生率99例共置入wingspan支架100枚,其中颈内动脉颅内段26枚,大脑中动脉74枚;支架置入成功率为100%。术后随访6~72个月,中位随访时间12个月(四分位数区间8~19.5 个月)。29处(29.0%)发生ISR,其中症状性ISR有10处(10.0%)。71处未发生ISR。
2.2 ISR的危险因素 单因素分析显示高血压、血脂、同型半胱氨酸血症、术前狭窄程度以及残余狭窄程度与ISR有关(P<0.05;表1)。多因素logistic回归分析结果显示高血压病史、残留狭窄程度>20%、血脂异常是ISR的独立危险因素(P<0.05;表2)。
3 讨论
颅内动脉粥样硬化性狭窄是缺血性脑卒中的主要病因。支架置入术逐渐成为治疗颅内动脉粥样硬化性狭窄的首选治疗方案,但术后并发症ISR严重影响治疗效果。本文结果显示高血压病史、残留狭窄程度>20%、血脂异常是ISR的独立危险因素。
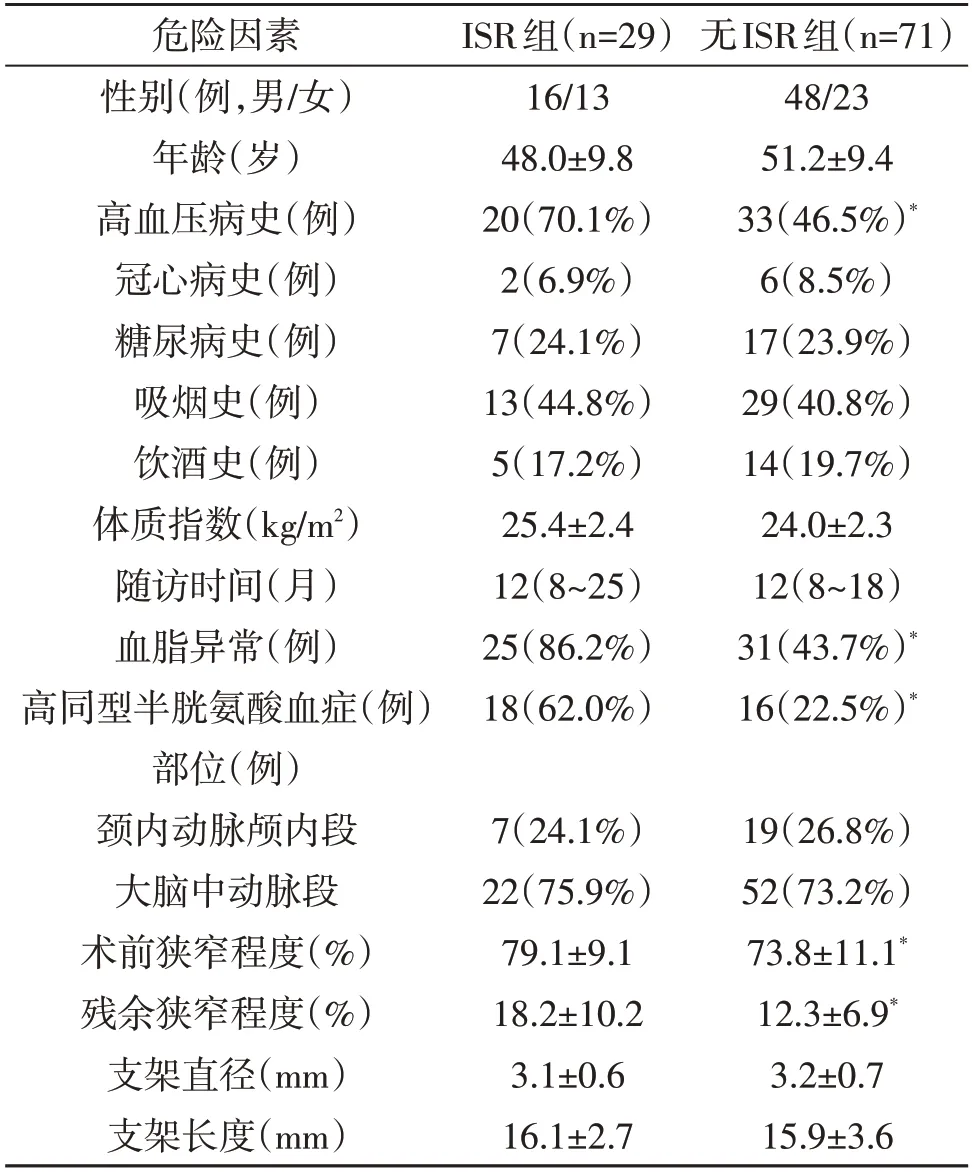
表1 本文99例颅内前循环winspan支架置入术后支架内再狭窄危险因素的单因素分析
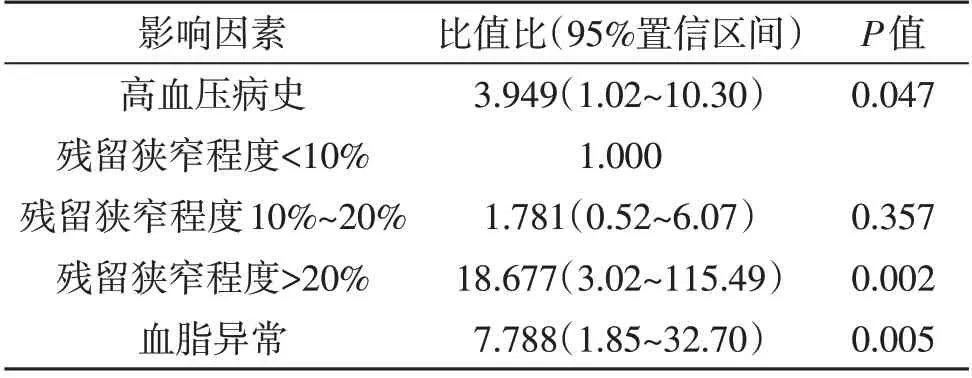
表2 本文99例颅内前循环winspan支架置入术后支架内再狭窄危险因素的多因素logistic回归分析
有共识指出,颈动脉支架置入术中可以不用追求完美的血管造影结果[6],但是残余狭窄程度越高,ISR发生的可能性越大[7~10]。原因可能是颅内血管管腔较小,残余狭窄程度越高,越容易引起血流动力学异常,进而引起血小板等聚集,导致ISR[11,12]。本文与残余狭窄程度<10%的病人相比,残余狭窄程度10%~20%的病人发生ISR的风险无明显变化,但是残余狭窄程度>20%的病人发生ISR的风险增加16.9 倍。
高脂血症是导致动脉粥样硬化性狭窄的发病机制之一。支架置入术会引起血管内膜的损伤,脂质更易沉积,而且高脂血症病人的血液粘稠度增加,血流清除能力降低,血小板以及炎症细胞等聚集,更容易导致支架部位血栓形成或新生内膜形成。Jimi等[13]对ISR病人组织进行免疫组织化学染色分析,发现低密度脂蛋白和胶原纤维的共同聚集在ISR的发生中起重要作用。高脂血症增加低密度脂蛋白进入内膜和内皮下间隙的进展性氧化改变。氧化的低密度脂蛋白导致脂质在完整的内皮细胞中进一步浸润,聚集并激活从血小板、巨噬细胞和内皮细胞释放有丝分裂原,反过来又刺激平滑肌细胞的增殖,从而导致新生内膜的形成,最终导致ISR[14]。
ISR与内皮细胞损伤与炎症反应相关,炎症细胞因子和生长因子的失调是ISR发病机理的关键机制[13~15],引起平滑肌细胞的增殖以及新生内膜的形成[16]。既往研究证实,高血压和内皮细胞的损伤密切相关[17]。本文发现高血压病史与ISR相关,可能是高血压加速支架置入部位血管内皮细胞的损伤,导致平滑肌细胞增殖以及新生内膜形成,进而导致ISR。
本文存在一些局限性。首先,这是一项回顾性分析,没有随访脑血管造影的病例被排除,且脑血管造影的随访时间较短,因此数据可能存在偏差。其次,再狭窄的病例数较少,可能会造成潜在的偏倚。
总之,本文结果提示,对于颅内前循环动脉粥样硬化性狭窄病人,支架置入术中注意控制残余狭窄程度,术后应严格控制血脂,尤其是合并高血压病史的病人,更加要注意危险因素的控制,术后需更为密切的随访和针对性的强化药物治疗。
