芍药苷对血管内皮生长因子诱导的人脐静脉内皮细胞小管形成的影响
2021-06-27迟骁玮陈刚领
迟骁玮 陈刚领
1.国家卫生健康委医药卫生科技发展研究中心,北京 100044;2.中国药科大学中药学院,江苏南京 211198
血管生成是指从已存在的微血管床上芽生出新的血管系统的过程,主要包括蛋白酶的产生、内皮细胞的迁移和增殖、内皮细胞管道化分支形成血管环和形成新的基底膜等过程[1-2]。血管生成与肿瘤的发展过程关系密切,实体瘤可通过调节肿瘤微环境促使新的毛细血管生成,进而在瘤体内形成微循环网,以实现肿瘤的血液及营养物质供应[3-4]。研究证实,在瘤体内未形成新生血管前,肿瘤细胞通过组织弥散的方式获得氧和营养物质,如果没有血管系统,实体瘤的增长不会超过1 cm3[5-7]。因此,通过抑制血管生成的方式阻断瘤体的给养通道,限制瘤体的氧和营养物质供应,可以有效控制瘤体的增大,是治疗肿瘤的有效方式之一。肿瘤血管生成是一个多环节的过程,在促进新生血管形成中,血管内皮生长因子(vascular endothelial growth factor,VEGF)是重要的诱导因子之一,且其在体外有促进内皮细胞小管形成的作用[8-9]。芍药苷(paeoniflorin,PF)是一种单萜糖苷类化合物,在毛茛科植物芍药的根中含量较高,具有抑制血小板、抗血栓、减轻脑缺血再灌注损伤及抗肿瘤等药理活性[10-12]。本研究拟针对PF 抗血管生成作用展开研究,旨在通过相关研究评定PF 抑制血管生成的作用及相关效果并初步探讨相关机制。
1 材料与方法
1.1 药品、试剂与仪器
PF:纯度>98%,购自南京替斯艾么中药研究所。M199 培养液:批号为0225,购自Invitrogen 公司。胰蛋白酶:批号为6C157D25,购自南京生兴生物技术有限公司。VEGF:批号为1207CY08-1,购自PeproTech公司。低温离心机(型号:1-15K,Sigma Corporation);酶标仪(型号:1500,Mullikan Spectrum);超净台(型号:SW-CJ-IF,苏州安泰空气技术有限公司);细胞培养箱(型号:3111,Thermo Electron Corporation);荧光倒置显微镜(型号:IX51,Olympus)。
1.2 实验样本
人脐静脉内皮细胞(HUVECs)细胞株,购自中国科学院细胞库。
1.3 HUVECs 的分离与培养
将HUVECs 细胞株从液氮中取出后,常规复苏,使用含20%新生小牛血清的M199 培养液(M199 完全培养液),于37℃、5%CO2的细胞培养箱中培养。24 h后换完全培养液除去未贴壁细胞。待细胞长成单层铺满培养瓶后,用0.25%胰蛋白酶消化,传代,M199 完全培养液培养。倒置显微镜下观察可见培养的HUVECs呈现铺路石样单层排列。
1.4 噻唑兰(MTT)法测定PF 对HUVECs 活力的影响
取对数生长期的HUVECs,接种到包被有1%明胶的96 孔板中,M199 完全培养液、37℃、5%CO2孵育培养12 h。将各实验孔分为空白组、PF 不同剂量(1、3、10、30、100 μmol/L)组,每组做3 个复孔,72 h 后每孔加入20 μL 浓度为5 mg/mL 的MTT 溶液,继续培养4 h,每孔加入200 μL 二甲基亚砜,待结晶物充分溶解后,测定λ=570 nm 的吸光度,实验重复3 次。细胞活力(%)=实验组吸光度/空白组吸光度×100%。
1.5 MTT 法测定PF 对VEGF 所致HUVECs 细胞活力的影响
取对数生长期的HUVECs,接种到包被有1%明胶的96 孔板中,用M199 完全培养液、37℃、5%CO2、孵育培养12 h,将各实验孔分为空白组、模型组、PF不同剂量(1、3、10、30、100 μmol/L)组,每组做3 个复孔,除空白组外,其他组均给予10 ng/mL 的VEGF,给药组同时给予不同剂量的PF(1、3、10、30、100 μmol/L),空白组、模型组给予同体积的药物溶媒,继续培养72 h,每孔加入20 μL 浓度为5 mg/mL 的MTT 溶液,继续培养4 h。每孔加入200 μL 二甲基亚砜,待结晶物充分溶解后,测定λ=570 nm 的吸光度,实验重复3 次。
1.6 PF 对VEGF 引起的HUVECs 小管形成的影响
在24 孔板中加入200 μL/孔的基质胶,取对数生长期的HUVECs,以1×105个/孔接种到该24 孔培养板中,分为空白组、模型组、PF 不同剂量(1、3、10、30、100 μmol/L)组,每组做3 个复孔,各组均用M199 培养液正常培养,除空白组外,其他组均给予10 ng/mL VEGF,给药组同时给予不同剂量的PF(1、3、10、30、100 μmol/L),空白组、模型组给予同体积的药物溶媒,每组做3 个复孔,24 h 后用倒置显微镜100 倍率下观察细胞小管形成情况,随机选择每组的5 个区域,成像小管形成情况。实验重复3 次。
1.7 PF 对VEGF 所致HUVECs 迁移的影响
取对数生长期的HUVECs 接种到24 孔板中,待细胞生长达90%融合后,采用20 μL Tip 头沿孔的中央在纵轴方向做划痕,构建单层融合细胞划痕创伤模型,用磷酸盐缓冲液冲洗2 遍以去除刮起的漂浮细胞。将各实验孔分为空白组、模型组、PF 不同剂量(1、3、10、30、100 μmol/L)组,每组做3 个复孔,所有实验组均用M199 培养液正常培养,除空白组外,其他组均给予10 ng/mL VEGF,给药组同时给予不同剂量的PF(1、3、10、30、100 μmol/L),空白组、模型组给予同体积的药物溶媒,37℃、5%CO2培养,在0、24 h用倒置显微镜100 倍率拍照记录,实验重复3 次。
1.8 统计学方法
采用SPSS 17.0 对所得数据进行统计学分析,计量资料采用均数±标准差()表示,多组间比较采用单因素方差分析,两两比较采用LSD-t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 PF 对HUVECs 细胞活力及对VEGF 所致HUVECs细胞活力的影响
与空白组比较,不同浓度PF(1、3、10、30、100 μmol/L)对HUVECs 的细胞活力影响差异无统计学意义(P >0.05)。见图1A。VEGF 作用后的模型组的细胞活力显著高于空白组,差异有高度统计学意义(P <0.01)。与模型组比较,不同浓度PF(1、3、10、30、100 μmol/L)对VEGF所致的HUVECs 细胞活力升高的影响差异无统计学意义(P >0.05)。见图1B。
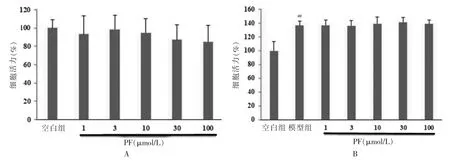
图1 PF 对HUVECs 细胞活力及对VEGF 所致HUVECs 细胞活力的影响
2.2 PF 对VEGF 引起的HUVECs 小管形成的影响
与空白组比较,模型组的HUVECs 24 h 后在基质胶上形成类似毛细血管管腔的结构。1 μmol/L PF 作用24 h 后,除HUVECs 形成闭合的管腔数量减少外,已形成管腔的宽度和长度减少。3、10 μmol/L PF 作用24 h 后,形成的管腔不完整。30、100 μmol/L PF 作用24 h 后,对HUVECs 形成管腔的能力的抑制更显著,视野中几乎没有完整且闭合的管腔形成。见图2。

图2 PF 对VEGF 所致HUVECs 小管形成的影响(100×)
2.3 PF 对VEGF 所致的HUVECs 迁移的影响
与空白组比较,模型组24 h 内向划痕区域迁移的细胞数量增多,划痕宽度缩小。与模型组比较,10、30、100 μmol/L PF 剂量组24 h 内向划痕区迁移入的HUVECs 的数量减少,划痕宽度缩小。见图3。模型组24 h 划痕宽度/0 h 划痕宽度比值显著低于空白组,差异有高度统计学意义(P <0.01)。10、30、100 μmol/L PF 剂量组24 h 划痕/0 h 划痕宽度均显著高度模型组,差异均有高度统计学意义(均P <0.01)。见图4。
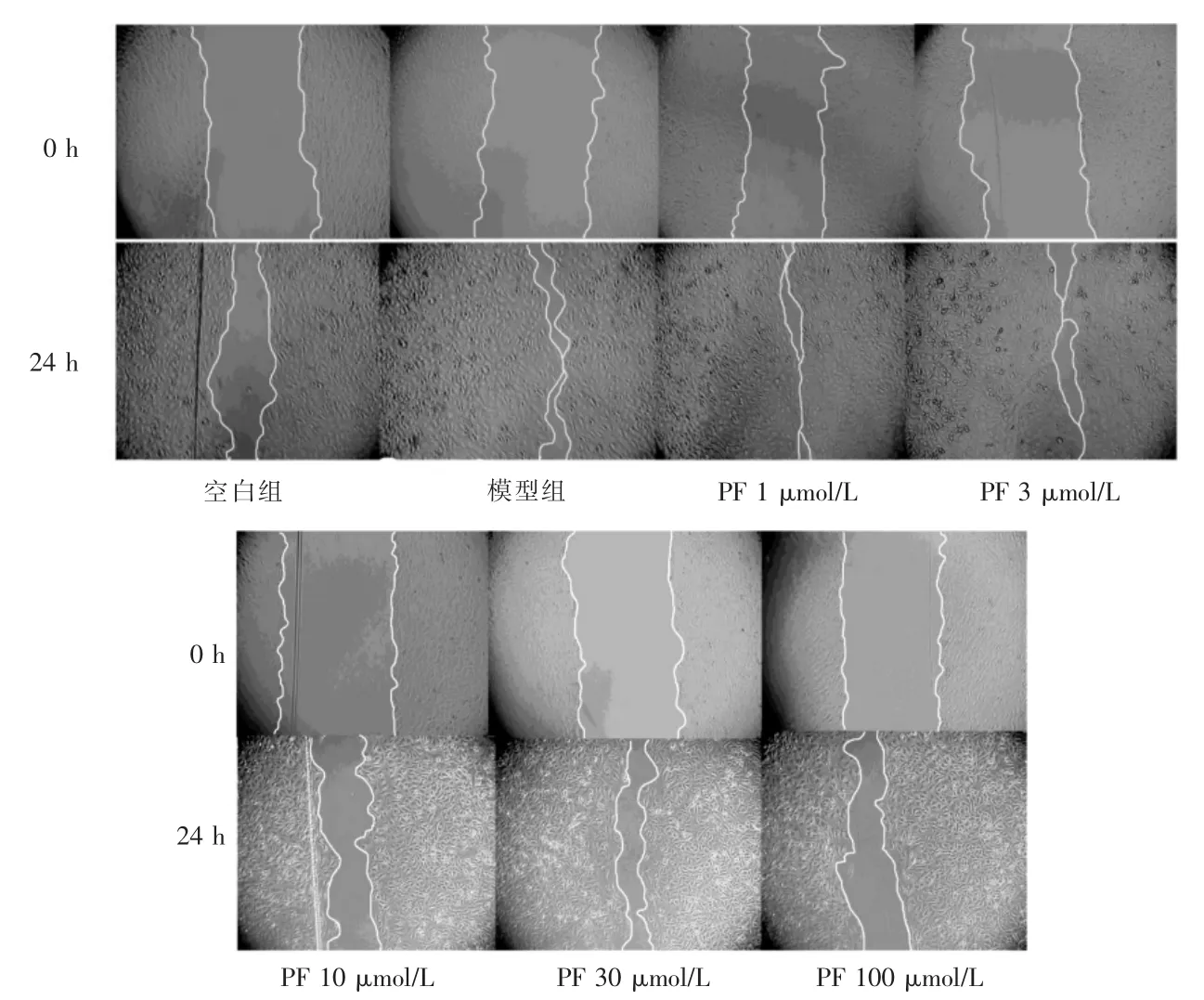
图3 PF 对VEGF 所致的HUVECs 迁移的影响(100×)

图4 PF 对VEGF 引起的HUVECs 迁移的影响
3 讨论
正常情况下,血管生成是一个受到严格调控的过程。在病理状态下,血管生成主要发生在类风湿性关节炎[13]、固体肿瘤和动脉粥样硬化[14-15]等疾病的发展过程中。以类风湿性关节炎为例,呈低氧状态的关节腔内微环境会促进血管新生活性因子(如VEGF)的生成,同时患者的血清中亦有较高浓度的VEGF,且伴随该病的发生发展[16-17]。新生的血管在类风湿性关节炎患者的关节腔内形成血管翳,后者为增生的滑膜细胞提供营养物质,同时也促进了炎症细胞对滑膜的浸润。此外,新生血管形成与肿瘤的发展关系密切,除有助于肿瘤细胞的增殖使瘤体增大外,亦能为后继的血行转移提供条件[18]。在此过程中,VEGF、碱性成纤维生长因子(bFGF)、表皮生长因子受体(EGFR)、基质金属蛋白酶(MMP)、肿瘤坏死因子-α 等表达增高,是诱发新生血管形成,促进瘤体快速增长,以及促进肿瘤血行转移的重要因素[19-21]。在上述疾病状态下,有效抑制病灶部位新生血管生成是控制疾病发展的重要治疗手段。
VEGF 发挥作用主要依赖于VEGF 受体(VEGFR),后者广泛分布于血管内皮细胞膜上,主要包括VEGFR-1 和VEGFR-2,其中VEGFR-1 在肿瘤相关血管生成中发挥重要作用[22-23]。体内研究表明,VEGF 可增加血管通透性,使血浆蛋白渗漏和血管外基质发育,为血管内皮细胞生长提供条件[24]。但高浓度的VEGF 诱导生成的新生血管结构与正常血管不同,会有不规则的形状、扩张和盲端[25],此类异常形成的新生血管加剧了疾病的恶化进程。
本研究使用VEGF 作为刺激因子,考察PF 对HUVECs的增殖、小管形成及迁移的作用。结果显示,1、3、10、30、100 μmol/L 的PF 对HUVECs 活力及对VEGF引起的细胞活力升高均无显著影响,但均能抑制由VEGF 引起的小管形成,且10、30、100 μmol/L 的PF 能够抑制VEGF 诱导的HUVECs 的迁移,提示PF 抑制血管生成的作用主要通过抑制内皮细胞引起的小管重排和迁移实现。进一步的研究将关注PF 对VEGFR相关信号通路的调控作用,以阐释PF 抑制血管生成的具体机制。
