某牛场奶牛产后败血症的细菌分离鉴定与药敏试验
2021-06-24金圣子关桐旭
牟 婧,金圣子,关桐旭,雷 磊,刘 云
(东北农业大学动物医学学院,黑龙江哈尔滨 150030)
奶牛产后败血症就是由于产后发生细菌感染,细菌入侵血液大量繁殖引起的全身性疾病。其多发于产后1周内,发热,精神沉郁,食欲减退,快速消瘦,瘤胃蠕动减弱,严重者会导致死亡。
大肠埃希氏菌在全球范围内都广泛存在,可引起奶牛乳房炎、犊牛腹泻、子宫内膜炎等多系统疾病。大肠埃希氏菌在奶牛产后败血症中也十分多见,奶牛产后能量消耗巨大,抵抗力低,且很多奶牛在生产前就已存在慢性感染,加之产后体质虚弱,极易导致炎症扩散,从慢性感染发展为危害生命的严重感染,给奶牛养殖业造成巨大损失[1]。
沙雷氏菌是一种主要存在于土壤、水体中的一种条件致病菌,可引发鱼类、昆虫、奶牛等多种动物疾病[2]。在20世纪90年代初有外国学者系统统计了沙雷氏菌引起奶牛乳房炎的发病情况,其多与大肠埃希氏菌、沙门氏菌、金黄色葡萄球菌混合感染,严重影响牛奶产量[3]。除奶牛本身存在沙雷氏菌感染外,在生产过程中,没有对术野进行彻底消毒,手术器械未经彻底消毒,粗暴助产等等都容易引起细菌感染,再加上术后护理不到位,未能及时发现病情,由沙雷氏菌局部感染后扩散引起的菌血症也时有报道。
目前细菌耐药已成为全球关注的卫生安全问题,很多牛场依赖抗生素解决牛场中的动物疾病,但却忽视了科学给药,造成了严重的细菌耐药情况,所以如何有效的治愈疾病但却可以最大程度避免耐药性的产生已经成为牛场需要解决的难题,也成为关于细菌研究的热点内容,科学给药,防止耐药菌的产生,不仅关乎动物健康、牧场利益,更关乎公共卫生安全和生态安全[4-5]。
本试验根据某牛场出现奶牛产后严重感染,导致多头母牛死亡,通过对病死牛剖检采取相关病料进行病原菌的分离与鉴定并对致病菌进行药敏试验,对发病牛进行疾病诊断及合理治疗提供依据。
1 材料与方法
1.1 材料
1.1.1 病料 某牛场病死产后母牛,采取其肝脏、肺脏、心房、肠管、子宫肉阜等器官和乳汁。低温保存送至实验室检验。
1.1.2 实验动物 哈尔滨医科大学附属第二医院动物实验中心购买5周龄昆明鼠55只。
1.1.3 培养基及试剂 麦康凯琼脂、伊红美蓝琼脂、MHA培养基,博奥星公司产品;血琼脂培养基,博赛公司产品;细菌基因组提取试剂盒,天根生化公司产品;DNA Marker、DNA聚合酶、dNTP,宝日医公司产品;核酸染料Gel-red,兰杰柯公司产品;微生物药敏试纸,康泰公司产品。
1.1.4 主要仪器 超净工作台(SW-CJ-2FD),上海博讯医疗设备厂产品;梯度PCR仪(C1000),美国BIO-RAD公司产品;琼脂糖水平电泳槽(DYCP-31DN),北京六一生物科技有限公司产品;恒温摇床(THZ-300),上海一恒科技仪器有限公司产品;恒温培养箱 (DRP-9162),上海森信有限公司产品。
1.2 方法
1.2.1 临床症状观察及剖检记录 观察该牛场发病牛的临床症状并进行记录;剖检发病死亡的母牛,观察内脏病变,采取病料并进行记录。
1.2.2 病原的分离鉴定 将肝脏、肺脏、心房、肠管、子宫肉阜的样品取其切面或内容物涂布到麦康凯琼脂、血琼脂和伊红美蓝琼脂上,逐步进行画线分离培养,同时进行革兰氏染色。
将纯化的菌株的培养液送至吉林库美生物科技有限公司进行16S rRNA测序,测序结果NCBI进行blast同源性比较。
1.2.3 毒力基因检测 用PCR检测分离出的大肠埃希氏菌黏附素(K88、K99、F17、F41、bfpA、CS31A)、毒素(STa、STb、Stx1、Stx2、hlyA)及毒力岛(eaeA、Irp2)共13种基因的检测。
1.2.3.1 DNA模板的制备 取各分离株1 mL菌液,用细菌基因组提取试剂盒进行分离株DNA的提取,将提取到的DNA保存于-20℃冰箱备用。
1.2.3.2 毒力基因引物的设计与合成 根据文献[6-7]中提供的各个毒力基因的序列设计引物,送至吉林库美生物科技有限公司进行引物合成。引物相关信息见表1。

表1 引物序列信息
1.2.3.3 PCR扩增毒力基因 以制备好的分离株DNA为模板,配置PCR扩增体系25 μL进行扩增,在PCR完成后,以进行琼脂糖凝胶电泳,在凝胶图像处理系统中拍照检查。
1.2.4 牛场饮用水水质检测 将送检的7个样品,在超净台中每个样品各取100 μL分别接种于NB培养基和麦康凯培养基上,用涂布棒涂抹均匀。37℃恒温培养18 h,分别进行总菌落数计数和大肠埃希氏菌菌落计数。
1.2.5 大肠埃希氏菌同源性检测
1.2.5.1 同源性检测引物的设计与合成 设计1对用于大肠埃希氏菌同源性检测的随机引物(5′-GAACGCTGCC-3′),送至吉林库美生物科技有限公司合成。
1.2.5.2 PCR扩增检测同源性 根据1.2.3.1的方法提取病料和饮用水中分离出的大肠埃希氏菌分离株的DNA,以其为模板进行PCR扩增,在PCR扩增完成后,进行琼脂糖凝胶电泳,在凝胶图像处理系统中拍照检查。
1.2.6 分离菌株的致病性试验 取55只6周龄的昆明鼠,每组5只,将其随机分为11个组,10个组为试验组,1个组为对照组。对试验组昆明鼠每组腹腔注射菌悬液0.2 mL(5×109CFU/mL),对照组腹腔注射0.2 mL无菌生理盐水,观察1周内小鼠的发病及死亡情况,进行统计。
1.2.7 药敏试验 将各分离株用生理盐水校正至0.5麦氏比浊管浓度,用无菌棉拭子蘸取菌液均匀地涂抹在Mueller-Hinton琼脂平板的整个表面。针对12种药物进行药敏试验。贴有药敏片的Mueller-Hinton琼脂平板于37℃、静置培养12 h,用游标卡尺测量抑菌环直径,以标准菌株ATCC25922和ATCC25923为对照,根据NCCLS标准判断结果。
2 结果
2.1 临床症状观察及剖检
先后将4头产后2 d至20 d的病死牛进行剖检,死前全身消瘦,脱水,发热,呼吸困难,病死牛心、肝、肺、肠管、子宫均出现不同程度的出血坏死,胸壁黏连,部分病死牛肝肺呈绿色,肠道臌胀,有血样乳汁。
2.2 病原菌的分离
病料经多次划线分离培养,分离出8株在麦康凯上形成中等大小的粉红色菌落,在伊红美蓝培养基上显示出金属光泽的菌落。经革兰氏染色后镜检,可见其为形状短粗的革兰氏阴性杆菌。经16S rRNA测序,鉴定出以上8株菌均为大肠埃希氏菌。在其中1头病死牛的乳样中,分离出1株细菌,其在麦康凯培养基上形成中等大小的粉红色菌落,在伊红美蓝培养基上形成透明菌落,无金属光泽,在血琼脂培养基上产生溶血环,经革兰氏染色后镜检,可见其为革兰氏阴性杆菌。经16S rRNA测序,鉴定出此菌为沙雷氏菌。在其中另1头病死牛的乳汁样品中。分离出1株在血琼脂平板上有溶血环的细菌,革兰氏染色镜检发现是呈葡萄串状的阳性球菌,经16S rRNA菌种鉴定为产色葡萄球菌。
2.3 大肠埃希氏菌毒力基因的检测
在8株大肠埃希氏菌中,有1株检出hlyA(图1)和STb(图3)两种毒力基因;另有2株均检出毒力基因F17(图2),其他毒力基因检测结果均为阴性。9号为阳性对照。

M.DNA 标准 DL2 000;1~8.分离株1~8;9.阳性对照
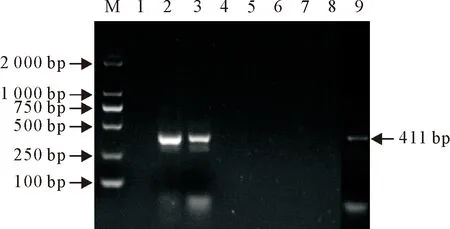
M.DNA 标准 DL2 000; 1~8.分离株1~8; 9.阳性对照
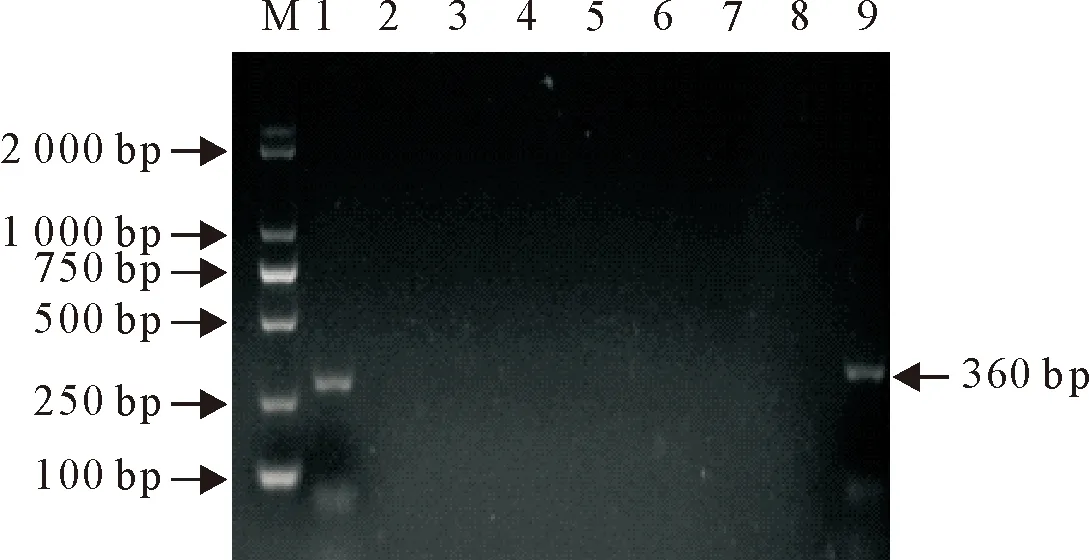
M.DNA 标准 DL2 000; 1~8.分离株1~8;9.阳性对照
2.4 牧场水质检测
总菌数检测结果表明,7个送检水样的菌落数均远大于300个,多至不可计数,根据我国《生活饮用水水质标准》(GB5749-2006)中规定饮用水菌落总数不得大于100 CFU/mL,此总菌落数检测结果,远远大于国家标准限量。大肠埃希氏菌数检测结果表明,7个水样大肠埃希氏菌菌落数分别为700 CFU/mL、60 CFU/mL、210 CFU/mL、10 CFU/mL、780 CFU/mL、60 CFU/mL、90 CFU/mL。根据我国生活饮用水水质标准(GB5749-2006)中规定饮用水大肠埃希氏菌数为每100 mL不得检出。故可看出,该牧场牛的饮用水中大肠埃希氏菌数量也严重超标。
2.5 大肠埃希氏菌同源性检测
病料中分出的8株大肠埃希氏菌均有较高同源性,其中2、3同源性比对结果基本一致,4、5、6同源性结果相似度也很高(图4)。饮用水中分离出的疑似大肠埃希氏菌的菌株与病料中分离出的大肠埃希氏菌均不具有同源性,且饮用水中分离出的12株菌之间有较低同源性(图4)。
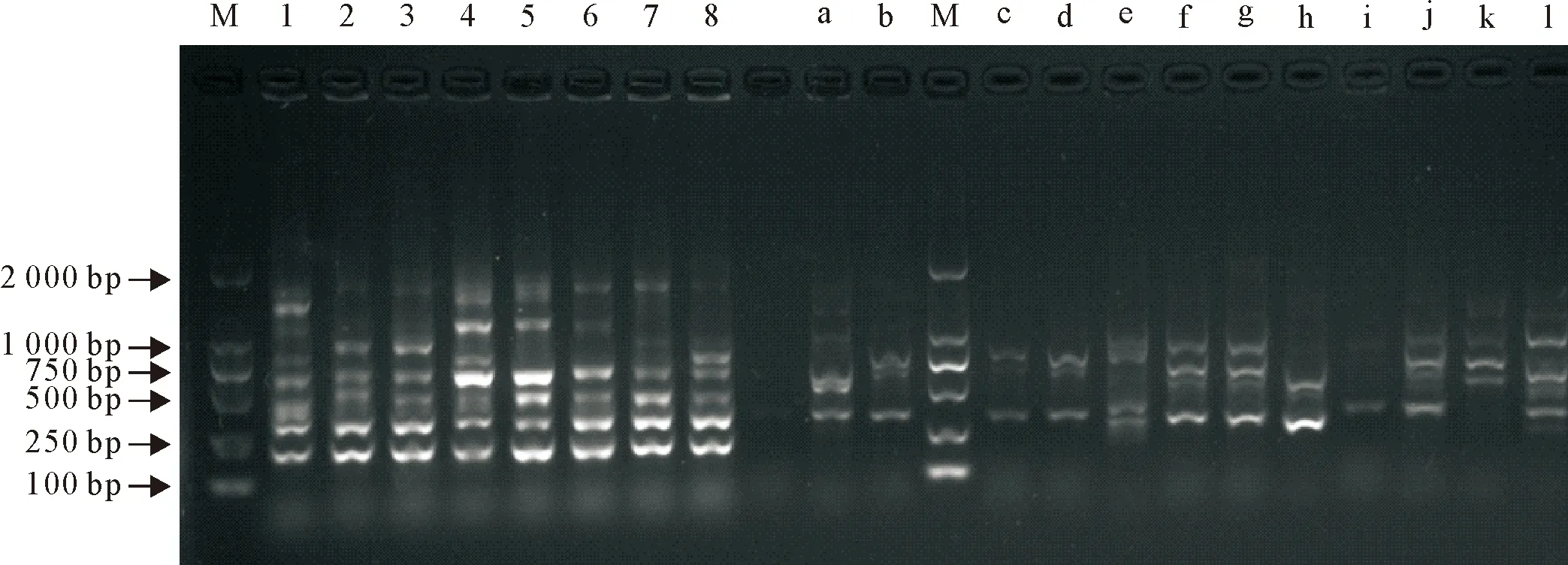
M.DNA 标准 DL2000;1~8.分离株1~8;a~l.来自饮用水中的分离株 a~lM.DNA Marker DL2000;1-8.Isolates 1-8;a-l.Isolates in drinking water a-l
2.6 致病性检验
接种大肠埃希氏菌的小鼠共8组,每组5只。第1组12 h内有2只死亡,72 h内又有1只死亡,其余存活下来的小鼠被毛凌乱,精神萎靡;第2、3组在12 h内有2只死亡,24 h内又有1只死亡;第6组在72 h内有1只死亡;以上4组死亡的小鼠,均不同程度的出现腹泻、眼部分泌物增多的症状。第4、5、7、8组没有小鼠死亡,但大部分小鼠被毛凌乱,不思饮食,96 h之后小鼠基本恢复正常。剖检病死小鼠,可观察到心脏、肺脏、胃肠道出血。接种沙雷氏菌的小鼠有1组,共5只。在24 h内有3只小鼠死亡,其余小鼠被毛凌乱、闭眼、活动力下降。接种产色葡萄球菌的小鼠有1组,共5只。在12 h内有2只小鼠死亡。
2.7 药敏试验结果
本试验用14种药物对分离出的8株大肠埃希氏菌,1株沙雷氏菌,1株产色葡萄球菌进行了药敏试验。试验结果见表2和表3。
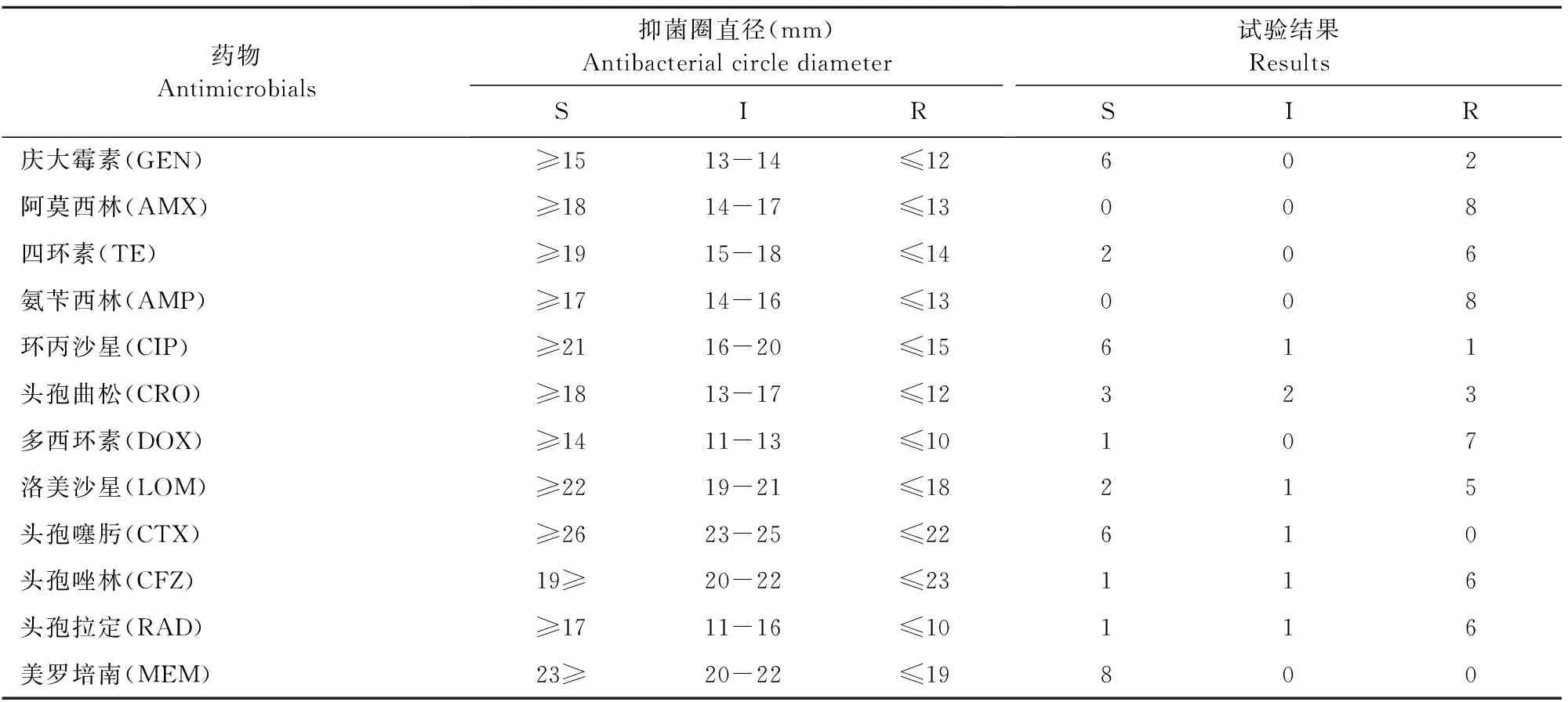
表2 大肠埃希氏菌药敏试验结果
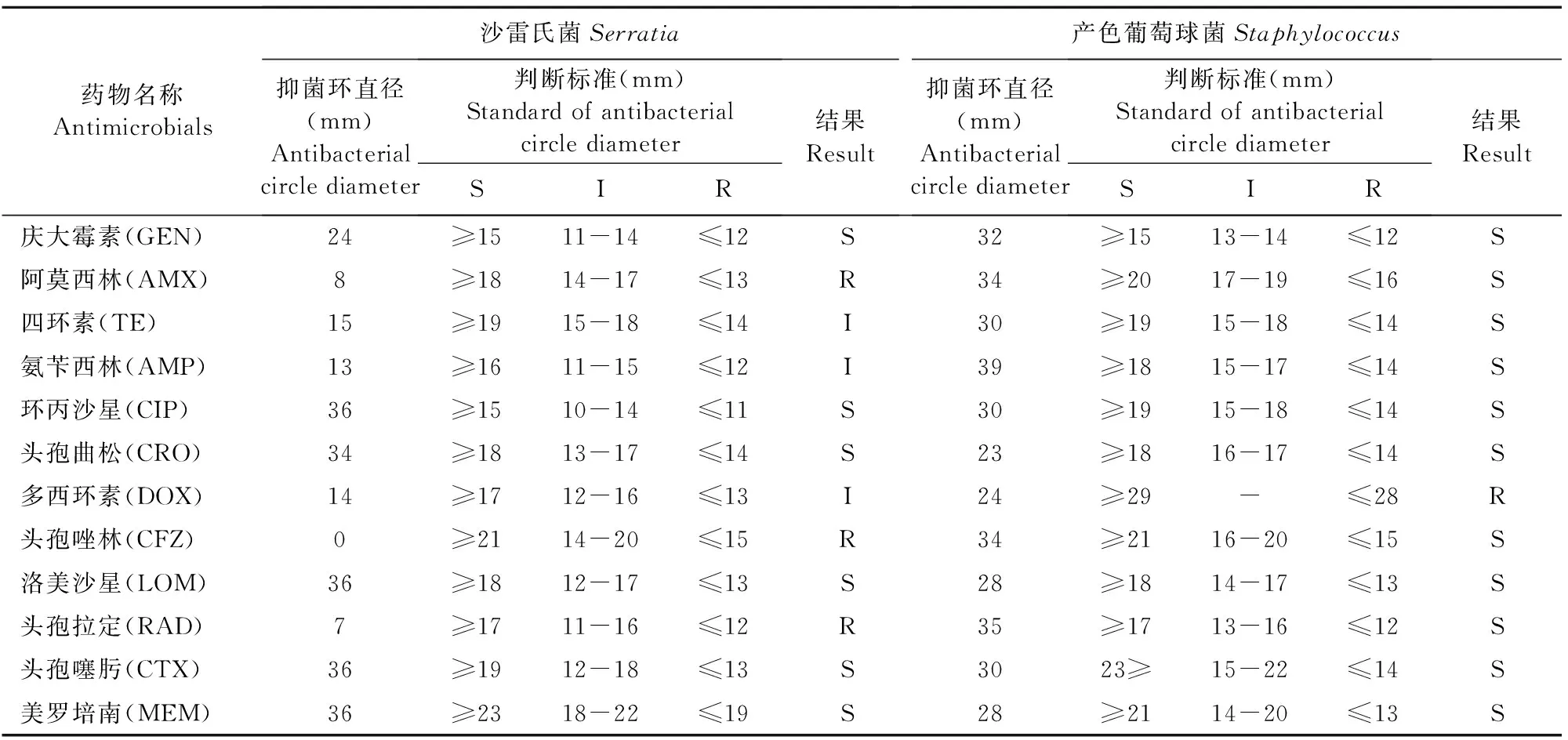
表3 沙雷氏菌和产色葡萄球菌药敏试验结果
3 讨论
本次牧场出现的母牛产后败血症,经临床诊断和实验室诊断,判断其因为产前本就存在大肠埃希氏菌、沙雷氏菌、产色葡萄球菌中的一种或几种导致的乳房炎,且在生产过程中没有严格消毒,造成母牛子宫发生感染,加上产后母牛免疫力下降,局部炎症迅速扩散,导致严重的全身性感染,且发现不及时,病情发展迅速,未能来得及给出及时有效的治疗方案,最终导致母牛因感染死亡。
在实验室检查中,共分离出8株大肠埃希氏菌、1株沙雷氏菌和1株产色葡萄球菌。在8株大肠埃希氏菌中,有1株检出hlyA和STb两种毒力基因;另有2株均检出毒力基因F17,且都具有相较于其他菌株较强的致病力。尽管大肠埃希氏菌并非乳腺的正常菌群,但由于大肠埃希氏菌广泛地存在于牛的生活环境中,很多牛场还是存在乳腺炎的慢性感染。在剖检牛的过程中发现部分牛有乳汁中带血的症状,而细菌从机体的其他部分通过血液循环和淋巴系统转移到乳房进行感染是极为少见的[8],故排除此种情况,我们认为是乳房本就存在细菌感染,而后由于产后免疫力降低而发生扩散。关于奶牛的乳腺炎,已有丰富的研究资料可以证明,乳腺感染易发于奶牛干乳期的后2周和产犊前的2周时间内[9],所以我们建议牧场,在此期间一定注意奶牛的健康状态,提供更加干净的生存环境。
除了剖检过程中发现子宫出现感染坏死外,牧场的其他同期生产的母牛中也有发现子宫感染的症状,推断可能在生产过程中,存在手术器械消毒不彻底,生产环境卫生较差或暴力助产的情况。这种情况在实际生产的过程中常见,有国外学者对奶牛产后出现子宫感染的病例做了统计发现:有36%~50%的动物在产后发生明显子宫感染的症状,Benzaquen M E的研究表明有18.5%和21%的动物有典型的全身感染的症状,还有很多产后感染处于亚临床状态,并未引起人们的察觉,但其危害同样不可小觑[10]。
在药敏试验方面,我们通过K-B法进行筛选,最终选择了庆大霉素和美罗培南用于该场的治疗。通过药敏试验,发现该场的大肠埃希氏菌存在较为严重的耐药情况。2019年,Hutchings M I的报道中也提到细菌耐药的问题。截止至2018年12月,在美国有45种抗生素正在进行临床阶段的研究,但针对广泛耐药的革兰氏阴性菌,目前新抗生素的研发依然是杯水车薪[11]。我国牧场的情况也是如此,由于耐药菌的不断产生,抗生素的选择余地越来越小,我们只有努力控制好牧场的病情,少发病少用药,对于已经患病的动物合理科学给药,在能在最大程度上减慢耐药菌的产生进程。
另外,牧场水质在细菌总数和大肠埃希氏菌数两方面严重超标,虽然没能在饮用水中找到使奶牛患病的致病菌,但奶牛生存环境细菌密布,这将对动物的安全产生各方面的威胁,有国外学者进行了挤奶用毛巾上的细菌数量与奶牛乳房炎的相关研究[12],近年来也有不少关于水质、土壤以及饲养人员对耐药菌产生的影响。这也说明了动物的生存环境对于保持健康以及减少耐药菌的产生十分重要[13]。
从此次发病牧场的情况来看,牧场动物健康的管理,不能依赖于疫苗和药物,要更多地从改善动物生存环境出发,从根源上减少患病的可能,这才是形成良好的牧场环境,延缓耐药菌形成,维持动物健康和获得良好经济效益的根本之策。
