N-豆蔻酰基转移酶在大肠埃希氏菌中的表达、纯化及活性检测
2021-06-24王苗苗卢渊录郭慧琛孙世琪闻晓波
王苗苗,董 虎,卢渊录,郭慧琛,孙世琪*,闻晓波
(1.黑龙江八一农垦大学动物科技学院,黑龙江大庆 163319;2.中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,国家口蹄疫参考实验室,甘肃兰州 730046;3.海南大学动物科技学院,海南省热带动物繁育与疫病研究重点实验室,海南海口 570228)
豆蔻酰化是指在细胞信号转导、蛋白相互作用、蛋白靶向内膜和质膜系统等方面发挥重要作用的一种蛋白脂质修饰[1],参与细胞增殖、分化、存活和凋亡等不同生理过程[2-5]。N-豆蔻酰基转移酶(N-myristoyltransferase,NMT)可以催化蛋白发生豆蔻酰化,其催化作用是一个不可逆的酰化过程。NMT对许多生物的生长和存活至关重要。NMT是寄生虫必不可少的酶,已证实NMT是针对寄生虫潜在的药物靶标[6-7],例如布氏锥虫、利什曼原虫、杜氏利什曼原虫和恶性疟原虫[8-9]。NMT也被鉴定为白色念珠菌的新型抗真菌靶标。Shrivastav A等研究表明,NMT对调节先天性和适应性免疫反应以及人类免疫缺陷病毒感染至关重要[10],N-豆蔻酰化的脊髓灰质炎病毒衣壳蛋白VP4的定点突变的研究表明,肉豆蔻酸参与病毒衣壳蛋白组装,对小RNA病毒复制组装及感染性病毒颗粒的装配至关重要。
省民族宗教委举办2018年清真食品安全监管和公民民族成份登记管理业务专题培训班 11月6日至7日,省民族宗教委举办2018年清真食品安全监管和公民民族成份登记管理业务专题培训班,来自全省16个州市、129个县(市、区)民宗委(局)的业务负责人共140余人参加培训,省民族宗教委副主任陆永耀出席开班动员会。
NMT的催化是一个共翻译的过程,在真核表达系统中已证实豆蔻酰化修饰可提高病毒蛋白的组装效率,而大肠埃希氏菌缺少翻译后的修饰,也无NMT活性,因此,在大肠埃希氏菌里表达的蛋白要与NMT共表达才能达到豆蔻酰化修饰的目的。大肠埃希氏菌具有生长速度快、代谢途径和机制较清楚及遗传操作简单等优点,便于制备蛋白,因此本研究将hNMT1基因,克隆至pRSFDuet1原核表达载体,在大肠埃希氏菌中诱导表达豆蔻酰基转移酶,优化其在大肠埃希氏菌中的表达条件,并通过Ni2+亲和层析进行纯化,采用基于7-二乙胺基-3-(4-马来酰亚胺-苯基)-4-甲基香豆素(7-diethylamino-3-(4-maleimidophenyl)-4-methylcoumarin,CPM)检测CoA的荧光法测定hNMT1活性,为下一步探究在大肠埃希氏菌表达系统中豆蔻酰化对小RNA病毒样颗粒组装效率奠定研究基础。
1 材料与方法
1.1 材料
1.1.1 质粒、菌株及抗体 原核表达载体pRSFDuet1及含有N-豆蔻酰基转移酶的pUC57-hNMT1、口蹄疫病毒VP1、VP4蛋白,由兰州兽医研究所兽用纳米材料与应用团队保存;大肠埃希氏菌感受态细胞E.coliBL21-CodenPlus(DE3)-RIL、E.coliTrans5α,宝生物工程(大连)有限公司产品;鼠源抗His单抗、辣根过氧化物酶标记的兔抗鼠IgG,Sigma公司产品。
1.1.2 主要试剂 限制性内切酶BamHⅠ、EcoRⅠ,NEB(北京)有限公司产品;连接酶SolutionⅠ、PCR扩增高保真酶,TAKARA公司产品;Plasmid Mini KitⅠ(200)、Gel Extract Kit(200),OMEGA公司产品;胰蛋白胨、酵母粉,OXOID公司产品;卡那霉素、氯霉素、IPTG和咪唑,北京索莱宝公司产品;DNA分子质量标准,北京全式金生物技术有限公司产品;蛋白分子质量标准,SMOBIO产品。
1.1.3 主要仪器 PCR仪(PTC-200),美国Bio-Rad公司产品;电泳仪(PowerPac Uniwersal),美国Bio-Rad公司产品;凝胶成像分析仪(WD-9413B),北京市六一生物科技有限公司产品;超微量分光光度计(nanodrop 2000 c),美国Thermo Fisher Scientific公司产品;蛋白染色仪(L02016 PD-00452),南京金斯瑞生物科技有限公司产品;pH计(FE20K),梅特勒-托利多仪器有限公司产品;超声波细胞粉碎机(SCIENTZ-IID),宁波新芝生物科技股份有限公司产品;全自动化学发光成像分析系统(Tanon 5200),上海天能科技有限公司产品;全波长酶标仪(3020),芬兰Thermo Fisher Scientific Oy公司产品。
1.2 方法
1.2.7 hNMT1的活性检测 使用96孔酶标板,每孔加入基础缓冲液(5 g/L EGTA、pH7.5的20 mmol/L磷酸钾、5 g/L EDTA、1 mL/L TritonX-100),然后加入不同浓度的hNMT1并与缓冲液混合,随后避光加入15 mmol/L的CPM与5 mmol/L的豆蔻酰CoA,最后加入10 mmol/L的VP4蛋白,空白对照中加入10 mmol/L的VP1蛋白作为阴性对照,各3个重复,室温避光反应30 min,运用多功能全波长酶标仪检测384 nm激发波下470 nm发射波长对应的荧光强度。
反冲质子磁谱仪的性能模拟结合了中子探测和反冲质子的动量分析等物理过程。首先,根据中子与反冲聚乙烯靶相互作用机理,采用蒙特卡罗方法模拟不同能量的中子在聚乙烯靶中的输运过程,获得反冲质子的能量和角分布;其次,以束流光学计算为基础,模拟反冲质子在磁分析单元中的色散、偏转和聚焦过程;最后,获得反冲质子在焦平面上的空间分布。模拟计算主要分为5个过程:
土壤样品全部采自贺州市荸荠地的0~20 cm表层土壤。每个采样点用五点法采集,除去动植物残体、石砾等杂物,并将大块样品捻碎混合均匀后,用四分法选取1 kg土样,共28份。土壤样品带回实验室,风干、研磨,分别过20和100目尼筛,并保存于玻璃瓶中备用。
比较两组病患治疗前后糖化血红蛋白数值变化,显示两组均有改善,观察组改善程度相对更明显(p<0.05),详见表一。
1.2.5.3 目的蛋白可溶性表达的温度优化 过夜培养的确定表达的菌液以1%比例接种至含有50 μg/mL卡那霉素、34 μg/mL氯霉素的5 mL培养基中,按照上述确定的诱导时菌浓度及IPTG浓度,分别于37℃、25℃和16℃中过夜表达,各取1 mL菌液离心后用适量PBS重悬,置于冰水浴中超声破碎,破碎后4℃离心,各取上清和沉淀经SDS-PAGE分析各温度下的可溶性蛋白的表达情况。
1.2.5.2 诱导剂浓度的优化 将确定表达过夜培养的菌液1∶100转接至5 mL培养基中,振荡培养至经优化所得的菌浓度时分别加入终浓度为0.05 mmol/L、0.2 mmol/L、0.4 mmol/L、0.6 mmol/L、0.8 mmol/L、1.0 mmol/L和1.5 mmol/L的IPTG,37℃表达4 h,SDS-PAGE分析蛋白的表达量,确定最佳诱导剂量。
1.2.4.1 hNMT1的诱导表达 将测序正确的质粒和空载体pRSFDuet1分别转入表达菌E.coliBL21-CodenPlus(DE3)-RIL中,各挑取单菌落于3 mL LB培养基(卡那霉素终浓度为50 μg/mL、氯霉素34 μg/mL)中培养,待OD 600 nm 值至0.8左右,加入终浓度为1.0 mmol/L的IPTG于37℃诱导表达4 h,取1 mL菌液10 000 r/min离心2 min,用100 μL PBS重悬菌体,空载体作为对照,经SDS-PAGE验证目的蛋白的表达。
1.2.4.2 hNMT1的Western blot鉴定 将表达的蛋白经12% SDS-PAGE后转移至硝酸纤维素膜(Nitrocellulose,NC)上,用50 g/L脱脂乳-TBST室温封闭1 h,加入1∶1 000稀释的抗his标签的鼠源单克隆抗体,4℃过夜孵育,TBST洗涤5次,加入1∶3 000稀释的HRP标记的兔抗鼠IgG,室温孵育1 h,TBST洗涤5次,加入ECL发光液避光反应1 min,利用Tanon 5 200全自动化学发光成像分析系统显示结果。
在当代水墨画坛,林容生的艺术风格十分鲜明,他在山水画上一方面悉心研究文人画传统,着重体悟传统绘画在表现精神性、书卷气上的品质,一方面勤奋地走向自然,在大量的写生中锤炼自己的笔墨语言,从而使画中的“生活”和笔墨的“格调”二者相得益彰,焕发华采。
1.2.5 hNMT1蛋白表达条件的优化
1.2.5.1 加入IPTG诱导时细菌浓度的优化 将确定表达的菌液过夜培养,次日以1∶100比例转接至5 mL培养基中,37℃振荡培养至OD 600 nm值分别在0.5、0.6、0.7、0.9、1.0和1.2时加入同等浓度的IPTG于37℃中进行诱导表达4 h,各取1 mL菌液离心并重悬菌体,经120 g/L SDS-PAGE分析确定诱导时细菌最佳浓度。
除了机遇,周边景区也对庐山西海的客源市场有较大的竞争力(例如庐山,星子,黄山等具独特的文化旅游资源的景点)。在全国都在加大旅游开发的形势下,庐山西海风景区还要面临来自中部地区旅游景区的竞争。除此之外,地方保护主义和地域的条块分割等弊端也会对庐山西海风景区的客源有一定的分流。
1.2.4 hNMT1蛋白的表达鉴定
1.2.3 重组质粒pRSFDuet1-hNMT1构建 胶回收后产物及pRSFDuet1载体分别经限制性内切酶BamHⅠ/EcoRⅠ在37℃酶切2 h后,胶回收纯化相应片段,Nano Drop One测定DNA浓度,经SolutionⅠ 16℃连接1 h,将连接产物转化至E.coliTrans5α感受态细胞,37℃培养14 h,挑取单菌落进行PCR鉴定,阳性菌落通过质粒小提试剂盒提取重组质粒,并用BamHⅠ、EcoRⅠ双酶切做进一步鉴定。鉴定阳性的质粒送至擎科生物科技有限公司测序。
积差相关系数.这种方法是Pearson提出来的,其适用条件为:①两个变量都是连续型随机变量;②两个变量的总体都呈正态分布或接近正态分布;③两个变量的取值是一一对应数据;④两个变量之间呈线性关系.
阿尔伯塔卒中项目早期CT评分>8分的急性后循环脑梗死患者发病12 h内血管内治疗的疗效观察 ………………………………………………………… 傅新民,傅聪,张洋,等 378
1.2.6 hNMT1蛋白的纯化 将表达菌按1∶100的比例转接至100 mL培养基中,按照优化好的条件待菌液OD 600 nm 值为1.0时,加入终浓度为0.6 mmol/L的IPTG,16℃诱导表达。收集菌体,用3~5 mL缓冲液(30 mmol/L Tris-hcl、300 mmol/L NaCl、10 mmol/L咪唑,pH8.5)重悬菌体,冰水浴超声破碎,11 000 r/min、4℃离心30 min,取上清液与镍树脂于4℃结合1 h,收集流出液,并依次用含有10 mmol/L、20 mmol/L和30 mmol/L咪唑的缓冲液洗脱杂蛋白,最后用含有300 mmol/L咪唑缓冲液洗脱目的蛋白(其余组分:30 mmol/L Tris-HCl、300 mmol/L NaCl,pH8.5)。经SDS-PAGE和Western blot检测纯化结果。用PierceTMBCA Protein Assay Kit (Thermo Scientific,U.S.A)按照说明书对蛋白定量。
1.2.1 引物设计 根据NCBI中的hNMT1序列(GenBank No:M86707.1),利用Oligo 6设计带有酶切位点的特异性引物,F-BamHⅠ:5′-CGGGATCCATGAACTCTTTGCCAGCAG-3′,R-EcoRⅠ:5′- CGGAATTCTTATTGTAGCACCAGTCCAACCT-3′,划线部位为酶切位点,引物由擎科生物科技有限公司合成。
2 结果
2.1 重组质粒的构建与鉴定
经IPTG诱导后,与空载体菌相比,在46 ku处有明显条带,SDS-PAGE(图3)与Western blot(图4)结果一致,均与预期蛋白分子质量大小相符。
1.2.2 目的基因的扩增及纯化 以质粒pUC57-hNMT1为模板,利用引物F-BamHⅠ/R-EcoRⅠ对其hNMT1基因进行扩增,体系如下:10 μL 5×PrimeSTAR GXL buffer(Mg2+plus),0.5 μL PrimeSTAR GXL,4 μL dNTP Mix,上、下游引物各1 μL,0.2 μL模板,ddH2O补至50 μL。扩增程序如下:98℃变性15 s,63℃退火30 s,68℃延伸90 s,共32个循环。PCR产物经10 g/L琼脂糖凝胶电泳并用OMEGA胶回收试剂盒进行DNA回收。

M.DNA标准DL 5 000;1.阳性对照;2~4.目的基因的PCR扩增产物;5.阴性对照

M.DNA标准DL 5 000;1.重组质粒pRSFDuet1-hNMT1;2.重组质粒双酶切
2.2 hNMT1蛋白的表达鉴定
以pUC57-hNMT1为模板,PCR扩增hNMT1基因,产物经10 g/L琼脂糖凝胶电泳,可见1 251 bp大小的特异性条带,与预期相符(图1)。将基因片段与pRSFDuet1载体连接、转化后,菌液PCR鉴定片段大小与预期相符,重组质粒经BamHⅠ/EcoRⅠ双酶切后,凝胶电泳可见与预期大小相符的两条带(图2)。将鉴定正确的质粒送至擎科生物科技有限公司测序,测序结果表明,序列与GenBank中hNMT1序列一致。
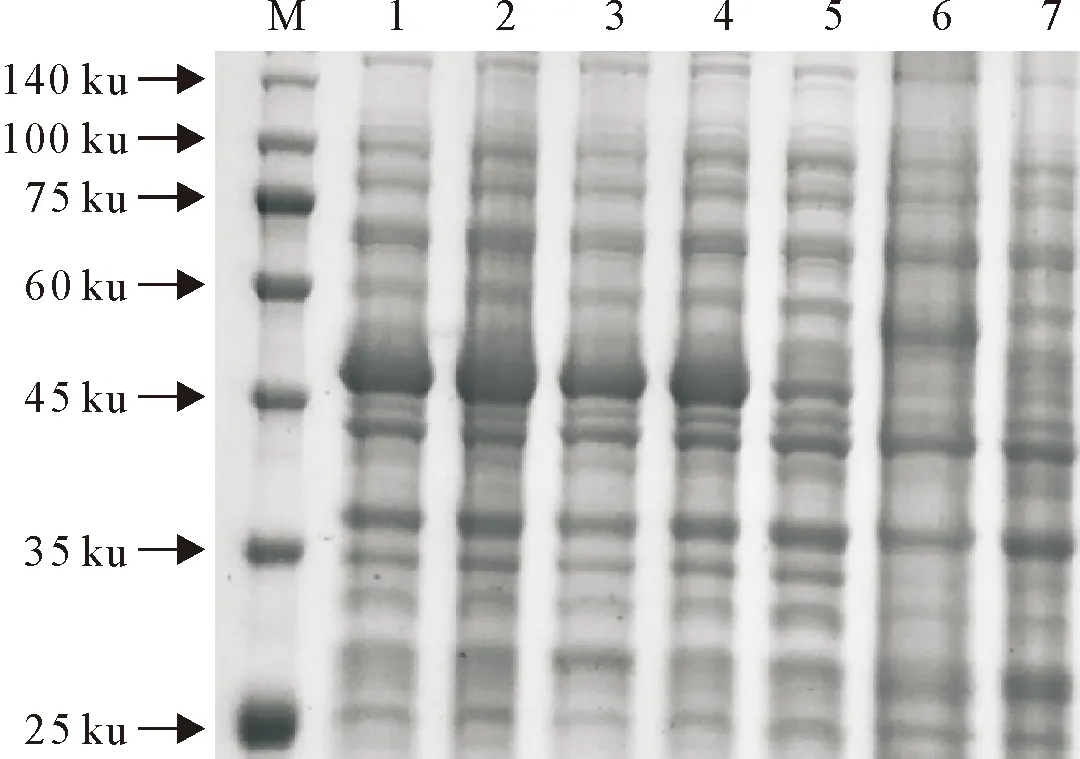
M.蛋白分子质量标准;1~4.重组质粒表达菌诱导;5.重组质粒表达菌未诱导;6.空载体诱导;7.空载体未诱导

M.蛋白分子质量标准;1.重组质粒表达菌未诱导;2~3.重组质粒表达菌诱导;4.空载体表达菌诱导;5.空载体表达菌未诱导
2.3 蛋白表达条件的优化
2.3.1 诱导时大肠埃希氏菌浓度对蛋白表达量的影响 选取大肠埃希氏菌对数生长期的节点,对处于不同生长阶段的大肠埃希氏菌进行诱导,随着菌浓度的增加,蛋白表达量逐渐增加,当OD 600 nm 值达到1.0时表达量最高,随后降低(图5),故选择在OD 600 nm =1.0时进行诱导。
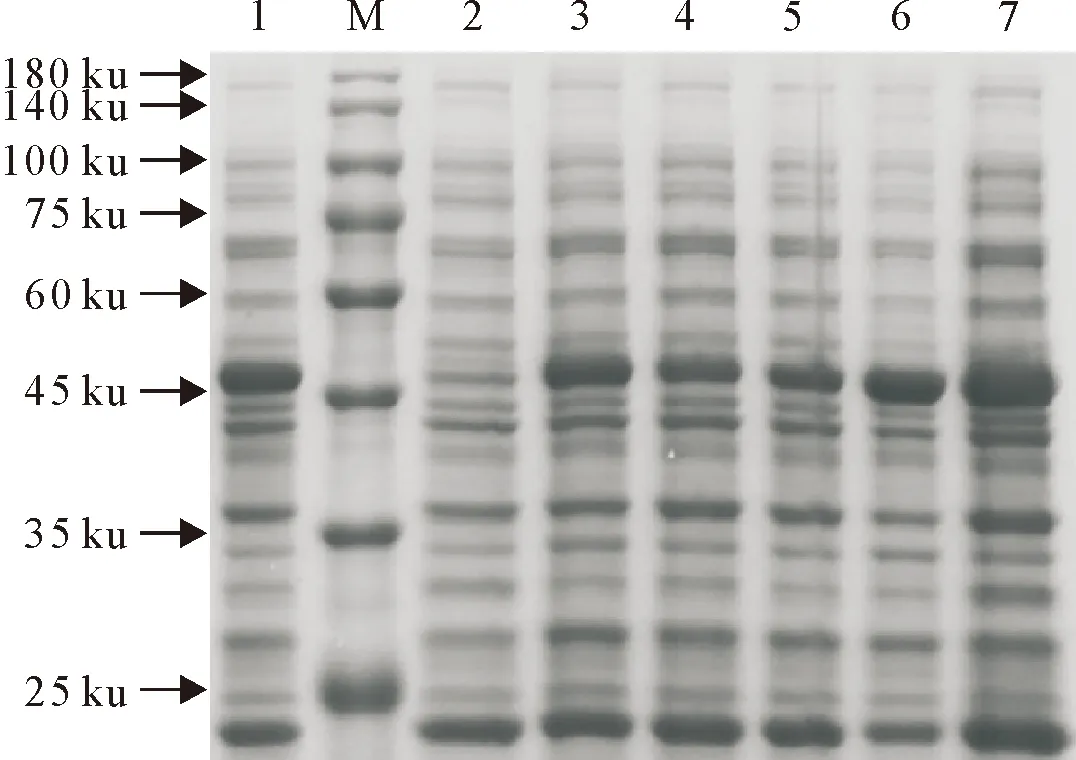
M.蛋白分子质量标准;1.诱导时菌浓度为1.2;2.未诱导;3~7.诱导时菌浓度分别为0.5、0.6、0.7、0.9和1.0
2.3.2 诱导剂剂量对蛋白表达量的影响 在确定诱导剂浓度过程中发现,在IPTG浓度较小时,随IPTG浓度增加蛋白表达量增多,当IPTG浓度达到0.5 mmol/L时,蛋白表达量最高,随后表达量不再随诱导剂浓度的增加发生明显变化(图6)。

M.蛋白分子质量标准;1~7.IPTG终浓度分别为1.0、0.9、0.7、0.5、0.4、0.2和0.1 mmol/L;8.重组质粒表达菌未诱导
2.3.3 不同表达温度对蛋白表达量的影响 在已确定的菌浓度及诱导剂浓度条件下,16℃、25℃和37℃时蛋白均可表达(图7),超声破碎后的上清及沉淀经SDS-PAGE分析,发现随表达温度的降低,可溶性蛋白增加(图8),因此选择在16℃条件下进行诱导表达。

M.蛋白分子质量标准;1.重组质粒表达菌未诱导;2~4.诱导表达温度分别为16℃、25℃、37℃
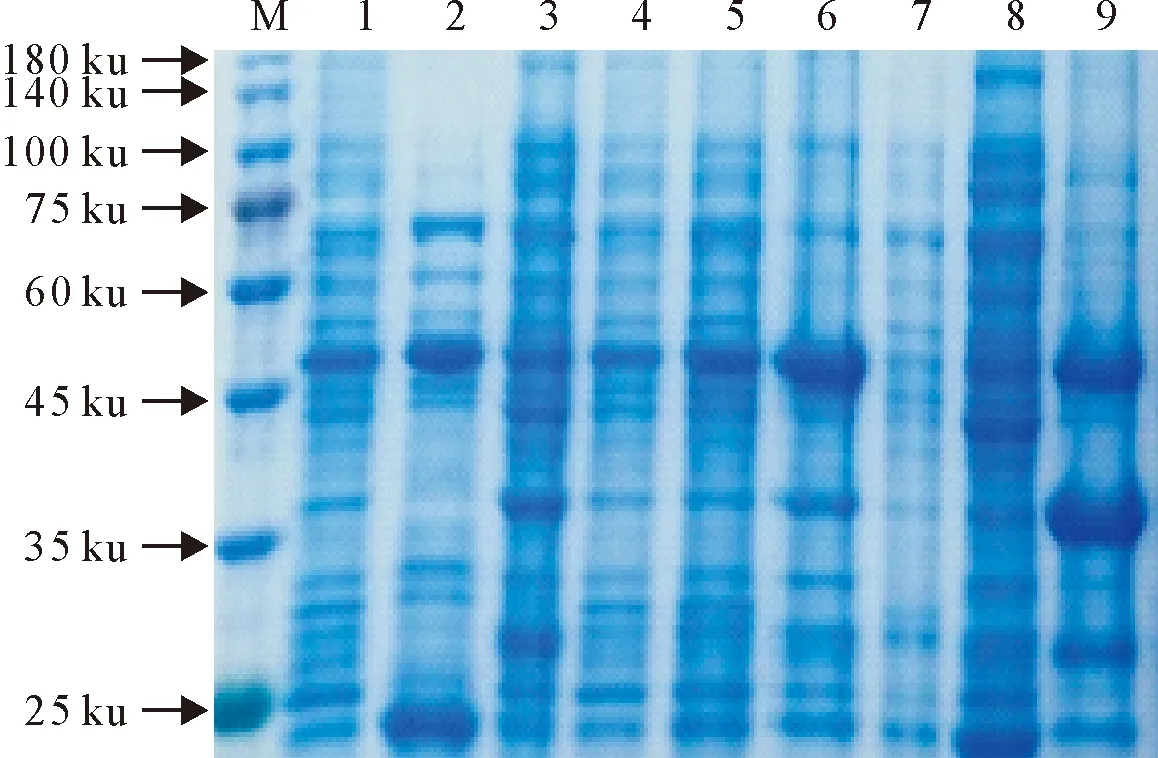
M.蛋白分子质量标准;1~3.分别为16℃表达全菌、上清和沉淀;
2.4 目的蛋白纯化及鉴定
蛋白经镍柱纯化后,SDS-PAGE结果可看出纯化后的蛋白大小与表达鉴定结果一致(图9)。将纯化后的蛋白进行Western blot鉴定,发现在46 ku处有特异性条带(图10)。

M.蛋白分子质量标准;1~2.纯化后蛋白M.Protein molecular weight Marker; 1-2.Purified hNMT1

M.蛋白分子质量标准;1.纯化后蛋白M.Protein molecular weight Marker; 1.Purified hNMT1
2.5 hNMT1活性检测
在hNMT1较低浓度范围内,随hNMT1浓度增加,470 nm处荧光强度略有增加,但与对照相比并无明显差异,当hNMT1浓度为20 nmol/L时,在470 nm处可见有明显的吸收峰,与对照组相比差异显著,当hNMT1浓度继续增加,吸收峰值不再升高(图11)。结果表明,本研究获得了具有活性的N-豆蔻酰基转移酶。

图11 hNMT1活性检测
3 讨论
NMT的N端主要为豆蔻酰CoA的结合区域,C端为抑制剂的结合区域。NMT能够特异性识别并结合豆蔻酰CoA形成NMT-豆蔻酰CoA缀合物。二者结合后共同构成了一个功能性肽类底物的结合位点,可识别特异性肽类(蛋白)底物形成NMT-豆蔻酰CoA-肽类底物三元复合物,发生直接亲核加成-消除反应,由酶-底物复合物转化成酶-产物复合物,一部分豆蔻酸被催化转移至底物N端的甘氨酸上,释放游离的CoA,随后释放N-肉豆蔻酰化产物[11-12]。
在低等真核生物中,一个基因即可编码NMT,而在高等真核生物中,NMT1和NMT2两个基因编码NMT[13-14]。哺乳动物细胞表达的NMT两种同工酶,序列相似性约为77%[15],但在豆蔻酰化生物活性中起着不同作用。Suwanmanee S等研究表明,NMT1可能是一种宿主因子,通过参与病毒生命周期的膜相互作用,促进登革热病毒(Dengue virus,DENV)复制,特别是吸附、病毒组装和释放[16]。有研究证实,体内敲除NMT1会抑制肿瘤的生长,NMT1基因敲除会导致小鼠胚胎中的缺陷型骨髓生成。Wen Z等在研究中发现,类风湿性关节炎患者可通过自调节NMT1的表达来抑制滑膜炎,进而表明NMT1对组织有保护作用[17]。
多种病毒蛋白都可发生豆蔻酰化,例如小RNA病毒、逆转录病毒、嗜肝DNA病毒及呼肠孤病毒等,其中有些蛋白的豆蔻酰化对产生有感染性的病毒颗粒或病毒复制组装是必不可少的,例如HIV-1的Nef蛋白。Nef蛋白的肉豆蔻酰化作用对其活性至关重要[18-19],而Nef蛋白缺失N端的肉豆蔻酰化位点会阻断其与CD4+T细胞质尾部的相互作用[20-21]。Seaton K E等研究表明,NMT1与NMT2这两种同工酶都可使Nef蛋白豆蔻酰化[22];Ohta H等[23]通过免疫共沉淀和质谱探究发现,NMT1使HIV-1蛋白发生豆蔻酰化并促进HIV-1复制。
因大肠埃希氏菌转化率高,加工生产蛋白快速,并且其表达外源基因产物的水平远高于其它基因表达系统,本实验室长期致力于研究在大肠埃希氏菌表达系统中装配口蹄疫病毒样颗粒,因此我们选用同工酶hNMT1作为研究对象,在大肠埃希氏菌表达系统中表达具有活性的N-豆蔻酰基转移酶,为了提高表达量,本试验对诱导剂浓度、表达温度和诱导前细菌浓度进行了摸索,利用最适表达条件得到表达量较高的可溶性蛋白。本试验采用化学荧光反应对hNMT1进行活性检测,操作简单,灵敏性好;hNMT1在浓度为20 nmol/L时,吸收峰值至最高,随后不再增加;为节约试验材料,我们选择浓度为20 nmoL/L的hNMT1进行后续试验。本研究所制备的hNMT1可用于探究在原核表达系统中,hNMT1催化的豆蔻酰化对小RNA病毒衣壳组装的影响。
