甘肃部分地区奶牛乳房炎金黄色葡萄球菌的细菌多位点序列分型与毒力检测
2021-06-24陈婷婷达举云申玉龙门倩云李宗帅王媛媛杨孝朴赵兴绪
陈婷婷,达举云,申玉龙,门倩云,李宗帅,王媛媛,杨孝朴,张 勇,赵兴绪
(甘肃农业大学动物医学院,甘肃兰州 730070)
奶牛乳房炎(cow mastitis)是奶牛养殖业中较为常见的一种普通病,被认为是世界上“最昂贵”的奶牛疾病之一。它通常由多种病原微生物引起,而金黄色葡萄球菌是该病最主要的致病菌之一[1]。近来,耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)感染诱发了严重的临床医学及公共卫生问题[2]。有研究报道表明,牛的耐甲氧西林金黄色葡萄球菌感染率在美国和韩国较低(分别为4%和4.2%),但中国牛的耐甲氧西林金黄色葡萄球菌感染率较高(47.6%)[3]。目前,抗生素仍然是治疗奶牛乳房炎的主要方法。然而,随着抗生素的不合理使用导致奶牛乳房炎病原菌耐药性越来越严重,甚至出现“超级细菌”[4]。 由MRSA菌株引起的感染对青霉素、苯唑西林等主要种类的抗生素具有耐药性,这使得治疗时间延长或治疗效果甚微。细菌致病力的强弱与其分泌的多种毒力因子密切相关,S.aureus也不例外。常见的毒力因子包括细菌毒素(肠毒素、溶血素、杀白细胞素和脱皮毒素等外毒素)、黏附蛋白(黏附素)、细胞表面碳水化合物和保护细菌的蛋白质(凝固酶)及可能有助于细菌致病性的水解酶(耐热核酸酶)等葡萄球菌酶[5]。研究病原菌的毒力因子,对于了解病原菌和宿主之间的相互作用有非常重要的作用。研究发现,细菌多位点序列分型(multilocus sequence typing,MLST)试验数据便于保存,可用于大规模和长期的流行病学监控[6]。故而,本研究选择以甘肃省东、中和西部为代表的3个地区罹患临床型乳房炎41头奶牛93个乳样为样本,进行金黄色葡萄球菌分离鉴定、MRSA的筛选及耐药性分析,同时对分离得到的菌株进行MLST分析并且检测其毒力因子的强弱,以期了解甘肃省临床型奶牛乳房炎感染金黄色葡萄球菌分子MRSA流行情况、耐药特点与分布规律及其毒力基因的携带状况,为甘肃省临床型奶牛乳房炎的防治和亚单位基因疫苗的研制提供参考依据。
1 材料与方法
1.1 材料
1.1.1 样品采集 依据奶牛乳房的外观和牛场工作人员描述,采集甘肃省41头罹患临床型乳房炎奶牛的乳样共计93份,4 ℃或-20 ℃保存。其中,甘肃东南地区(陇东南)天水市24份(样品名为T1-T24),甘肃中部地区(陇中)定西市22份(样品名为D1-D22),甘肃西部地区(河西)张掖市47份(样品名为Z1-Z47)。
1.1.2 主要试剂 Baird-Parker琼脂培养基、营养肉汤琼脂培养基、亚碲酸盐卵黄增菌液、Mueller Hinton琼脂培养基(MHA)、青岛海博生物技术有限公司产品;细菌基因组DNA提取试剂盒、OMEGA公司产品;微量生化鉴定管、药敏片、杭州滨河微生物公司产品;ATCC29213质控菌株、北京质检生物技术有限公司产品;2×EasyTaqPCR SuperMIX、DNA Marker北京全式金公司产品。
1.1.3 主要仪器 超净工作台(1300 SERIES A2),美国Thermo Fisher Scientific公司产品;恒温培养箱(DHP-9160B),上海一恒科技有限公司产品;正置光学显微镜(CX23),日本Olympus公司产品;PCR扩增仪(T100)、凝胶成像系统(Universal HoodⅡ),美国Bio-Rad公司产品。
1.2 方法
1.2.1 金黄色葡萄球菌分离 乳样充分摇匀,划线接种于营养肉汤琼脂培养基上,37℃培养18 h~24 h,涂片、革兰氏染色、镜检后接种于Baird-Parker氏琼脂培养基上纯化培养,置-80℃保存。
1.2.2 菌株的鉴定
1.2.2.1 生化试验 按照微量生化反应管说明书进行接触酶、凝固酶、糖分解、甘露醇和硝酸盐试验。结果依据《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》对比,判定细菌的种属。
1.2.2.2 分子生物学鉴定 按照DNA提取试剂盒操作说明提取待检菌基因组,采用侯书宝设计的引物[7],利用PCR扩增16S rRNA序列,产物送北京奥科鼎盛有限公司测序,结果进行序列同源性比对分析。
1.3 MRSA筛选
根据GenBank(登录号:AP017922.1)中已公布的基因序列,利用premier 5.0软件设计扩增mecA基因的PCR引物,上游引物F:5′-ATGAGAATAGAACGAGTAGATGA-3′;下游引物R:5′-CAAACTCTGTAGTTATTGGATTG-3′,预期扩增目的片段长度为502 bp。
1.4 药物敏感性试验
采用琼脂纸片扩散法(K-B法),将新鲜菌悬液稀释至0.5麦氏浊度,37℃恒温培养24 h,测量抑菌圈直径,按照美国临床实验室标准化委员会(NCCLS)颁布的《抗微生物药物敏感性试验执行标准》判断对药物的敏感性,金黄色葡萄球菌(ATCC29213)作为质控菌。
1.5 MLST分型
1.5.1 PCR扩增 参照金黄色葡萄球菌MLST 数据库(http://pubMLST.org/aureus/)所提供的arcC、aroE、glpF、gmk、pta、tpi、yqiL7对持家基因的引物序列,扩增目的片段。
1.5.2 测序及MLST分型分析 将产物送金唯智(天津)公司测序。登录金黄色葡萄球菌MLST数据库(pubMLST),对每株菌的7个持家基因序列进行查询与比对,得到相应的等位基因编码(aelle),按照arcC、aroE、glpF、gmk、pta、tpi、yqiL的排列顺序,确定菌株的序列型(sequence type,ST)。
1.5.3 进化树分析 将测得的不同等位基因序列分别通过Clustal进行对位分析,7个基因串联后采用NJ(Neighbor-joining)法进行Bootstrap 2 000次的重复构建,使用MEGA5.0软件进行系统发育树图形绘制。
1.6 毒力基因检测
参考文献[8],用PCR技术检测金黄色葡萄球菌14种毒力基因在分离株中的分布情况。
2 结果
2.1 细菌的分离鉴定
从93份乳样中分离得到40株葡萄球菌,其中表皮葡萄球菌1株(D4),溶血葡萄球菌4株(Z7、Z14、D13和T2),木糖葡萄球菌1株(Z9),腐生葡萄球菌5株(T1、T9、D3、D12和Z17),伪中间葡萄球菌1株(T11),金黄色葡萄球菌28株,分离率为30%。对28株金黄色葡萄球菌重新编号,其中张掖市13(Y1-13)株、定西市5(X1-5)株、天水市10(Q1-10)株;3个地区金黄色葡萄球菌的分离率依次为46.42%、17.86%和35.71%。
2.2 MRSA筛选
mecA基因扩增结果如图1。可见28株金黄色葡萄球菌中有11株mecA基因阳性,确定为耐甲氧西林金黄色葡萄球菌(MRSA),检出率为39.3%。其中张掖、天水和定西地区mecA基因阳性检出结果分别为6株、4株和1株,检出率依次为46%、40%和20%。其余17株mecA基因阴性,为甲氧西林敏感金黄色葡萄球菌(methicillin-sensitiveStaphylococcusaureus,MSSA),检出率为60.71%。

M.DNA标准DL 2 000; 1~11.Y1、Y2、Y4、Y6、Y8、Y12、Q6、Q7、Q8、Q10、X2
2.3 药敏试验结果
28株金黄色葡萄球菌对12种抗生素的药物敏感性试验结果见表1。11株MRSA和17株MSSA均对万古霉素敏感,MRSA对四环素、克林霉素、多黏菌素B、氯霉素、环丙沙星、呋喃妥因、氨曲南等的敏感率均低于MSSA;分离株多为多重耐药(16株),多重耐药率达到57.14%。

表1 28株金黄色葡萄球菌药物敏感性试验结果
2.4 MLST分型
2.4.1 MLST分析 应用PCR方法成功扩增出28株金黄色葡萄球的7个管家基因(图2),经测序后获得基因的部分保守序列(2株多次送测失败),其余26株的测序结果与MLST数据库收录的相应管家基因进行比对分析,共有9个型(表2,图3)。其中ST59有8株(6株是MRSA,2株是MSSA),是其优势型,占31%;ST50和ST398(4株是MRSA,1株是MSSA)各5株;ST3796和ST5323各有2株,其余序列型均只有1株。
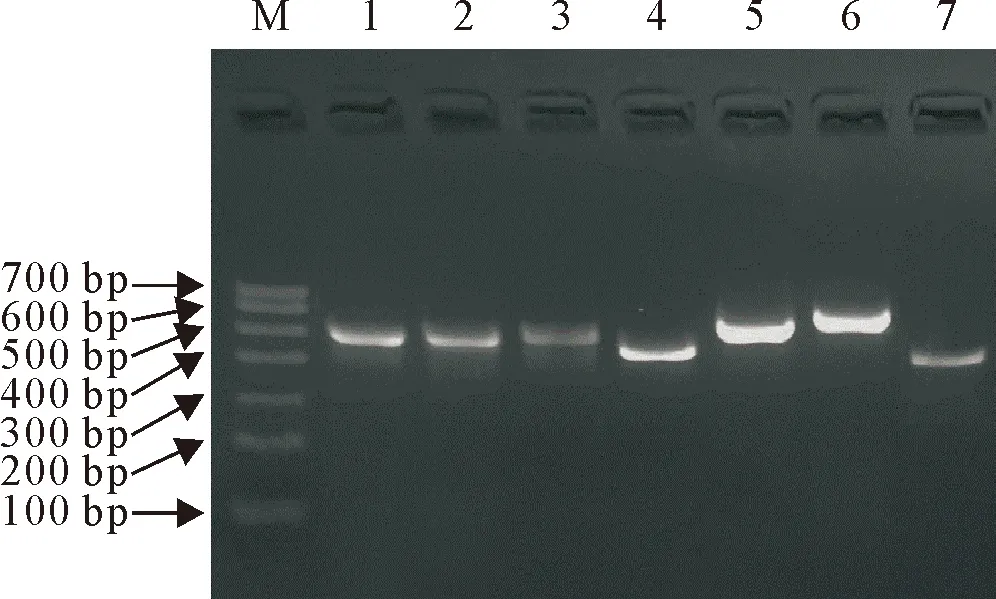
M.DNA标准DL 700; 1~7:arcC、aroE、glpF、gmk、pta、yqiL、tpi

表2 金黄色葡萄球菌等位基因编号及序列号
2.4.2 系统发育分析 通过将MLST分型方法使用的7个持家基因测序的结果串联后,对26株金黄色葡萄球菌分离株进行系统发育树分析(图3),发现系统发育树有两大分支Group1和Group2,其中定西市的4株全部在Group1中,说明其不存在地区差异性,而天水和张掖地区的在Group1分支上的分离株多于Group2分支上的,体现出这两个地区的金黄色葡萄球菌存在地区性差异。
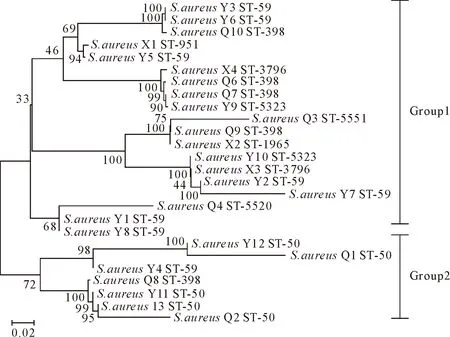
图3 ST分型系统发育进化树
2.5 毒力基因检测
28株金黄色葡萄球菌毒力基因的PCR检测结果见表3。对28株分离菌进行了14种毒力基因检测,检出了12种(图4),但有2种,即hla和FnBPB未被检出。其中nuc、spa和coa检出率均为100%,且在MRSA和MSSA中检出的结果一致;hlb、set1、clfA、sak、seb、FnBPA、seg、PVL和sea在MSSA菌株的阳性检出率分别为88.2%、76.5%、70.6%、35.3%、58.8%、88.2%、23.5%、11.8%和23.5%,而在MRSA菌株中依次为63.6%、63.6%、54.5%、18.1%、45.5%、72.7%、9.1%、18.2%和18.1%。这些基因在张掖市分离株中检出11种,而定西和天水市分别检出8和9种。
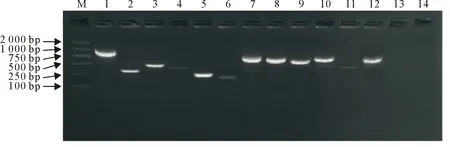
M.DNA标准DL 2 000; 1~14.FnBPA、sak、seb、PVL、nuc、sea、spa、hlb、clfA、set1、seg、coa、hla、FnBPBM.DNA Marker DL 2 000; 1-14.FnBPA,sak,seb,PVL,nuc,sea,spa,hlb,clfA,set1,seg,coa,hla,FnBPB

表3 牛源金黄色葡萄球菌毒力基因PCR检测结果
3 讨论
奶牛乳房炎是奶牛生产中最常见、造成经济损失最大的普通病之一,它是由多种病原微生物感染引起的,已知的奶牛乳房炎的致病微生物已超过150种,其中包括球菌、杆菌、支原体、真菌、酵母菌和病毒等。研究发现,金黄色葡萄球菌(S.aureus)是引起奶牛乳房炎的诸多致病菌中最重要病原菌之一[9],也是临床上最难治愈并造成经济损失最大的接触性传染性病原[10]。本试验从93份乳样中分离到6种40株葡萄球菌属的细菌,其中金黄色葡萄球菌最多,占30%,这个结果低于郭慧琴等[11]对杭州地区金黄色葡萄球菌的分离率60.7%,但高于杜琳等[12]对内蒙古自治区、河北省、黑龙江省、上海市和山东省金黄色葡萄球菌分离率12.15%,这种分离率的地域差异性可能与牛场周边的环境状况、饲养条件以及管理水平有关。以往的研究表明,中国奶牛乳腺炎中MRSA的发生率在1.4%~47.6%[13],在本试验中39.3%的金黄色葡萄球菌分离株被鉴定为MRSA,在国内报道的范围之内。但是MRSA在德国、韩国、美国的流行率较低,分别为16.7%、6.3%、4%[14-16]。相比之下,在印度奶牛乳腺炎中检测到MRSA的频率更高,达到48.7%[3]。这可能与不同的样本量、不同的季节、农场管理和滥用抗生素有关。有研究显示,100%的MRSA菌株对红霉素、克林霉素、氯霉素和庆大霉素耐药[17],Vanderhagehen W等[18]报道了MRSA对四环素的抗药性,经常对大环内酯类、林可酰胺类和氨基糖苷类产生抗药性,并且Moon等[19]也报道了MRSA对青霉素存在较高的耐药性。本研究中,MSSA和MRSA分离株的耐药谱与相关报道中非常相似。在本试验中所分离的菌株均对万古霉素敏感,说明万古霉素可作为这三个地区治疗金葡菌引起的临床型奶牛乳房炎首选药物。
为了进一步研究分离株的致病性,本试验通过PCR检测了14 种金黄色葡萄球菌常见的毒力基因的分布情况,结果显示,MRSA 菌株对肠毒素基因seg、set1、sea、seb和sak的携带率较低,这与之前报道的MRSA 菌株较少携带肠毒素基因的研究结果一致[20-21]。此外,clfa、FnBPA、nuc、spa、coa、hlb、set1和seb等基因在分离株中的高频率,显示它们在甘肃牛乳房炎中的潜在毒力。含有pvl基因的金黄色葡萄球菌可能对人类和动物造成危害,它们与严重的皮肤和软组织感染有关[22]。在本试验中,发现4株pvl阳性菌株(14.3%),其中2株是MRSA ,这与Mancini F等[23]在意大利南部的牛奶和乳制品中鉴定出MRSA-pvl阳性菌株型一致,与本研究不同的是Sudagidan M等[24]从食物中分离的金黄色葡萄球菌中存在MSSA-pvl分离株,说明MSSA-pvl分离株不仅存在于食物源金黄色葡萄球菌中,也存在于动物源金黄色葡萄球菌中。通过MLST分型发现,26株金黄色葡萄球菌中存在9种ST序列型,其中ST59为优势序列型。MRSA 菌株存在ST59、ST398和ST1965这3种序列型,有研究报道瑞士和比利时乳房炎奶牛乳汁中的MRSA属于ST398,但也有在法国和北美ST398克隆株引起人类严重感染的报道[25-26]。因此,ST398序列型的菌株应值得注意,可能存在人和动物之间相互传播的可能性,应避免在养殖过程中引起人和动物的感染。MSSA菌株有8种序列型,其中以ST50为主,占 29.4%,与MRSA菌株相比表现出了克隆多样性。
