致细胞病变型新疆BVDV基因2型毒株的分离鉴定及其致病性
2021-06-21郭妍婷陈俊贞胡新艳赵新艳董文丽贺渊秀王万顺李泽宇冉多良史慧君
李 祯,郭妍婷,陈俊贞,胡新艳,赵新艳,董文丽,贺渊秀,王万顺,李泽宇,姚 刚,冉多良,付 强,史慧君
(新疆农业大学 动物医学学院,新疆 乌鲁木齐 830052)
牛病毒性腹泻/黏膜病(bovine viral diarrhea/mucosal disease,BVD/MD),简称牛病毒性腹泻病,是由牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)感染引起的接触性传染病,感染动物常表现出高热、腹泻、白细胞减少、免疫抑制、黏膜充血等临床症状,还能引起奶牛产奶量下降、孕牛流产、产死胎以及牛的持续性感染[1-3]。BVDV可通过血液、排泄物等多种途径水平传播,感染BVDV的牛发病率高、病死率低,牛群中相当一部分是BVDV的携带者。BVDV还可垂直传播,感染孕牛产下的犊牛终身带毒,持续排毒,是重要传染源,同时也是生物制品、血清、冻精的主要污染源,对养牛业危害极大[4]。
BVDV毒株有2种生物型,分别为非致细胞病变(non cytopathic,NCP)生物型和致细胞病变(cytopathic,CP)生物型[5]。CP型BVDV接种细胞可使细胞出现病变,具体表现为细胞聚集、拉网、空泡、核固缩等现象。BVDV 5′UTR的核苷酸序列呈高度保守性,常利用其核苷酸序列设计特异性引物,以此对BVDV进行检测和分型鉴定。
本试验在分离BVDV新疆地方株的基础上,对5′UTR基因进行克隆与序列分析,从而了解BVDV新疆株基因型及致病性,为疫病的诊断及致病机制研究提供依据。
1 材料与方法
1.1 细胞系、病毒株及样品MDBK细胞为本实验室保存;BVDV-TC新疆塔城分离株由新疆农业大学动物医学学院冉多良教授惠赠[6];样品为新疆博乐地区某养牛场出现腹泻症状的病牛新鲜粪便样品,-80℃保存。
1.2 主要试剂及仪器马血清HS、Trypsin及高糖DMEM、青-链抗生素均购自BI试剂公司;TRIzol购自Invitrogen公司;低熔点琼脂糖、0.33%中性红染液购自Sigma公司;Anti-dsRNA mAB J2(10010200)购自美国SCICONS公司;抗荧光淬灭PVP封片液购自Beytime公司;0.2%磷钨酸购自Hitachi公司;超滤离心管(100 kDa)、0.45 μm滤器购自Merck Millipore公司;反转录试剂盒(CW2569M)购自北京康为世纪生物科技有限公司;细胞培养箱(Eppendorf,Glaxy 170R)、PCR仪(BIO-RAD,C1000)、照胶仪(BIO-RAD,721BR11152)、激光共聚焦显微镜(Zeiss,LSM 510)和透射电子显微镜(Hitachi,HT7700)。
1.3 RT-PCR鉴定将粪便样本加入3倍体积的PBS振荡混匀,4℃离心10 min;取500 μL上清液加入TRIzol 500 μL,充分混匀,加入200 μL氯仿,离心15 min;转移上层液相至新的离心管,加入等体积异丙醇,4℃离心10 min后弃上清;加入75%乙醇 500 μL,4℃离心10 min后弃上清,室温干燥5 min;加入20 μL RNase-free水,反转录后-80℃长期保存。反转录步骤参照康为世纪反转录试剂盒。
参照文献[7]及Primer Premier 5.0软件设计BVDV检测通用引物5′UTR(F:5′-CCTAGCCATGCCCTTAGTAGGACT-3′;R:5′-GGAACTCCA-TGTGCCATGTACA-3′)由苏州金唯智生物科技有限公司合成。RT-PCR扩增条件:94℃ 5 min;94℃ 40 s,55℃ 30 s,72℃ 30 s,35个循环;72℃ 10 min,4℃保存。
1.4 病毒的传代将病毒处理液接种至80%~90%单层MDBK细胞,于37℃、5%CO2细胞培养箱中培养;接毒后24,36,48,72 h观察细胞病变情况,收集上清液,-80℃保存。
1.5 蚀斑纯化试验使用DMEM对病毒进行10倍梯度稀释,将稀释液接种于单层MDBK细胞中;将无菌的2%低熔点琼脂糖与2% HS DMEM培养液按照体积比1∶1比例混匀后加入到细胞和病毒中,厚度约为2 mm,待凝固后倒置于37℃培养箱中培养;待细胞出现病变,用0.001%的中性红染色,肉眼可见明显的蚀斑;选择清晰的单个蚀斑重培养,RT-PCR鉴定后进行下一轮的蚀斑纯化,如此反复操作5次后得到纯化的病毒。
1.6 病毒的毒力测定取相同TCID50的纯化病毒和BVDV TC株,分别进行10-1~10-8梯度稀释后接种至80%单层MDBK细胞中,设立阴性对照组;分别于病毒感染后12,24,36 h收取细胞和病毒液,反复冻融3次后测定病毒滴度(方法同上),逐日观察5 d,记录每个稀释度出现病变的孔数,按Reed-Muench法计算病毒的TCID50。
1.7 理化性质鉴定为了测定分离毒株对乙醚、氯仿、胰蛋白酶、酸性条件、碱性条件、温度、紫外线的敏感程度,分别使用20%乙醚、20%氯仿、0.25%胰蛋白酶、pH 3.0酸性条件、pH 10.0碱性条件、温度条件(56℃作用30 min)、紫外线对分离毒株进行处理,依照上述方法测定病毒滴度。
1.8 免疫荧光试验将纯化病毒接种至MDBK细胞(设立阴性对照),待细胞病变后用4%多聚甲醛固定;用BVDV p7蛋白免疫血清(稀释比例1∶50)和Anti-dsRNA RNA antibody(稀释比例1∶1 200 4℃孵育过夜,荧光二抗标记驴抗鼠IgG(H+L)常温孵育,PI核染,抗荧光淬灭PVP封片液封片,激光共聚焦显微镜下观察结果。
1.9 透射电镜试验将浓缩病毒液滴在200目碳支持膜铜网上,静置3~5 min,2%磷钨酸负染3次,2~3 min/次,室温干燥后透射电子显微镜下观察。
1.10 病毒核苷酸分析BVDV 5′UTR基因扩增的方法同上。用DNA胶回收试剂盒回收PCR扩增产物,将其与克隆载体pMD19-T在4℃连接过夜,转化至大肠杆菌DH5α感受态细胞中,涂布至氨苄青霉素抗性的固体LB培养基中,37℃培养12~16 h后使用PCR鉴定单克隆菌落,将阳性克隆送苏州金唯智生物科技有限公司进行测序鉴定。将测序结果与GenBank数据库收录的BVDV基因序列进行Blast比对分析,构建遗传进化树。
1.11 小鼠致病性试验选取4~5月龄健康BALB/c小鼠6只,随机分成对照组和试验组2个组别;试验组通过尾静脉注射108IU/mL病毒液,对照组通过尾静脉注射等体积的DMEM;每隔2 d注射1次,共注射5次后取小鼠的心脏、肝脏、脾脏、肺脏、肾脏及十二指肠等组织,制备病理切片,观察病理变化。
2 结果
2.1 BVDV 5′UTR扩增RT-PCR扩增BVDV 5′UTR基因片段,检测腹泻牛的粪便样本,结果1号样本的PCR产物约为267 bp,表明该样本为BVDV阳性(图1)。

M.DL2000 DNA Marker;1~4.不同的样品;5.BVDV-TC株;6.阴性对照
2.2 病毒的分离培养将盲传15代的分离病毒株接种于MDBK细胞进行增殖培养,设立阴性对照组和BVDV-TC株阳性对照组;分别于病毒接种后12,24,36 h时观察细胞形态变化。结果发现,病毒接种24 h时,MDBK细胞出现病变,表现为皱缩、变圆、碎裂、脱落、聚集后产生合胞体和巨细胞等现象(图2),表明BVDV-BL314株为CP型。

图2 正常细胞及感染病毒后细胞形态(20×)
2.3 病毒的蚀斑纯化以低熔点琼脂糖作为覆盖物,使用蚀斑方法对分离的病毒进行纯化。经过中性红染色后低熔点琼脂糖上可见透明或乳白色的病毒蚀斑(图3);挑取单个蚀斑接种到正常的MDBK细胞上增殖,经RT-PCR鉴定呈阳性(图4)。

图3 病毒蚀斑

M.DL2000 DNA Marker;1~6.不同的病毒蚀斑;7.BVDV-TC株;8.阴性对照
2.4 病毒毒力测定使用Reed-Muench方法测定BL314分离株和BDVD-TC株的病毒毒力。病毒感染后24 h,BL314分离株病毒滴度显著性高于BVDV-TC株(*示P<0.05,**示P<0.01),表明BL314分离株的毒力强于BVDV-TC株(图5)。

注:*P<0.05;**P<0.01。下同
2.5 理化性质鉴定结果分别使用乙醚、氯仿、胰蛋白酶、酸/碱性条件、高温条件、紫外线等处理病毒并测定其滴度变化。乙醚、氯仿、胰蛋白酶、酸、碱、高温、紫外线处理后病毒滴度显著性降低(**示P<0.01),表明分离毒株对乙醚、氯仿等有机溶剂敏感,对胰蛋白酶敏感,56℃作用30 min病毒毒力降低,紫外线照射30 min可使其失活(表1,图6)。

图6 不同条件处理后病毒滴度测定
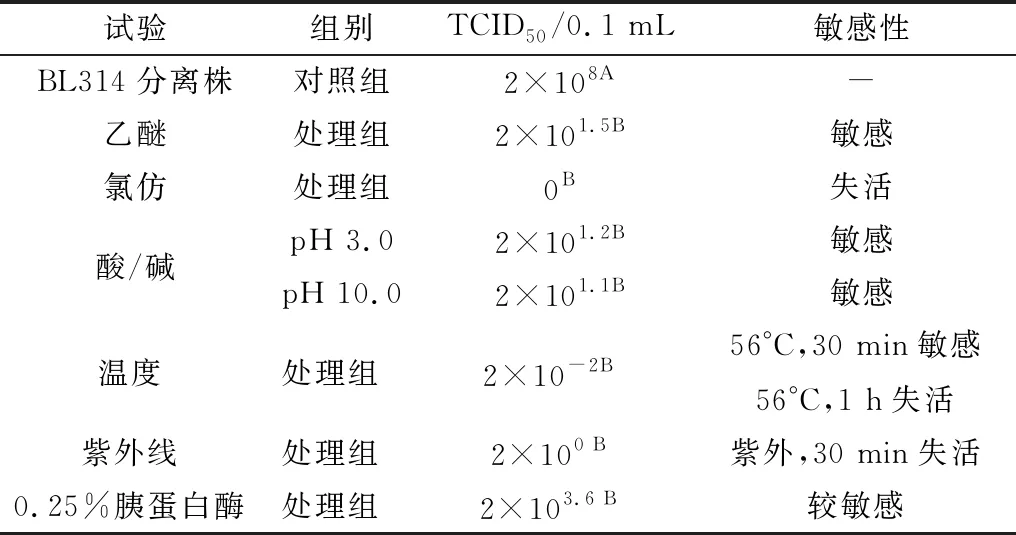
表1 病毒理化特性结果
2.6 免疫荧光试验接种分离毒株感染单层MDBK细胞(设立阴性对照),分别使用BVDV p7蛋白免疫血清和Anti-dsRNA 4℃孵育过夜,驴抗鼠荧光二抗常温孵育后,胞浆中可见绿色荧光,PI核染为红色荧光(图7)。
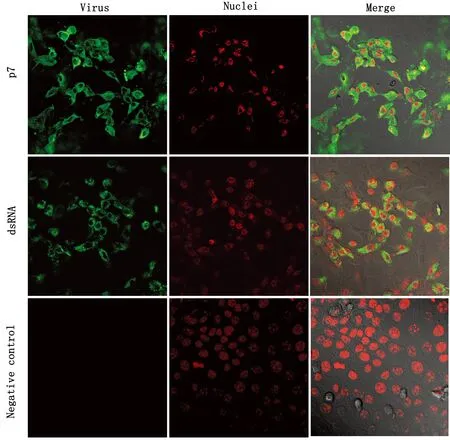
图7 BVDV-BL314免疫荧光鉴定(200×)
2.7 免疫透射电镜试验病毒吸附铜网后经2%磷钨酸负染,置于透射电镜下观察,可见直径为40~60 nm的球形、外被囊膜的病毒颗粒(黑色箭头所指)(图8)。

图8 BL314分离株形态的电镜观察结果
2.8 BVDV 5′UTR基因克隆与序列分析扩增BVDV 5′UTR基因片段,结果显示PCR产物约为267 bp(图9)。根据分离株5′UTR基因部分区域与GenBank数据库收录的BVDV基因序列进行Blast分析,建立遗传进化树,结果显示,该分离株与BVDV-2a型125c株的遗传距离较近(图10),因此BL314分离株为BVDV-2a基因亚型。

M.DL2000 DNA Marker;1.BL314;2.阴性对照
图10 BVDV-BL314分离株与其他BVDV株的5′UTR基因系统进化树分析
2.9 小鼠致病性试验结果将病毒尾静脉注射BALB/c小鼠5次后,取其心脏、肝脏、脾脏、肺脏、肾脏及十二指肠,观察其病理变化。结果显示,脾脏、肺脏和心脏不同程度肿大,有散在的出血点,质地变脆,边缘钝圆,无光泽;肺脏水肿,表面有出血斑点;心脏心肌肥大,血管不明显,心包和心外膜有纤维性肥厚和浑浊,心肌纤维变性、坏死;肾脏边缘变脆、趋向于透明(图11)。取部分病变组织制作石蜡切片,HE染色后观察其病理变化。结果显示,脾脏、肺脏和十二指肠病变较明显,脾脏红髓部分出血严重;肺脏肺泡扩张,肺泡壁增厚且有明显的出血;小肠绒毛代偿性变宽,肠绒毛上皮细胞由单层变为多层,隐窝形态发生变化;心脏和肝脏血管周围可见淋巴细胞浸润,肝脏血管内有淤血,少量肝细胞坏死;肾皮质、肾小管周围有少量出血,肾盂萎缩(图12)。

图11 组织解剖检测结果

图12 病理组织切片检测结果
3 讨论
1946年,OLAFSON等[8]在美国纽约州发现一种发病率高而死亡率低,以发热、腹泻和咳嗽为特征的牛传染性疾病,称之为BVD/MD。目前,该病广泛分布于美国、英国、新西兰、中国、澳大利亚等大型畜牧业国家。BVDV可以感染野生反刍动物,如绵羊、肉牛、奶牛和鹿,可以从病畜的血液、内脏、肠淋巴结组织或呼吸道、乳汁、精液中分离出病毒,给世界养牛业带来巨大的经济损失[9]。2016-2018年,泰国北部、土耳其卡尔斯地区、爱尔兰地区和巴西东北部的帕拉伊巴州BVDV阳性检出率为62.5%~100.0%[10-13]。2018年世界BVDV流行病学调研结果显示,我国动物水平的抗体阳性率为60%~80%,畜群水平抗体阳性率为20%~40%[14]。基于BVDV 5′UTR序列的高度保守性,可以将其分成BVDV-1、BVDV-2和BVDV-3这3个基因型,它们之间的抗原性和遗传性差异较大[15]。BVDV-2型主要包括BVDV-2a、BVDV-2b、BVDV-2c、BVDV-2d四种亚型,流行区域主要包括江苏省、山东省、河南省、青海省、陕西省、新疆维吾尔自治区等地区[16-18]。根据研究显示BVDV-2致病性更强、致动物死亡率更高[19]。新疆是我国的畜牧大省,研究表明该病已在新疆广泛存在。通过对新疆地区BVDV抗体和抗原的检测及流行病学调查,最高抗体阳性率平均在90%以上,严重阻碍了新疆养牛产业的健康发展,给农牧民带来了不同程度的经济损失[20]。
本研究从腹泻牛粪便中分离纯化到BVDV-BL314分离株,分离病毒株接种于MDBK细胞进行增殖培养,可观察到细胞出现皱缩、变圆、碎裂、脱落、产生合胞体等病变。免疫荧光抗原(绿色荧光)主要分布于细胞浆中,而未接种病毒的MDBK正常细胞无荧光出现,表明分离得到的病毒为BVDV。由于世界各国经济贸易频繁,导致BVDV在世界范围内广泛存在,且存在毒株变异较大、毒力增强的现象,此次分离毒株滴度为2×108TCID50/0.1 mL,且毒力高于BVDV-TC分离株;在BALB/c小鼠体内试验中,随着感染BVDV时间的延长,BVDV呈现出在机体内大量复制的现象,BALB/c小鼠试验组与对照组逐渐出现明显的差异。感染小鼠后可引起慢性感染,表现为多内脏器官肿大、出血、变形、质地变脆,边缘钝圆,无光泽;镜检组织内炎性细胞浸润、出血,血管淤血,脾脏及肺脏病变较为严重。
根据以往报道,新疆地区主要流行的病毒株为BVDV-1型,但也存在BVDV-2型[21-23]。本试验根据该分离株5′UTR基因部分区域绘制的系统进化树表明BL314分离株与BVDV-2型参考毒株美国125c株在同一分支上,与印度Ind141353株、美国Olwein#12株、美国USMARC-60780株亲缘性较近,确定BL314分离株为BVDV-2a基因亚型;表明本次调查的新疆牛场中存在BVDV-2a型的感染。
本研究通过BVDV的分离与纯化来了解CP型新疆地方性毒株2a型的流行特点及致病性,为疫病的诊断及致病机制研究奠定基础。
