宿主因子干扰素诱导蛋白44(IFI44)对水疱性口炎病毒复制的影响
2021-06-21陈怀鹏王蓬琨贺文琦宋德光关继羽
陈 爽,陈怀鹏,王蓬琨,赵 魁,贺文琦,宋德光,关继羽
(吉林大学 动物医学学院,吉林 长春 130062)
水疱性口炎(vesicular stomatitis,VS)是由水疱性口炎病毒(vesicular stomatitis virus,VSV)感染引起的猪、马、牛等多种哺乳动物和人共患的急性高度接触性传染病,被我国列为《国家中长期动物疫病防治规划(2012-2020年)》中重点防范的13种外来动物疫病之一。虽然VSV感染很少直接导致患畜死亡,但由此引发的动物机体抵抗力下降、继发性感染和群体性传播也曾给养殖业带来巨大的经济损失。VSV属于弹状病毒科、水疱病毒属,其基因组是不分节段的单股负链RNA。VSV通过节肢动物作为传播媒介感染家畜和啮齿类动物,也可感染人类[1]。VSV基因组从3′到5′端依次编码5个蛋白(N、P、M、G、L蛋白)。其中,N、P、L蛋白可以协同某些宿主蛋白形成RNA依赖的RNA聚合酶,从而有效行使病毒转录功能。N蛋白在病毒复制过程中还可以结合新生的病毒RNA,阻止双链RNA(dsRNA)中间体的形成,从而避免被宿主细胞内RNA传感器介导的先天免疫应答反应所识别[2]。不仅如此,N、M蛋白可通过降低宿主细胞的其他抗病毒反应进行免疫逃逸[3-6]。据报道,M蛋白也可通过抑制宿主基因mRNA的核-质运输进程,在整体上抑制宿主基因的表达水平[7]。
宿主细胞可以利用多种机制对抗入侵的病毒[8]。VSV亦可借助多种宿主因子来抵抗、逃避宿主细胞的应答反应,实现复制增殖[9]。已有研究表明,宿主因子干扰素(IFN)诱导蛋白35(IFI35)在VSV感染过程中对IFN的抗病毒反应具有负向调控作用,其可通过抑制视黄酸诱导的基因I(RIG-I)的激活,削弱其作为RNA传感器在细胞抗病毒反应中的重要作用,抑制IFN的产生,进而促进VSV复制。干扰素诱导蛋白44(IFI44)是另一种IFN诱导产生的蛋白,其表达水平可被IFN-α、IFN-β所诱导,但不可被IFN-γ诱导[10]。还有研究报道IFI44因子参与庆大霉素诱导的耳毒性和肾毒性相关的炎症反应进程[11]。IFI44在各种病毒感染过程中展现的作用因病毒种类不同而有所差异。IFI44可通过抑制人类免疫缺陷病毒1型(HIV-1)的LTR 启动子的活性从而影响病毒转录[12]。当髓系来源细胞HAP-1感染Ⅰ型甲流病毒(IAV)时,IFI44与细胞因子FK506结合蛋白5(FKBP5)发生相互作用,负调控宿主细胞的抗病毒应答,进而促进病毒复制[13]。此外,IFI44还参与了如肿瘤细胞增殖及抗辐射效应等多种生物学进程。
本试验通过构建IFI44基因沉默和过表达载体、包装慢病毒、分别建立IFI44沉默及过表达细胞系,探讨宿主因子IFI44对VSV复制增殖的影响。本研究不仅为揭示VSV 的致病机理奠定基础,也为探索VS的疫病防控提供新的思路。
1 材料与方法
1.1 细胞及病毒小鼠巨噬细胞系RAW264.7、293T细胞及VSV均由本实验室保存。
1.2 试剂EasyGeno快速重组克隆试剂盒、无内毒素质粒大量提取试剂盒、凝胶回收试剂盒购自天根公司;限制性内切酶KpnⅠ、EcoRⅠ、BamHⅠ及T4DNA连接酶购自TaKaRa公司;嘌呤霉素、DMEM培养液及双抗购自美仑公司;血清购自Gibco公司;转染试剂LipoFiter 3.0购自汉恒公司。
1.3 IFI44基因沉默慢病毒载体的设计和构建参照GenBank数据库中的鼠源IFI44的基因序列(登录号:NM_133871.3),利用在线软件http://rnaidesigner.thermofisher.com/rnaiexpress/设计2条靶向该基因的shRNA序列。将用于合成shRNA的2对引物稀释为10 μmol/L后各取2 μL,再加入2 μL的T4DNA连接酶(10 ×)、1 μL T4PNK及ddH2O补足至20 μL体系,瞬时离心混合后置于37℃水浴30~40 min,95℃煮沸5 min,自然降温至室温,形成双链Oligo。同时,用限制性内切酶BamHⅠ和EcoRⅠ对空载体 pLVX-shRNA-Puro进行双酶切,通过琼脂糖凝胶电泳回收线性化的载体片段。将上述退火形成的Oligo与线性化载体片段进行连接、转化、涂板,挑取单克隆进行质粒大量提取制备。
1.4 IFI44基因过表达慢病毒载体的设计和构建按照EasyGeno Primer无缝克隆在线设计原则,以同源重组的方式构建重组质粒,依据IFI44的基因编码序列以及空载体pLVX-IRES-Puro的多克隆位点区设计引物。以合成的10 μmol/L引物、PrimerStar Max预混液、来自于RAW264.7细胞的cDNA为模板扩增IFI44基因编码区序列(携带质粒同源臂),与经酶切线性化的载体片段按一定比例混合,加入5 μL的2×Easy Geno Assembly Mix,用ddH2O补足至10 μL后,将混合反应液置于50℃水浴孵育15 min。随后进行瞬时离心,并将离心管置于冰上冷却5 min获得连接产物。连接产物进行转化、挑菌、摇菌,测序验证。对验证正确的菌液进行无内毒素质粒大量提取。
1.5 慢病毒颗粒包装将处于DMEM完全营养液(10%血清+1%双抗)中的293T细胞置于37℃、5% CO2培养箱中培养。当细胞汇合度为60%~70%时转染细胞。将汉恒脂质体LipoFiter 3.0加入250 μL的OPTI-MEM营养液中混匀,加入250 μL 用于慢病毒包装的穿梭及骨架质粒,各质粒的比例分别是穿梭质粒∶pspAX2∶pMD2G为4∶4∶1。将上述脂质体试剂和质粒混匀后室温孵育20 min,缓慢加入到生长于6孔板中的293T细胞中,并将细胞置于培养箱中培养48 h,收取慢病毒上清备用。
1.6 IFI44基因沉默及过表达细胞系构建用收集的病毒液(MOI=10)感染RAW264.7细胞,静置培养细胞72 h,观察细胞状态,换成含3 mg/L嘌呤霉素、2%血清的DMEM完全营养液进行阳性细胞筛选,每2 d换1次含嘌呤霉素的培养液,直至最终得到具有嘌呤霉素抗性的基因修饰细胞系。
1.7 VSV感染基因修饰细胞系将IFI44基因沉默/过表达细胞系及其相应对照细胞培养至细胞汇合度为85%时接种VSV(MOI=1),8 h后收集上清液进行病毒半数组织培养感染剂量(TCID50)测定,同时将细胞裂解提取细胞总RNA、反转录成cDNA,并利用实时荧光定量 PCR 以 VSV的P基因及反向基因组引物序列进行分析[8]。
2 结果
2.1 设计、构建重组IFI44基因沉默、过表达质粒IFI44基因沉默质粒设计如图1A所示,从GenBank获取鼠源IFI44的基因序列,利用在线软件设计2条靶向该基因的shRNA序列。分别添加BamHⅠ、EcoRⅠ酶切位点于上、下游引物末端,引物序列如表1所示。将经退火形成的双链Oligo与线性化穿梭载体pLVX-shRNA-Puro(经BamHⅠ和EcoRⅠ双酶切)进行连接、转化。IFI44基因过表达质粒设计如图1B所示。通过EasyGeno无缝克隆在线软件设计扩增IFI44基因的引物序列(表2)。提取小鼠巨噬细胞系总RNA后反转录成cDNA,再以此为模板通过PCR法扩增得到IFI44编码区全长片段,此目的片段携带靶向载体的同源序列。将该产物回收纯化后以同源重组的形式插入靶向慢病毒载体pLVX-IRES-Puro中。经菌液PCR及测序测定后大量提取扩增,获得重组质粒。
A.IFI44沉默载体;B.IFI44过表达载体

表1 IFI44的 shRNA引物

表2 IFI44的基因扩增引物
2.2 慢病毒包装、细胞感染及筛选鉴定以上述构建的IFI44基因沉默载体和过表达载体作为穿梭质粒与慢病毒骨架质粒pspAX2及pMD2G共同转染293T细胞,转染比例为4∶4∶1。转染细胞72 h后收集含病毒液的细胞上清,感染小鼠巨噬细胞系RAW264.7,病毒感染48 h后以3 mg/L嘌呤霉素进行筛选,同时设置空载病毒进行感染、筛选,作为对照。将经嘌呤霉素筛选后的上述细胞分别裂解、提取总RNA、反转录cDNA、进行qPCR检测。结果显示,2个shIFI44慢病毒感染组的IFI44基因转录水平显著降低,表明成功构建IFI44基因沉默细胞系(图2)。依照上述试验方案,包装携带IFI44基因的慢病毒颗粒,并对RAW264.7进行感染、筛选,获得具有抗性的细胞系。对细胞进行裂解、RNA提取、cDNA合成及qPCR检测。结果显示,IFI44的转录水平显著上调,表明成功构建IFI44 基因过表达细胞系(图3)。
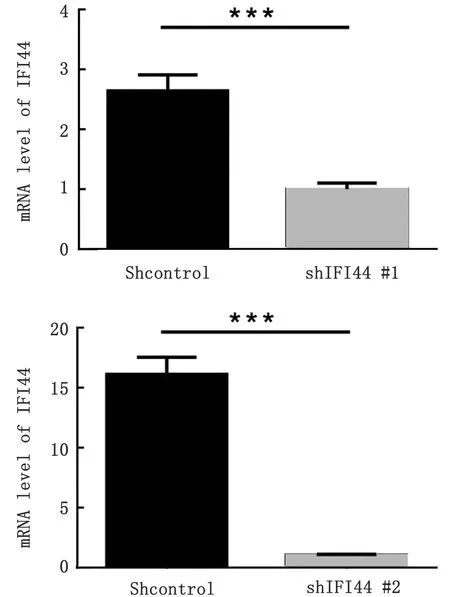
***示P<0.001

****示P<0.000 1
2.3 IFI44基因沉默对VSV复制增殖的影响将上述筛选获得的IFI44沉默细胞系及相应空载体对照细胞系感染VSV(MOI=1)10 h后收集细胞。裂解、提取细胞总 RNA,随后反转录成 cDNA 并进行 Real-time PCR 检测。与对照组细胞相比发现,VSV-P蛋白的mRNA水平显著下降,表明病毒的转录进程受到抑制(图4A)。不仅如此,IFI44基因沉默也使得VSV的反向基因组水平被显著削弱,表明VSV的复制增殖受到抑制(图4B)。此外,TCID50测定试验也证实了IFI44基因沉默的抗病毒效果(图4C)。

A.VSV-P mRNA水平;B.VSV反向基因组水平;C.TCID50。***示P<0.001
2.4 IFI44基因过表达对VSV复制增殖的影响将上述筛选获得的IFI44基因过表达细胞系及相应空载体对照细胞系感染VSV(MOI=1)10 h后收集细胞,裂解细胞、提取细胞总RNA、反转录成cDNA并进行荧光定量PCR法检测。经与对照组细胞比较发现,IFI44过表达显著上调VSV-P的基因转录水平,表明此时病毒转录进程受到促进(图5A)。同时,IFI44过表达也会显著提高VSV的反向基因组水平,表明促进了VSV的复制增殖(图5B)。此外,TCID50测定试验也证实了IFI44基因过表达的促病毒效果(图5C)。

A.VSV-P mRNA水平;B.VSV反向基因组水平;C.TCID50。*示P<0.05;****示P<0.000 1
3 讨论
近年来,非洲猪瘟和小反刍兽疫等外来疫病的传入给我国家畜养殖业带来了重大的经济损失。因此,加强对尚未传入我国的外来疫病的防控、增强相关理论及技术研究储备,对于家畜生产安全、食品供应安全至关重要。VS是一种可感染多种家畜动物和人的急性、高度接触性传染病,是《国家中长期动物疫病防治规划(2012-2020年)》中重点防范的13种外来动物疫病之一。VS的发病由VSV感染引起,虽然患畜因VSV感染直接导致死亡的情况较少,但由此引发的其他病原继发性感染仍然会给畜牧养殖业造成重大损失。VSV的自然宿主包括牛、猪、马等动物,VSV感染人的案例也偶有报道,感染者常常出现轻度流感样症状,而重症患者则具有脑炎症状[14-15]。
作为一种具有广泛细胞嗜性的病毒,VSV侵入细胞时被宿主模式识别受体识别,进而诱导宿主细胞产生IFN及其相关因子[16-17]。宿主细胞内IFN的产生对机体抵抗病毒、限制病毒复制及清除病毒的进程中至关重要[18]。然而,研究发现,某些IFN诱导蛋白并未起到抗病毒作用。例如,IFI35对宿主细胞的抗病毒应答反应可以起到负向调控的作用,而这一调节作用可作为宿主炎性反应的稳态调控机制,以维持细胞内促炎-抗炎水平的平衡[8]。由IFN诱导的IFI44可参与多种病理生理进程,如对病毒的应答反应、参与系统性红斑狼疮的发病、对辐射的抵抗及调控肿瘤生长的特性[10]。最新研究发现,表达在非小细胞肺癌(NSCLC)细胞中的IFI44因子可以被长非编码RNA(lncRNA)LINC01116所靶向抑制,在肿瘤对吉非替尼的耐药进程中起到关键作用[19]。此外,作为IFI44的旁系同源基因,IFI44L被发现具有负向调节IFN先天免疫反应的作用。IFI44L基因沉默可限制病毒的复制,这有助于调节、限制由病毒诱导产生的炎症反应[20]。然而,IFI44在VSV感染巨噬细胞后的具体作用尚有待研究。
为明确宿主因子IFI44在VSV复制增殖过程中的作用,本试验首先包装携带IFI44基因靶向shRNA的慢病毒以及携带IFI44基因编码区的慢病毒,随后感染RAW264.7细胞,并建立IFI44基因沉默及过表达细胞系。通过RT-qPCR方法对基因修饰结果进行验证,结果发现宿主因子IFI44可促进病毒的复制增殖。然而,目前尚不明确VSV复制增殖过程中的哪些进程受IFI44的调控。探究IFI44在宿主细胞内的促病毒作用规律则有待于深入探索。
