棉花核酸外切酶基因GhWRN的克隆及功能验证
2021-06-19薛羽君魏恒玲王寒涛马亮程帅帅郝蓬勃顾丽姣付小康芦建华喻树迅
薛羽君,魏恒玲,王寒涛,马亮,程帅帅,郝蓬勃,顾丽姣,付小康,芦建华,喻树迅
(中国农业科学院棉花研究所/棉花生物学国家重点试验室,河南安阳455000)
作为1种水解磷酸键的酶,核酸酶可以剪切核酸中的3′或者5′磷酸二酯键,它对DNA和RNA的剪切催化功能是各种生命体中必不可少的。例如,5′-3′核酸外切酶和核酸内切酶参与DNA复制过程,同时也是移除RNA引物的必需组分;3′-5′核酸外切酶是DNA校正修复过程的必需组分,因此核酸酶的活性是DNA完整复制的保证[1-4]。核酸酶突变的植物,在种子发育、管状细胞及维管组织发育中都显现出不同程度的生长发育障碍。核酸酶功能缺失的高等植物会因核酸降解失衡从而出现各种畸形发育,也会影响植物幼苗期的光形态建成,从而造成植株的生长停滞与死亡。如百日草(Zinnia elegans)的核酸内切酶ZEN1在不影响液泡形态的前提下调节细胞核中DNA的降解,从而特异地调控管状细胞的衰 老 和 死 亡[5]。杜 仲(Eucomm ia ulmoides)中 的EuCaN1和EuCaN2基因编码Ca2+依赖的核酸内切酶,定位于细胞核,具有降解DNA的功能。这2个基因经RNA干扰后,其转基因植株的次级木质部出现分化异常的情况[6]。对拟南芥(Arabidopsis thaliana)核酸内外切酶研究发现,核酸内外切酶突变体出现植株发育畸形的表型。在菜豆(Phaseolus coccineus)相关研究中发现,DNA降解对各器官的平衡和发育起到了重要的作用[7-8]。PARN(Poly A-specific 3′-5′ribonuclease,多聚腺苷酸特异性核酸酶)能高效降低真核生物mRNA的聚腺苷酸尾,缺乏PARN的拟南芥胚发育明显受阻,并且在光形态建成时期子叶会弯曲并停止生长,表明RNA的降解影响植物的生长发育过程[9]。拟南芥植物体中存在1种小干扰RNA(Small interfering RNA,siRNA)合成及微小RNA(M icroRNA,m iRNA)降解相关的RNA结合蛋白,该蛋白的缺失突变体出现m iRNA积累和植株生长发育缺陷[10]。
核酸酶不仅参与植物生长发育,也参与非生物胁迫应答调控[11]。相关试验证明,大麦(Hordeum vulgareL.)中的Bnuc1核酸酶在盐胁迫或者外源脱落酸(Abscisic acid,ABA)处理下诱导表达,但在种子萌发阶段外源施加赤霉素(Gibberellin,GA)时该酶无响应[12]。拟南芥中RNase通过调控mRNA的降解来影响HSP70蛋白的活性和丰度,从而影响植株对高温胁迫的响应[13]。试验表明拟南芥RNase突变体中miRNA积累,对盐胁迫更敏感[14]。以上研究表明,拟南芥、大麦等植物中一些核酸酶基因参与植物的生长发育及非生物胁迫应答。
基于不同熟性陆地棉品种转录组数据[15],通过生物信息学分析所得差异表达基因,筛选出与棉花早熟相关的基因,从中发现含有WRN-exo结构域的DnaQ核酸外切酶。通过查阅文献,发现在人和动物及多种植物中均报道过该核酸酶,而棉花中的WRN-exo未见报道。因此,本研究通过克隆得到1个棉花核酸外切酶基因GhWRN,分析该基因在不同棉花品种花芽分化中的特点及组织特异性的表达特征,克隆获得该基因的启动子序列并进行顺式作用元件分析,在第四片真叶展平期对幼芽喷施外源激素,通过qRT-PCR(Quantitative real-time polymerase chain reaction,实时荧光定量-聚合酶链式反应)分析GhWRN基因响应植物激素时的表达特征,构建植物的过表达载体得到转基因拟南芥并观察其表型,从而为深入研究核酸外切酶参与棉花生长发育及调控植物在激素处理后的应答模式奠定基础。
1 材料与方法
1.1 试验材料
本试验以陆地棉早熟品种盐早2号和晚熟品种国欣11为试验材料,种植于中国农业科学院棉花研究所东场试验田(河南省安阳县),大田常规管理。
取盐早2号和国欣11幼苗子叶展平期、第一至第五片真叶展平期共6个时期顶芽样品。取盐早2号盛花期的根、茎、叶、苞片、萼片、花瓣、雄蕊、雌蕊,所有材料于-80℃保存备用。本试验所用野生型拟南芥为哥伦比亚型(Col-0生态型),由中国农业科学院棉花研究所棉花早熟育种课题保存,培养在温度为22℃、光周期为16 h光照/8 h黑暗的温室。
1.2 试验方法
1.2.1GhWRN基因的克隆。采用北京天根生化科技公司植物总RNA提取试剂盒提取盐早2号第五片真叶展平期顶芽中的RNA,利用超微量分光光度仪检测总RNA的浓度和纯度。利用PrimeScript RT reagent kit with gDNA Eraser(Perfect Real Time)试剂盒(宝生物,中国大连)将RNA反转录合成第1链cDNA,以该cDNA为模板,利用Oligo 7软件设计特异引物GhWRN-F/R(表1),扩增GhWRN基因的全长cDNA序列。将目的条带切胶回收后,与pGEM-T Easy载体连接,转化至大肠杆菌DH5α感受态细胞(诺唯赞,中国南京),挑取单克隆,经菌液PCR鉴定正确后,送由尚亚技术生物(郑州)有限公司测序。
1.2.2GhWRN基因的生物信息学分析。将GhWRN基因的DNA序列提交到Gene Structure Display Server online software(http://gsds.cbi.pku.edu.cn./)网站预测基因结构。使用DNAMAN软件进行序列比对,利用MEGA7软件的邻接法(Neighbor-Joining,NJ)构建进化树。使用ExPASy在线工具(http://www.expasy.org/tools/)分析GhWRN的蛋白质分子量和等电点。用CBSTMHMM(http://www.cbs.dtu.dk/services/TMHMM-2.0/)和CBS-SignalP(http://www.cbs.dtu.dk/services/SignalP/)分析蛋白质的跨膜结构和信号肽。利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.htm l)和ExPASy-SW ISS-MODEL(https://www.sw issmodel.expasy.org/)预测蛋白质的二级和三级结构。在Cotton-FGD上获得GhWRN(Gh_D12G1228)基因转录起始位点上游1 500 bp的核苷酸序列,使用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/htm l/)进行在线分析和功能预测。
1.2.3激素处理棉花幼苗。根据GhWRN基因启动子的分析结果,对正常生长的第四片真叶展平期的盐早2号,分别用以下激素叶面喷施:100μmol·L-1的生长素(Auxin,IAA)、200μmol·L-1的脱落酸(Abscisic acid,ABA)和5 mmol·L-1的水杨酸(Salicylic acid,SA),同时将600 m L蒸馏水加200μL无水乙醇(各激素溶解时使用200μL无水乙醇溶解)作为对照,取处理前(0 h)及处理后0.5 h、1.5 h、3 h、6 h、9 h、12 h、24 h的顶芽,各处理重复3次,各重复取3个样品,置于液氮中速冻,保存于-80℃备用。
1.2.4转基因拟南芥的遗传转化及表型鉴定。采用农杆菌介导的花序浸染法[16],将构建的含35S∷GhWRN的pBI121表达载体转化野生型拟南芥,使用含有卡那霉素的1/2MS培养基筛选转基因苗,将每一代的阳性植株移栽种植并检测,至T3开始表型观察、鉴定工作。取生长4周的T3阳性拟南芥和野生型拟南芥的叶片,采用CTAB法[17]提取DNA,以野生型拟南芥(WT)作为阴性对照。利用35S启动子序列的上游引物At35S-F(表1)及GhWRN基因下游引物GhWRN-R进行转基因检测,使用1%琼脂糖凝胶电泳检测。根据T3植株表型观察,提取生长28 d的已开花的T3转基因拟南芥叶片RNA,选取拟南芥花发育相关的关键基因AtFT、AtSOC1、AtAP1、AtFUL进行基因表达量分析,荧光定量引物见表1。
1.2.5GhWRN基因的qRT-PCR分析。使用Oligo 7设计GhWRN的荧光定量引物qRT-PCRF/R (表1),以GhHistone3(Accession No.:AF024716)作为棉花的内参基因,Atactin2为拟南芥内参基因,分析GhWRN基因在不同陆地棉品种、盐早2号不同处理下的表达模式,每个样本做3次生物学重复。qRT-PCR反应体系和反应程序按照SYBR Prem ix ExTaq(DRR041A)荧光定量试剂盒说明书进行操作,所用仪器为ABI 7500Real Time PCRSystem(ABI,美国)。每个样品重复3次,目的基因的相对表达量采用2-ΔΔCT方法[18]计算,所得数据利用GraphPad Prism5软件绘图。

表1 本研究中使用的引物Table 1 Primers used in this study
2 结果与分析
2.1 GhWRN基因克隆及特征分析
从转录组数据[15]中获得1个在不同熟性陆地棉品种中表达存在明显差异的Coding sequence(CDS),在CottonFGD网站上进行Blast序列比对,根据南京农业大学测序基因组[19]获得该基因(Gh_D12G1228)的开放阅读框(Open reading frame,ORF)序列,发现该基因是含有WRN-exo结构域的DnaQ核酸外切酶,所以将该基因命名为GhWRN。以cDNA模板进行PCR扩增,经检测条带正确后,送测序分析。该GhWRN基因ORF为798 bp,无内含子。
通过National Center for Biotechnology Information(NCBI,https://www.ncbi.nlm.nih.gov/)的非冗余蛋白数据库搜索GhWRN蛋白同源序列,发现可可(Theobroma cacao)XP_007051231.2、哥伦比亚锦葵(Herrania umbratical)XP_021279751.1、辣椒(Capsicum annuum)KAF3629001.1、烟草(Nicotiana attenuate)OIT08451.1与GhWRN蛋白相似性分别为68%、68%、51%、48%,拟南芥(A.thaliana)At5g06450蛋白为含DnaQ-like的核酸外切酶[20]。对以上6个蛋白进行多序列比对,使用MEGA7软件构建系统发育树,表明GhWRN与可可、哥伦比亚锦葵的同源蛋白的亲缘关系最近(图1)。
GhWRN蛋白包含265个氨基酸,预测相对分子量是30.23 kDa,等电点是9.58。序列进行分析,发现GhWRN蛋白中富含赖氨酸(13.6%)、亮氨酸(9.8%)和丙氨酸(7.9%),含少量色氨酸(0.8%),不含吡咯赖氨酸、硒半胱氨酸;蛋白整体呈碱性且带正电荷,其中带负电荷的残基31个,带正电荷的残基49个;预测半衰期约为30 h;蛋白不稳定指数为28.58,指数较低为稳定蛋白。蛋白的亲疏水性分析发现,亲水性氨基酸明显多于疏水性氨基酸,亲水性平均系数为-0.451,因此该蛋白属亲水性蛋白。
CBS-TMHMM在线预测表明,GhWRN蛋白含跨膜螺旋的氨基酸期望值为17.20876,推测不存在跨膜螺旋结构;且CBS-SignalP在线预测其不存在信号肽,综合推测GhWRN是非分泌蛋白。由SOPMA软件对该蛋白的氨基酸序列二级结构进行预测。结果表明,该蛋白主要由α-螺旋构成。用ExPASy-SWISS-MODEL对蛋白进行三维结构预测,结果显示该蛋白的三级结构多为α-螺旋和无规则卷曲。
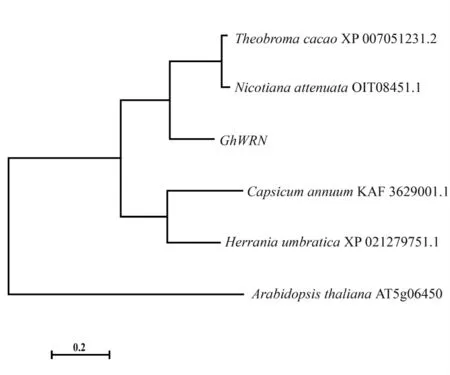
图1 GhWRN进化树分析Fig.1 Phylogenetic tree analysis of GhWRN proteins
2.2 GhWRN基因的启动子生物信息学分析
对GhWRN基因上游1 500 bp启动子序列进行分析,结果表明:该启动子包含多个典型的核心元件,如TATA框和CAAT框。此外,该启动子还包含丰富的顺式调控元件:环境胁迫响应元件,如光响应元件(Box4、G-Box、GT1-motif、MRE、TCCC-motif等)、逆境胁迫响应元件(TC-rich repeats)等;激素响应元件,如脱落酸响应元件(ABRE)、生长素响应元件(AuxRR-core、TGA-element)等(表2)。表明GhWRN基因的表达可能与非生物胁迫及植物激素诱导相关。
2.3 GhWRN基因的表达分析
通过qRT-PCR分析GhWRN基因在不同熟性陆地棉真叶期(True leaf stage,TLS)顶芽及各组织的表达特征。结果显示,在早熟材料盐早2号的2片真叶期(两叶期)至五叶期该基因表达量显著增加;在晚熟材料国欣11各时期表达量无显著变化(图2A),与其在盐早2号两叶期表达量相当。提取盐早2号四叶期的根、茎、叶、花瓣、雄蕊、雌蕊、苞片、副萼,进行组织特异性表达分析。结果表明,GhWRN基因在不同组织中均有表达,在苞片、雄蕊、叶中表达量较高,在根中表达量最低(图2B)。

表2 GhWRN基因启动子调控元件预测Table 2 Prediction of cis-elements of GhWRN promoter
2.4 GhWRN基因响应植物激素的表达分析

图2 GhWRN基因的特异性表达分析Fig.2 Expression specificity analysis of GhWRN gene
通过qRT-PCR分析在不同植物激素处理下棉花顶芽中GhWRN基因表达量的变化。结果显示(图4):ABA处理后0.5 h,该基因表达量较对照极显著升高;处理后12 h、24 h该基因表达量较对照显著下降(图3A)。IAA处理后除1.5 h、6 h外,其他检测时期该基因表达量较对照均显著升高(图3B)。SA处理后9 h、12 h该基因表达量存在显著差异(图3C)。不同激素诱导后不同时间GhWRN基因表达水平不同,脱落酸、生长素极显著诱导GhWRN基因上调表达,表明GhWRN基因的表达受外源激素的调控,推测这些调控与启动子中的激素响应元件相关。
2.5 转基因拟南芥的鉴定
观察野生型拟南芥与转基因T3拟南芥的表型,发现生长至28 d时,转基因拟南芥T3陆续开花而野生型拟南芥刚刚完成莲座叶生长(图4A)。选取野生型拟南芥及3个转基因拟南芥株系,每个株系各挑选4株植株混取叶片,对Gh-WRN基因表达进行定量检测。试验结果显示,3个阳性株系均能检测到目的条带;转基因拟南芥株系GhWRN基因在3个阳性株系中的表达量都很高且显著高于野生型(图4B、4C),说明已获得稳定的转基因拟南芥阳性株。为了确定开花时间,对野生型拟南芥和T3转基因拟南芥开花时的莲座叶数和开花天数进行了数据统计,发现转基因拟南芥各株系的开花时间比野生型的拟南芥提前约5.5 d。其中,野生型拟南芥从抽薹(茎长1 cm)至首次开花为32.8 d,莲座叶平均数为11.9;T3转基因拟南芥株系从抽薹至首次开花平均为27.3 d,莲座叶平均数为9.3(表3)。综合T3阳性株基因表达量、开花时间及提前开花的表型判断,GhWRN基因与植株开花时间有关。
2.6 GhWRN影响花发育信号通路相关基因的表达
为了研究过表达GhWRN在拟南芥中促进开花的分子机制,选取花发育相关的关键基因进行荧光定量分析。结果发现,与花发育相关的基因AtFT、AtSOC1和AtFUL的表达量在T3转基因拟南芥中表达量极显著高于野生型,AtAP1表达量与野生型无显著差异(图5)。推测GhWRN在AtSOC1、AtFT、AtFUL基因组成的相关开花调控通路中发挥功能。

图3 GhWRN基因响应植物激素的表达分析Fig.3 Expression analysis of GhWRN gene in response to plant hormones
3 讨论
GhWRN蛋白富含赖氨酸、亮氨酸和丙氨酸,色氨酸含量较少,核酸酶由高度亲水性氨基酸赖氨酸等组成,这种亲水性可能使该酶更易于同底物(水)发生反应[11]。二级结构预测显示GhWRN蛋白主要由α-螺旋组成,前人研究报道指出DnaQ-like核酸外切酶有1个绝对保守的DEDD功能域,该功能域中的保守酸性氨基酸残基多数位于α-螺旋中,GhWRN蛋白具有相同的结构,推测行使相同的功能[22]。聚类分析表明,GhWRN蛋白与可可、哥伦比亚锦葵的WRN蛋白的同源性较高。
在植物体中大部分DNA酶和RNA酶受生物胁迫影响,并且部分核酸酶的功能缺失与植物逆境抗性相关[11]。黄瓜为单性花,CsCAN核酸酶基因在其雌花发育过程特异表达。在施加外源乙烯前体物质后,收集处理后4、8、12、16、20和24 h幼苗子叶,结果显示随着时间的延长CsCAN核酸酶基因上调表达从2倍增加到4倍,表明乙烯和CsCAN活性之间的关系并不简单[23]。水稻和拟南芥中的BBD(Bifunctional nuclease in basal defense response,碱基防御反应中的双功能核酸酶)蛋白是1种DNA酶和RNA酶双功能核酸酶,水稻OmBBD基因在100μmol·L-1外源ABA处理后1、2、3、4 h表达量明显增加,表明该基因受ABA的诱导[24]。本试验中外源IAA或ABA处理后,GhWRN基因表达量有明显升高的趋势,推测该基因与调控植物应对外源激素等环境变化相关。

图4 转基因拟南芥的表型及基因表达情况Fig.4 The phenotypes of transgenic A.thaliana p lants and GhWRN gene expression pattern
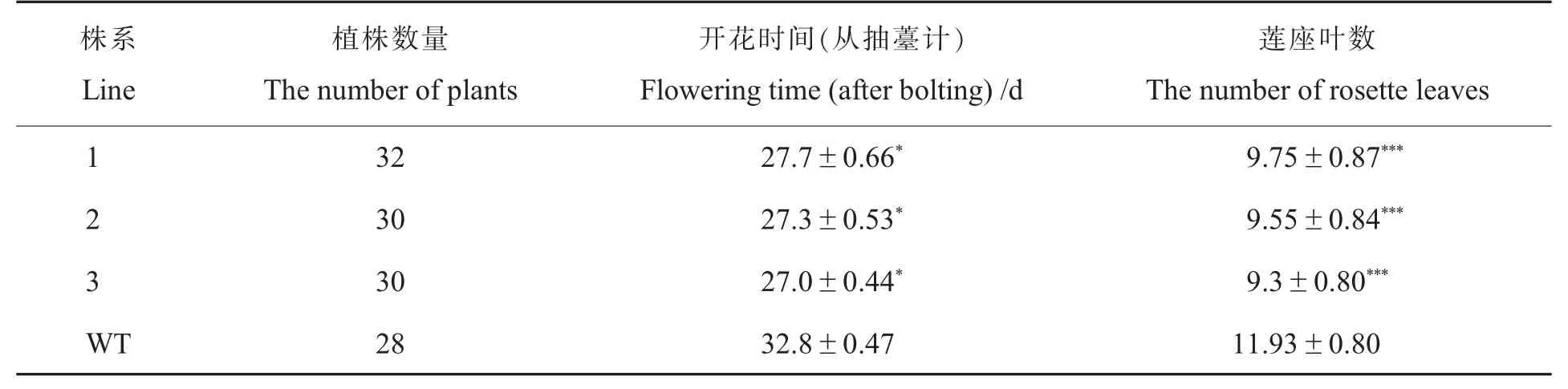
表3 抽薹时莲座叶片数Table 3 Rosette leaf number at bolting
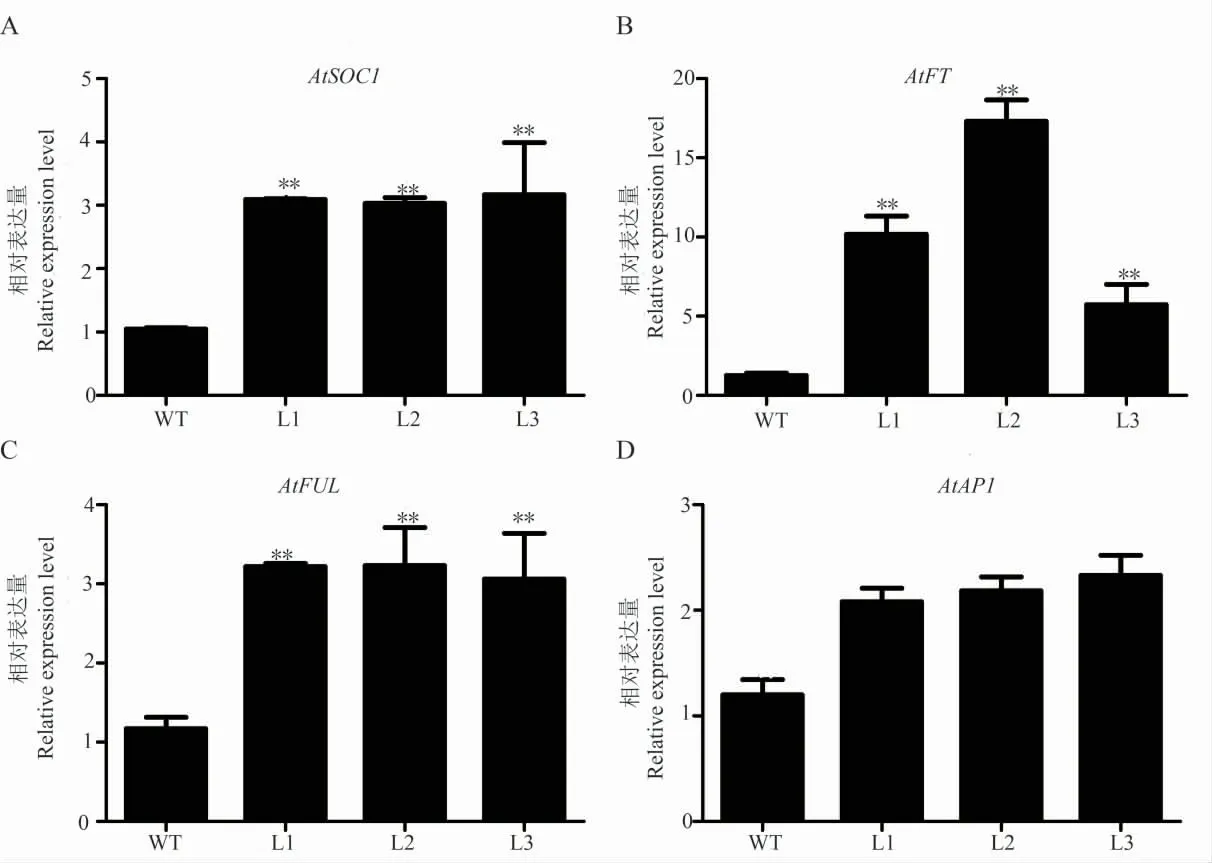
图5 转基因拟南芥内源开花基因表达分析Fig.5 Expression analysis of endogenous flowering-related genes of transgenic A.thaliana
花芽分化是植物由营养生长向生殖生长转化开始的标志,石蜡切片证明早熟品种是在二叶期开始花芽的分化[21]。我们对不同熟性棉花品种的子叶、不同真叶期的叶片进行GhWRN基因表达检测,GhWRN基因在早熟棉二叶期的表达量升高且在花器官中表达量较高,推测该基因可能与棉花熟性及花芽分化有关。拟南芥是一种十字花科植物,广泛用于植物遗传学、发育生物学和分子生物学的研究,已成为一种典型的模式植物,对于植物开花时间相关的基因调控有较深入研究。已有研究表明FT作为1种成花素,在光周期途径调控下转移到顶芽中,与转录因子FD一起激活开花途径的整合因子SOC1,该整合因子以及其他的调控因子最后直接或间接地激活AP1,促使花器官形成[21]。但是,在烟草、拟南芥等植物中发现,FUL在控制花序形态和花分生组织方面与AP1功能重叠,FUL同样具有促进开花的功能[24-27]。棉花研究中,发现开花相关基因Gh-FLP1超表达拟南芥会促进其内源开花基因SOC1、FT等不同程度的上调[28]。从荧光定量结果来看,转GhWRN基因拟南芥中AtFT、AtSOC1和AtFUL基因表达量极显著升高,而AtAP1表达量无显著变化。总之,GhWRN在早熟棉花品种花芽分化时期及花器官中表达量较高,且过表达GhWRN的拟南芥植株开花提前,因此推测GhWRN基因在植物中过量表达能促使AtFT升高进而激活整合因子AtSOC1,最后激活促开花因子AtFUL而非AtAP1,从而促使转基因拟南芥植株早开花。但对于该基因如何具体参与调控棉花开花机制仍需要进一步深入的研究。
4 结论
本研究从陆地棉盐早2号中克隆出GhWRN基因,开放阅读框长度为798 bp,编码265个氨基酸。GhWRN基因无跨膜结构,为非分泌蛋白,包含高度保守的WRN-exo功能域。GhWRN基因在早熟棉花品种花芽分化时期及雄蕊、苞片等花器官中表达量较高。启动子中包含多个胁迫响应元件和激素响应元件,外源ABA及IAA诱导GhWRN基因显著上调表达。在拟南芥中过表达GhWRN基因发现GhWRN在植物开花时间方面发挥重要作用,推测该核酸外切酶基因通过参与花发育过程调控植物开花。
