土壤环境因子对棉花根际与内生拮抗细菌存活数量的影响
2021-06-19党文芳刘萍管力慧杨红梅牛新湘李萍楚敏娄恺史应武
党文芳,刘萍,管力慧,杨红梅,牛新湘,李萍,楚敏,娄恺,史应武,3,6*
(1.新疆农业科学院微生物应用研究所,乌鲁木齐830091;2.新疆大学生命科学与技术学院,乌鲁木齐830052;3.新疆特殊环境微生物实验室,乌鲁木齐830091;4.新疆农业科学院土壤肥料与农业节水研究所,乌鲁木齐830091;5.新疆库尔勒市农业技术推广站,新疆库尔勒841000;6.农业农村部西北绿洲农业环境重点实验室,乌鲁木齐830091)
随着对生防微生物防病机制研究的不断深入,生防微生物在农田的高效应用及其适应土壤生境的生态学条件研究已成为热点[1-5]。其中,生防微生物的生防效果取决于生防微生物菌剂应用的生态环境条件及相应农作物的长势等观点已经明确。因此,筛选出适应当地生态环境的生防微生物菌株,并通过研究土壤环境对外源施入生防微生物群落结构的影响,对生防微生物菌剂的合理开发和高效应用具有重要的理论指导价值[6]。
目前,有关生防微生物的适应性研究多限于探讨其在植物植株中的定植变化规律及其定植后对植物生长的影响和防病效果的研究,对复杂的土壤环境的适应性及与其宿主相关性的报道还很少见,而生防微生物与复杂的农田环境的关系决定了生防微生物的定植能力,进而影响防治病害的效果及其田间实际应用价值[7-13]。笔者团队[14-15]前期从新疆棉田土壤中筛选出4个棉花黄萎病病原菌大丽轮枝菌(Verticillium dahilae)的拮抗细菌菌株,鉴定为BacillusvelezensisBHZ-29(贝莱斯芽孢杆菌BHZ-29)、B.subtilisSHT-15(枯草芽孢杆菌SHT-15)、B.atrophaeusSHZ-24(萎缩芽孢杆菌SHZ-24)和B.vanilleaSMT-24(香草芽孢杆菌SMT-24);与大丽轮枝菌共培养发现,4个菌株能通过减少大丽轮枝菌分生孢子形成、破坏大丽轮枝菌菌丝和孢子形态、导致大丽轮枝菌细胞膜破裂和降低大丽轮枝菌毒蛋白的含量等达到抑制病原菌的作用。王娜等[16]指出不同内生细菌在棉花体内的定植规律不同,且在棉苗中定植一定数量后才能对棉花黄萎病产生较高的防治效果。高毓晗等发现枯草芽孢杆菌168被修复基因后其定植能力显著上升,对番茄细菌性枯萎病和黄瓜镰刀菌枯萎病的防效大幅上升[17-18]。据此,研究4个菌株在土壤环境中的适应能力有助于发挥其防治棉花黄萎病的潜力。
为了充分发挥这4个菌株的应用效果,本研究以此为研究对象,在实验室条件下分析土壤理化性质对其存活数量及活性的影响,揭示拮抗细菌在土壤不同理化条件下的适应能力,为这些菌株进一步高效防治棉花黄萎病应用提供数据支撑。
1 材料与方法
1.1 材料
1.1.1土样。取自博乐(BL)、石河子(SHZ)、库尔勒(KEL)试验地土壤。土壤的理化性质由中国科学院新疆生态与地理研究所测定。

表1 不同采样地土壤理化性质Table 1 Soil physical and chem ical properties in different sam pling sites
1.1.2供试病原菌。大丽轮枝菌(Verticillium dahliae)菌株为2015-007,系强致病力菌株[19],由新疆农业科学院植物保护研究所馈赠。
1.1.3供试拮抗细菌。供试菌株均由新疆农业科学院微生物应用研究所史应武研究员课题组筛选得到。其中,BHZ-29、SHZ-24分别从博乐、石河子棉株内筛选得到,SHT-15、SMT-24均从石河子棉株根际土壤中获得。
1.1.4供试棉花品种。新陆早36号由新疆石河子农业科学院棉花研究所馈赠。
1.1.5供试培养基。采用4种培养基试验,即营养肉汤(Nutrient broth,NB)培养基、营养琼脂(Nutrient agar,NA)培养基,查比克(Czapek)培养基、马铃薯葡萄糖琼脂(Potato dextroseagar,PDA)培养基。
1.1.6主要试剂。试剂包括尿素、磷酸二铵(二铵)、硫酸钾、碳酸钠、重碳酸钠、氯化钠、氯化钙、氯化镁、硫酸镁、硫酸钠、盐酸、氢氧化钠。以上试剂均为化学纯试剂。配制0.85%(质量分数)氯化钠溶液。
1.1.7主要仪器。恒温培养振荡器ZHWY-211B型由上海智诚分析仪器制造有限公司生产,超净工作台SWCGCO型由苏州净化设备有限公司生产,SPX-250BF-2型培养箱由上海福玛实验设备有限公司生产,YXQ-LS-75SⅡ型立式压力蒸汽灭菌器由上海博迅实业有限公司生产。
1.2 方法
1.2.1土样的灭菌。同文献[14]。
1.2.2病原菌发酵液制备。同文献[14]。
1.2.3拮抗细菌发酵液制备。同文献[14]。
1.2.4培养皿中理化因子试验方法。试验(1)~(5)以灰漠土为基础进行,量取病原菌1 m L、拮抗细菌3 m L,按照试验设计加入定量灭菌水或混合液于培养皿(直径为90 mm)中,摇匀后再称取40 g灭菌土于培养皿中,放入培养箱进行培养(30℃),每隔一段时间取土样进行拮抗细菌的活菌计数。试验开始后,每天下午18:00用称量法测定土壤含水量,补充当天失去的水分,使各处理保持设定的含水率。
6个土壤理化因子的试验设置如下:(1)3个水分梯度,分别量取10 m L、15 m L、20 m L灭菌水于培养皿中。(2)3个温度梯度,分别为15℃、25℃、30℃,放入培养箱中。(3)3个盐分梯度,含盐量(质量分数)分别为0%、0.3%、0.6%(由碳酸钠、重碳酸钠、氯化钠、氯化钙、氯化镁、硫酸镁、硫酸钠7种盐分等比例混入蒸馏水中灭菌后使用)。(4)3个肥力梯度,分别为T1、T2、T3,按1 kg土添加如下肥料,T1:尿素0.048g,二铵0.073g,硫酸钾0.012 g;T2:尿素0.077 g,二铵0.128 g,硫酸钾0.026 g;T3:尿素0.104 g,二铵0.182 g,硫酸钾0.052 g。上述肥料混入蒸馏水中灭菌后使用。(5)3个pH梯度,用NaOH或盐酸分别调灭菌水pH至5、7、9。(6)3个土壤类型,棕漠土(ZMT,取自新疆库尔勒试验地)、灰漠土(HMT,取自新疆石河子试验地)、棕钙土(ZGT,取自新疆博乐试验地)。
这6个土壤理化因子每个梯度下,用1.2.2的病原菌发酵液(孢子含量107m L-1)与1.2.3的拮抗细菌发酵液[有效活菌数108CFU(菌落形成单位,Colony form ing unit)·m L-1]设置以下8个处理,每个处理3个重复,每皿为1个重复,共有432个培养皿。8个处理:(1)拮抗细菌SHZ-24发酵液;(2)拮抗细菌SHT-15发酵液;(3)拮抗细菌SMT-24发酵液;(4)拮抗细菌BHZ-29发酵液;(5)病原菌发酵液+拮抗细菌SHZ-24发酵液;(6)病原菌发酵液+拮抗细菌SHT-15发酵液;(7)病原菌发酵液+拮抗细菌SMT-24发酵液;(8)病原菌发酵液+拮抗细菌BHZ-29发酵液。
1.2.5盆栽中土壤理化因子试验方法。试验(1)和(2)以灰漠土为基础进行,设置3个土壤理化因子:(1)3个水分处理。每隔1 d浇1次水,每钵10 m L;每隔2 d浇1次水,每钵10 m L;每隔3 d浇1次水,每钵浇10 m L。每隔3 d、2 d和1 d(每钵10 m L水)处理的土壤的含水率分别为10%、15%和20%。(2)设3个肥力处理,T1、T2、T3,肥料配方同1.2.4。施用时将肥料溶入水中浇灌棉苗,施用前将肥料溶入水,分4次灌入土壤:30%作基肥,1片真叶时施20%,棉苗生长15 d时施30%,棉苗生长30 d时施20%。试验期间各处理均灌溉无离子水。(3)3个土壤类型,分别为采自新疆库尔勒(棕漠土)、石河子(灰漠土)、博乐(棕钙土)的土壤。土壤灭菌后进行盆栽试验。
棉苗盆栽种植及防效试验方法:将无菌土装营养钵2/3处,每筒种植4粒颗粒饱满的棉种,覆土后抚平表层土壤,放入智能培养箱出苗,昼/夜光照时间与温度13 h/11 h、26℃/24℃,光照强度6×104lx,培养箱内相对湿度60%。用1.2.2的病原菌发酵液(孢子含量107m L-1)与1.2.3的拮抗细菌发酵液(108CFU·m L-1)设置7个处理。(1)空白处理;(2)仅伤根;(3)伤根+病原菌发酵液;(4)伤根+病原菌发酵液+拮抗细菌SHZ-24发酵液;(5)伤根+病原菌发酵液+拮抗细菌SHT-15发酵液;(6)伤根+病原菌发酵液+拮抗细菌SMT-24发酵液;(7)伤根+病原菌发酵液+拮抗细菌BHZ-29发酵液。每个处理至少做3个重复。在播种一定时间后接种生防细菌和病原菌,调查防病效果。
1.2.6接种方法。播种后18 d左右棉苗1片真叶初现时,每钵棉苗接种拮抗细菌发酵液30 m L(直接将108CFU·m L-1注入棉株)。5 d后将长至两叶一心的棉苗距根底部2~3 cm处用剪刀人工伤根,每钵棉株伤根处灌溉病原菌发酵液(孢子含量107m L-1)10 m L。棉苗置于智能培养箱中培养,每隔2 d浇1次水,每钵10 m L。白天培养箱内温度控制在25℃,夜间温度控制在22℃,土壤相对湿度控制在60%以上,光照良好。
1.2.7拮抗细菌在土壤生境中的活菌数量的测定。采用平板菌落计数法[20]计算土壤中拮抗细菌的数量。接种拮抗细菌后开始取样,每个处理设3个重复,每个重复取3株棉苗根部土壤,挖取棉株根部土壤,混匀(培养皿取样时,每皿选取3个部位挖取土壤),测量土壤的含水率后,称量5 g土壤于250 m L三角瓶中,加入灭菌生理盐水(质量分数为0.85%)45 m L,25℃、180 r·m in-1振荡2 h,再用梯度稀释法进行稀释,将土壤原液稀释至10-4、10-5梯度后涂布在NA固体培养基上,置于30℃恒温箱培养1 d,记录每皿细菌菌落数量,剔除杂菌并计算每克土壤中细菌数量。计算活菌数的相对数量(rN):rN=(N0-N1)/N0。式中,N0为对照组活菌数绝对数量,N1为试验组活菌数绝对数量。
1.2.8防病效果调查。棉花黄萎病发生情况调查方法同文献[15]。分级标准:0级,外表无症状;1级、2级、3级、4级,病叶占总叶片数比例分别为(0,25%]、(25%,50%]、(50%,75%]、(75%,100%]。病情指数(DI)计算公式:DI=∑(DG×NDG)/(DGmax×NT)×100。式中,DG为病级,NDG为相应病级发病株数,DGmax为最高病级(4),NT为调查总株数。1.2.9数据处理与分析。采用MSExcel、Graph-Pad Prism 6和IBM SPSSStatistics 22软件对数据进行分析并作图。
2 结果与分析
2.1 培养皿中土壤理化性质对拮抗细菌存活数量的影响
对培养10 d时不同理化因子下拮抗细菌的存活数量进行方差分析,结果(表2)表明,在6个土壤理化因子中,土壤含水率、土壤肥力和土壤类型对4株菌存活数量的影响均显著(P<0.05);土壤pH、土壤含盐量、土壤温度对SMT-24、SHT-15和BHZ-29存活数量的影响显著(P<0.05),但对SHZ-24存活数量的影响不显著(P>0.05)。选择对4株拮抗细菌影响均显著的土壤因子进行盆栽试验,进一步明确在不同土壤含水率、土壤肥力和土壤类型下4株拮抗细菌在棉苗根部的定植能力及对棉花黄萎病的防病效果。
2.2 盆栽土壤理化因子对拮抗细菌存活的影响
2.2.1土壤肥力对拮抗细菌相对数量的影响。在同一处理时间,不同土壤肥力处理下土壤中各菌株的活菌相对数量存在显著差异 (P<0.05)。BHZ-29菌株在3种土壤中活菌相对数量最高,T2肥力处理40 d时为24.81%,SHZ-24和SHT-15菌株次之,40 d时活菌相对数量分别为1.69%和1.83%;SMT-24菌株在土壤中活菌相对数量最低,T3、T2、T1肥力处理下40 d时分别为0.59%、0.92%和0.79%(图1)。SHZ-24和SMT-24菌株在不同土壤肥力处理下活菌相对数量相差不大,SHZ-24在1.4%~2.8%,SMT-24在0.5%~1.3%。SHT-15菌株在整个时期内在T2肥力处理的土壤中活菌相对数量最高,10 d、20 d、30 d和40 d时分别达到了2.3%、1.77%、2.24%和1.83%,在整个监测时期内变化趋势平稳。在T3肥力下10 d以后,BHZ-29菌株活菌相对数量呈先减小后增大的趋势,T2肥力下呈先增大后减小的趋势,T1肥力下呈持续减小的趋势。BHZ-29菌株在整个时期内在T2肥力处理的土壤中相对数量最高。
2.2.2土壤类型对拮抗细菌相对数量的影响。在同一时间,不同土壤类型处理下土壤中各菌株的菌落相对数量存在显著差异(P<0.05)。在不同土壤类型中,BHZ-29菌株在土壤中活菌相对数量最高,棕漠土处理下40 d时为15.24%;SHZ-24和SHT-15菌株次之,棕钙土中40 d时活菌相对数量分别为2.15%和3.07%;SMT-24菌株活菌相对数量在土壤中最低,灰漠土、棕钙土、棕漠土肥力处理下40 d时分别为0.27%、1.06%和0.63%(图2)。SMT-24菌株活菌相对数量在3种类型土壤中相差不大,其相对数量在0.5%~1.3%,在棕钙土中均呈先增大后减小的趋势。SHT-15菌株活菌相对数量在棕钙土中呈先减小后增大的趋势,在灰漠土和棕漠土中呈先增大后减小的趋势。BHZ-29菌株活菌相对数量在灰漠土呈先增大后减小的趋势,在棕钙土和棕漠土中呈先减小后增大的趋势,40d时分别达到13.32%和15.24%。

表2 4株拮抗细菌在不同土壤理化因子下的菌落存活数量方差分析结果Table 2 Analysis of the variance of the number of surviving antagonistic bacteria under different soil physical and chem ical factors

图1 4株棉花黄萎病菌拮抗细菌在4种不同土壤肥力下的活菌相对数量变化Fig.1 Variation of the relative quantity of four antagonistic bacterial isolates against Verticillium dahliae in four different soil fertilities
2.2.3土壤含水率对拮抗细菌相对数量的影响。在同一时间,不同土壤含水率下土壤中各菌株的菌落相对数量存在显著差异(P<0.05)。在不同土壤含水率下,SHZ-24菌株在土壤中活菌相对数量最大,15%含水率下30 d时达到27.74%,且在20%和15%含水率下均呈现先减小后增大的趋势;SHT-15菌株,在15%和20%含水率下活菌相对数量呈持续减小的趋势,10%含水率下呈先减小后增大的趋势,30 d时为10.85%;在3种含水率下,土壤中SMT-24菌株活菌相对数量相差不大;BHZ-29菌株在10%含水率的土壤中活菌相对数量呈先增大后减小的趋势,且均高于含水率为15%和20%的土壤,在30 d时达到12.85%(图3)。
2.2.4土壤肥力对拮抗细菌防效的影响。4株拮抗细菌在不同肥力处理后20 d时,棉苗在T3土壤中长势良好,发病程度较弱;T2处理的棉苗发病较严重;T1处理的棉苗叶片出现萎蔫症状,发病最重。此时,同一拮抗细菌对棉花黄萎病的防效,在不同肥力处理间均表现显著差异(图4)。T3肥力处理4种拮抗细菌处理对棉花黄萎病的防效最好,SHZ-24、SMT-24、SHT-15、BHZ-29的防效分别为62.12%、63.64%、65.91%和87.12%;T1肥力处理下防效最差,分别为40.77%、44.89%、55.72%和53.87%;T2肥力处理下防效居中,分别为50.02%、51.59%、41.91%和66.89%。
2.2.5 土壤类型对拮抗细菌防效的影响。4株生防细菌处理后20 d时,不同土壤中棉苗子叶均已发病,部分真叶发病。此时,同一拮抗细菌对棉花黄萎病的防效在不同土壤类型间均表现显著差异(图5)。灰漠土中,SHZ-24和BHZ-29菌株防效最好,其防效分别达到了49.17%和44.75%;棕钙土中,BHZ-29菌株防效最好,达到60.87%;棕漠土中,SHZ-24菌株的防效最好,达到45.50%。

图2 4株棉花黄萎病拮抗细菌在3种类型土壤下的活菌相对数量变化Fig.2 Variation of relative quantity of four antagonistic bacterial isolates against Verticillium dahliae in three types of soil
2.2.6土壤含水率对拮抗细菌防效的影响。4株拮抗细菌处理后20 d时,含水率15%和20%处理的棉苗长势良好,发病程度较弱;10%处理的棉苗叶片多数脱落,只剩顶端的2片真叶。此时,在不同土壤含水率下,同一拮抗细菌处理对棉花黄萎病的防效差异显著(图6)。在含水率10%和15%的条件下,拮抗细菌SHZ-24、SHT-15和BHZ-29防效较好,其中SHZ-24处理为53.74%和55.56%,SHT-15处理为52.76%和52.17%,BHZ-29处理为57.16%和58.45%。4株拮抗细菌在含水率为20%的土壤条件下相较其他2个含水率下棉花黄萎病的发病程度重。不同水分处理中,SMT-24菌株防效最差,10%、15%和20%的含水率下分别为35.04%、43.96%和37.55%。
3 讨论

图3 在不同土壤含水率下4株棉花黄萎病拮抗细菌的活菌相对数量变化Fig.3 Variation of the relative quantity of four antagonistic bacterial isolates against Verticillium dahliae in the soil with different water contents
多数植物病害的拮抗微生物是从土壤特别是植物根际土壤分离的,由于这些拮抗微生物易受土壤中各种条件的影响,在土壤中的存活能力差,导致其防病效果不稳定,无法达到持续防治的作用[21]。目前,有关拮抗微生物的防病机制研究着重在拮抗物质、营养和生态位竞争及系统诱导三个方向,这些机制并非相互排斥,通过单一或共同作用达到防病效果[22]。同时生防微生物能否成为较好防治棉花黄萎病的微生物菌剂的有效成分,除拮抗微生物具有较好的防病机制外,更重要的是要有对土壤较好的适应性[6]。还有研究指出,土壤水分的流动会影响拮抗细菌的分布,土壤水分的差异会影响拮抗细菌在土壤中的存活[23]。本研究表明土壤含水率、土壤肥力和土壤类型对供试的4株棉花黄萎病拮抗细菌在土壤中的存活能力影响显著,且显著影响其对棉花黄萎病的效果,说明拮抗细菌要充分发挥防病作用,对土壤类型、含水率、肥力具有选择性。这与前人研究结果一致,也为如何高效使用拮抗细菌提供的理论指导。本研究还发现SHZ-24和BHZ-29菌株在土壤中存活率较大且其防病效果较好,而李雪艳[14]指出SMT-24菌株抑菌效果最好,其次为BHZ-29菌株,SHT-15与SHZ-24较差。表明尽管SMT-24抑菌效果较好,但其在土壤中的存活能力较差,进而导致其防病效果并非最优。这一点正好验证了拮抗细菌在土壤中的存活能力是该菌株发挥生防效果的条件之一。与Chinawoeng等[24]的研究结果——具有良好拮抗效果的假单胞菌PCL1391在番茄根际的存活能力是该菌株发挥生防效果的条件之一——相符。有研究指出土壤酶能够反映土壤质量在时间或各种不同条件下的变化,改变土壤理化性质、肥力状况等会显著影响土壤酶的活性[25-27],进而影响拮抗细菌在土壤中的存活能力及对棉花黄萎病的防病效果。土壤环境复杂多样,土壤的活菌计数费时、费力,且准确性较低;因此,从土壤酶活性入手,明确生防菌适应土壤环境的机理,进而为改善生防细菌的防病效果提供理论基础和技术支撑,值得研究。
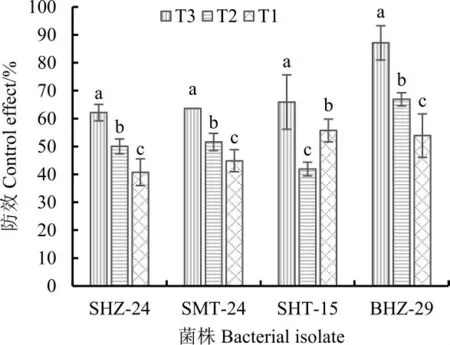
图4 不同土壤肥力下4种拮抗细菌防治棉花黄萎病的效果Fig.4 Control effects of the four antagonistic bacterial isolates to cotton Verticillium w ilt under different soil fertilities

图5 不同土壤类型对4种生防细菌防治棉花黄萎病效果的影响Fig.5 Effects of different soil types on the four biocontrol antagonistic bacterial isolates to control cotton seed ling Verticillium w ilt

图6 不同土壤含水率对4种生防细菌防治棉花黄萎病的影响Fig.6 Effects of different soil water contents on four antagonistic bacterial isolates to control cotton Verticillium w ilt
本研究探讨了土壤理化环境对拮抗细菌存活的影响,可为拮抗细菌菌株的合理使用及其制剂加工工艺研究提供支持。但拮抗细菌菌株的防效与拮抗菌株的使用方法、剂量及使用时间等密切相关,所以这些拮抗细菌的高效使用技术需要进一步研究明确。
4 结论
以4株棉花黄萎病拮抗细菌为研究对象,明确了不同理化因子、土壤含水率、土壤肥力和土壤类型对其存活及防病效果的的影响。SHZ-24和BHZ-29菌株在土壤中活菌相对数量较高,其中SHZ-24在15%的土壤含水率下达到27.74%,BHZ-29菌株在中等肥力、灰漠土中分别达到24.81%和15.24%;在高肥力、土壤含水率小于20%的土壤条件下,4株拮抗细菌对棉花黄萎病的防效较好;BHZ-29防效最高可达87.12%,SMT-24防效最低仅为35.04%。
