电针对膝骨关节炎模型兔滑膜组织信号通路的影响机制研究
2021-06-16殷岳杉阮安民刘梦玉马佳音白鹏
殷岳杉 阮安民 刘梦玉 马佳音 白鹏△
膝骨关节炎(Knee Osteoarthritis,KOA)是临床常见的以膝关节软骨破坏为主要特性的退行性骨关节疾病。其病变过程累积整个膝关节,包括软骨、软骨下骨、滑膜及周围韧带等软组织结构,表现为全方位、多层次、不同程度的慢性炎症[1]。然而目前其病因病机并不清楚,之前研究认为软骨损伤是KOA的病因也是导致KOA的病理结果,近些年来随着研究的不断深入,滑膜炎症在KOA病变过程中的作用逐渐被认识,而且滑膜炎症可能作为KOA病变的使动因素[2]。我们知道关节滑液主要由滑膜组织分泌,当滑膜发生炎症病变时关节滑液中透明质酸(HA)和润滑素等成分都会降低,这些改变会对软骨产生不利影响[3]。而在KOA进展过程中,滑膜炎症也会导致大量炎性因子及金属蛋白酶等分解酶的产生,进一步促进软骨基质的降解[4]。在疾病发展过程中许多OA患者关节滑膜表现出非感染性慢性炎症的特征,但目前关于OA滑膜炎的原因仍存在争议[5]。前期临床研究结果表明电针疗法对于KOA效果显著[6],然而其具体的作用机理有待于进一步探讨。因此本研究采用电针疗法对模型兔进行干预,并采用RT-PCR法及Western Blot法对兔滑膜样本中TLR4/NF-κB信号通路的主要成分进行检测,旨在从分子生物学层面探求电针治疗膝关节骨性关节炎的作用机制,明确电针治疗KOA的特异性作用靶点。
1 材料与方法
1.1 实验动物及分组
健康6个月龄新西兰大白兔44只,雌雄各半,体质量2.0~2.5 kg,由北京金牧阳实验动物养殖有限公司提供(许可证号为SCXK(京)2015-0005),饲养于中日友好医院临床医学研究所动物试验中心。所有家兔适应性喂养1周后随机分成6组,其中空白组4只,假手术组、模型1组、模型2组、电针1组、电针2组每组8只。其中空白组双膝取材,其余各组左侧膝关节取材。在实验过程中,对动物的处置经过北京中医药大学动物护理和使用委员会批准,并严格按照《实验动物护理和使用指南》福利伦理执行。
1.2 主要试剂及仪器
TRNzol总RNA提取试剂盒,天根生化科技有限公司提供;PrimeScriptTMRT reagent Kit with gDNA Eraser,SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus),ROX plus,DL2000 DNA Marker,由TaKaRa公司提供;TLR4、NF-κB及MyD88,美国Abcam公司提供;二抗及NC膜(0.45 μm),由美国Millipore公司提供。离心机,德国Eppendorf公司;分光光度计,美国Therno scientific公司;荧光定量PCR仪,美国Applied Biosystems公司;Fresco低温冷冻离心机,美国Thermo公司;湿转电泳槽,Cavoy公司;电泳仪,美国Bio-Rad公司。
1.3 模型制备
造模组:模型1组、模型2组、电针1组、电针2组采用改良Hulth法制备动物左膝KOA模型[7],术后不固定患肢,驱赶动物缩短造模时间。其中模型1组与电针1组造模时间为2周,模型2组与电针2组造模时间为4周。术后肌注庆大霉素注射液3 d(0.125 mL/kg),1次/d抗感染。假手术组:与造模组相同方法入路切开皮肤及关节囊进入关节腔,生理盐水冲洗后逐层缝合关节囊及皮肤,以排除手术因素的干扰。空白组:正常饲养,不作任何处理。
1.4 术后干预
1.4.1取穴 选取KOA兔膝关节周围穴位:阳陵泉、阴陵泉、内膝眼、犊鼻、梁丘、血海等穴参照《实验针灸学》[8]与《动物针灸学》[9],并结合动物比较学方法,根据比较解剖取穴法并结合模拟骨度分寸取穴法,选取兔膝关节周围上述腧穴进行治疗。
1.4.2治疗 电针组:选取“内膝眼”“犊鼻穴”“阴陵泉”“阳陵泉”“血海”及“梁丘”穴,用毫针进行针刺,直刺约5 mm。采用英迪脉冲针灸治疗仪进行电针治疗,选取两组电针,一组“正极:梁丘,负极:血海”、另一组“正极:犊鼻穴,负极:内膝眼”。疏密波,强度1~2 mA,以兔下肢微微抖动为度,每次20 min。电针1组造模2周后给予电针干预,电针2组造模4周后给予电针干预,隔日治疗1次,每周治疗3次,共治疗4周。
1.5 取材处理
各组在造模结束或治疗结束后分批取材,3%戊巴比妥钠水溶液麻醉后,局部常规消毒,以造模时原切口路入。切开皮肤、皮下组织,打开关节腔,分离剔取滑膜,迅速装入相应分组标记的EP管内,及时投入液氮冷冻,后保存于-80 ℃冰箱冻存待检,用于实时PCR和Western Blot检测。
1.6 检测方法及指标
1.6.1实时PCR检测各组滑膜中TLR4、NF-κB、MyD88的mRNA表达水平 将滑膜组织匀浆后,采用Trizol总RNA提取试剂进行样本RNA提取,采用PrimeScriptTMRT reagent Kit with gDNA Eraser进行cDNA反转录,2 μL cDNAA为模板扩增TLR4、NF-κB、MyD88及ACTIN,具体步骤按照说明书进行。所用引物序列见表1.

表1 TLR4、NF-κB 及MyD88引物序列设计
1.6.2Western Blot测定滑膜中TLR4、NF-κB、MyD88的蛋白表达 BCA蛋白定量后,每孔上样30 μg,SDS-PAGE胶电泳分离蛋白,采用湿转法转膜,5%的脱脂奶室温下封闭2 h,然后分别加入一抗在4 ℃过夜孵育,TBST洗涤5 min×4次,加入相应的二抗室温孵育1 h,再用TBST洗涤5 min×4次,ECL发光试剂盒显影,Bio-Rad荧光扫描仪扫描显像。
1.7 统计学方法
2 结果
2.1 实时PCR检测
各组TLR4、NF-κB、MyD88的mRNA表达结果见表2。模型组1、2中TLR4、NF-κB及MyD88的mRNA表达水平显著高于假手术组,差异有统计学意义(P<0.05);电针1组及电针2组中TLR4、NF-κB及MyD88的mRNA表达水平显著低于与其对应的模型1组和模型2组,差异有统计学意义(P<0.05);模型2组与模型1组比较TLR4、NF-κB及MyD88的mRNA表达水平均升高,差异有统计学意义(P<0.05)。
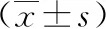
表2 各组兔关节滑膜中TLR4、NF-κB、MyD88的mRNA表达水平
2.2 Western Blot检测
各组滑膜中TLR4、NF-κB、MyD88蛋白表达见表3。模型组1、2中TLR4、NF-κB及MyD88的蛋白表达水平显著高于假手术组,差异有统计学意义(P<0.05);电针1组及电针2组中TLR4、NF-κB及MyD88的蛋白表达水平显著低于与其对应的模型1组和模型2组,差异有统计学意义(P<0.05);模型2组与模型1组比较,TLR4、NF-κB及MyD88的蛋白表达水平均升高,差异有统计学意义(P<0.05)。

表3 各组兔关节滑膜中TLR4、NF-κB、MyD88的蛋白表达水平
3 讨论
3.1 滑膜炎症在KOA病变过程中的重要作用
KOA是临床中常见的肌肉骨骼疾病,临床发病率较高,35%以上中年人受到其困扰,严重影响人们的生活质量[10]。本病的发病机制目前尚不清楚,因此还没有一种方法能够从根本上逆转KOA的病理进程,当前的治疗方式主要为对症治疗,并且存在一定的副作用。以往的研究结果认为软骨损伤是KOA发病的主要病理机制,随着研究的逐渐深入滑膜炎症在KOA病理和临床中扮演的角色逐渐被认识,现在已经知道在许多KOA患者的疾病发展过程中关节滑膜表现出非感染性慢性炎症的特征[11]。滑膜炎症与疼痛和关节功能障碍程度密切相关,炎症状态下滑膜分泌的关节液含有大量的细胞因子和趋化因子,加速软骨细胞损伤及细胞外基质的分解,从而导致关节退变发生[12]。被破坏的细胞外基质及脱落的碎片进入关节腔,刺激滑膜导致炎症进一步扩大化,促进炎性介质释放进入滑液,这些介质亦可诱发滑膜血管生成、激活细胞因子和关节软骨表面的MMPs,加重软骨的退变,进一步破坏关节内环境,从而形成恶性循环[13]。
大量研究表明无论是在OA疾病的早期或末期都伴有滑膜炎症的存在,并且通过关节镜、MRI和超声检测到的滑膜炎进展程度可以作为评价OA病变严重程度的指标[14]。这与中医的筋骨理论相一致,滑膜属于软组织,属于中医经筋的范畴。当肌肉过度收缩的时候,产生的应力沿经筋进行传导,引起膝周的软组织损伤,即“筋伤”。膝周软组织损伤导致力学失衡,进而诱发滑膜炎症。滑膜炎症与软骨损伤之间形成恶性循环,这是一个由筋及骨的传变过程,筋伤而骨损,骨损进一步加重筋伤。因此在临床治疗上抑制滑膜炎症反应对于治疗KOA具有重要意义。
3.2 TLRs/NF-κB信号通路介导的滑膜炎症反应是促进KOA滑膜炎的关键环节
TLRs是固有免疫系统中一类重要的模式识别受体(PRRs),广泛参与病原相关分子模式(PAMPs)或内源性危险信号相关分子模式(DAMPs)的感知,诱导多种促炎性因子合成和释放,引发或加重炎症[15]。DAMPs包括分布于KOA滑液中的小分子量透明质酸、纤维连接蛋白、细胞粘合素C、高迁移率族蛋白B1(S100 proteins,HMGB-1)等内源性物质,这些内源性物质来源于无菌性组织损伤或细胞应激导致降解的细胞外基质[16-18]。激活的TLRs/NF-κB信号通路最终通过活化转录因子AP-1,进而启动IL-1β等一系列促炎性因子基因转录和表达[19]。释放至胞外的IL-lβ通过与IL-1受体结合激活IL-1信号通路和TLRs /NF-κB信号通路,募集炎性细胞、刺激滑膜细胞增殖、促进滑膜血管生成,释放更多的炎性因子及蛋白酶进入关节,发生炎症级联放大效应[20],使KOA炎症反应持续,进一步加重KOA病变进程。因此,KOA滑膜固有免疫应答通过DAMPs/TLRs/NF-κB信号通路激活KOA滑膜炎症反应,是KOA可能的发病机制。
3.3 电针治疗KOA的作用机制
临床研究证实电针能够通过缓解疼痛、改善关节功能、增强肌力从而达到治疗KOA的目的[6]。然而电针治疗KOA的具体作用机制有待研究,刘苗苗等[21]发现电针能够通过降低KOA大鼠滑膜组织中基质金属蛋白酶-3(MMP-3)和基质金属蛋白酶抑制剂-1(TIMP-1)的高表达,达到缓解疼痛、消肿的目的。王道海等[22]发现电针能够通过上调碱性成纤维细胞生长因子(bFGF)的表达促使KOA大鼠关节损伤软骨的修复。本研究从滑膜炎症角度出发,探讨电针对于TLRs/NF-κB信号通路介导的滑膜炎症的干预作用。研究结果发现,TLR4、NF-κB及MyD88三种指标在实验过程中变化趋势基本一致,在两模型组中mRNA及蛋白表达水平显著高于假手术组,说明TLR4、NF-κB及MyD88的mRNA及蛋白的表达在滑膜炎症中呈现特异性增加的趋势;在电针1组与电针2组中mRNA及蛋白表达水平显著高于模型1组和模型2组,说明电针治疗可以抑制TLR4、NF-κB及MyD88的mRNA及蛋白的表达;模型2组与模型1组比较TLR4、NF-κB及MyD88的mRNA及蛋白表达水平升高,说明随着造模时间的延长,TLR4、NF-κB及MyD88的mRNA及蛋白表达水平呈上调的趋势;而电针1组与电针2组的表达趋势未出现明显差异,说明电针对KOA不同时期模型的TLR4、NF-κB及MyD88的mRNA及蛋白表达均具有调控作用。
综上所述,电针可以通过调控TLRs /NF-κB信号通路介导的滑膜炎症反应达到治疗KOA的目的。
