稳定过表达XAF1基因对A2780卵巢癌细胞生物学功能的影响
2021-06-16刘星辰魏宝宝王悦华
刘 娟 ,刘星辰 ,魏宝宝 ,刘 洁 ,王悦华 ,刘 辉
四川大学1华西第二医院妇产科,2出生缺陷与相关妇儿疾病教育部重点实验室,四川 成都 610041;3成都市第六人民医院妇科,四川 成都 610051;4成都中医药大学附属医院妇科,四川 成都610075
卵巢癌具有早期诊断率低,复发率高,致死率高的特点,因其发病隐匿,约70%的卵巢癌患者诊断时已属晚期(FIGOⅢ~Ⅳ期),目前卵巢癌的治疗方案是手术辅以铂类联合紫杉烷类药物化疗[1-3]。通常初期行化疗的患者均有较好的疗效,但在后期仍有大量患者病情会发展到终末期,耐药随之出现[4]。癌细胞对凋亡的抵抗是导致多种化疗药产生耐药的重要因素,诱导肿瘤细胞凋亡有助于增加化疗药的效果,而XAF1在这个过程中起着重要作用[5-7]。
X-连锁凋亡抑制蛋白相关因子(XAF1)是XIAP的内源性抑制因子,XIAP是一种强烈的凋亡抑制蛋白,通过与Caspase3、7、9结合,阻止终末凋亡反应[8]。XAF1在正常细胞中广泛表达,然而在恶性肿瘤中包括卵巢癌[9-10]呈低表达或者缺失表达[11-13],主要原因是启动子的高甲基化[14-16]。XAF1低表达与恶性肿瘤细胞的过度增殖、Caspase活性增加以及多种凋亡诱导因子,恢复XAF1的表达可抑制肿瘤生长,促进凋亡发生并增加肿瘤对凋亡诱导因子的敏感性[17-18]。此外,XAF1可抑制肿瘤细胞的周期进展,包括诱导G0~G1期[9]、G1期[13]、G2-M期阻滞[19-21],促进有丝分裂灾难的发生[19-20]。在临床组织样本中,XAF1的表达量及甲基化状态与肿瘤分化程度[10,22-24]、分期[21,23]、耐药[10,25]、生存期[21,25-26]等相关,XAF1表达越低肿瘤预后越差[14,21]。因此,XAF1在肿瘤的发生发展中发挥着重要作用,有望成为肿瘤治疗的新靶点。
卵巢癌易复发并伴随化疗耐药同时出现,寻找其治疗靶点已成为新的研究热点。曾有学者检测了上皮性卵巢癌中XAF1的表达发现XAF1呈低表达,并与卵巢癌的分化程度及预后相关,稳定过表达XAF1后抑制卵巢癌细胞SKOV3增殖,通过诱导XIAP失活、caspase-3及细胞色素c激活促进凋亡发生发生进而增加SKOV3细胞对顺铂的敏感性[10]。进一步,ZHAO等通过质粒转染技术增加了卵巢癌细胞SKOV3 及其顺铂耐药株SKOV3/DDP中XAF1的表达,发现XAF1有较强的抗侵袭作用,通过抑制XIAP表达、激活caspase3、9促进SKOV3和SKOV3/DDP凋亡,增加了对顺铂的敏感性,此外XAF1诱导SKOV3和SKOV3/DDP细胞G0/G1阻滞[9]。综合以上研究说明XAF1可能是抑制卵巢癌生长的重要基因,并且增加了卵巢癌对顺铂的敏感性。因研究数目少,且均只用了一种卵巢癌细胞株即SKOV3进行实验,故进一步采用不同的卵巢癌细胞株对XAF1在卵巢癌中的作用进行验证是极其必要的。除此之外,紫杉醇作为卵巢癌化疗的重要组成部分,其耐药已成为影响卵巢癌预后的主要因素之一,寻找紫杉醇增敏剂对于提高卵巢癌疗效尤其重要。与顺铂诱导细胞DNA损伤不同,紫杉醇通过抑制细胞有丝分裂,诱导细胞G2-M期阻滞进而杀死肿瘤细胞,而目前XAF1与卵巢癌紫杉醇增敏的相关研究仍未见报道。
本研究采用卵巢癌细胞A2780构建XAF1稳定过表达模型,研究XAF1基因对卵巢癌细胞的增殖、凋亡、细胞周期及紫杉醇敏感性的影响,旨在探究XAF1在卵巢癌发生发展中的作用提供新的更稳定的实验模型,并为卵巢癌患者靶向治疗提供新的靶点思路。
1 材料和方法
1.1 细胞及主要试剂仪器
人卵巢癌细胞株A2780(ECACC catalogue no.93112519)来源于本实验室;pcDNA3.1(+)-XAF1重组载体及阴性对照pcDNA3.1(+)载体构建于天津赛尔技术有限公司;转染试剂LipofectamineTM2000(invitrogen);RP1640培养基(Gibco);胎牛血清(杭州四季青生物工程材料有限公司);TRIzol、逆转录试剂盒、2×PCR master mix(南京诺唯赞生物科技股份有限公司),主要PCR仪(Bio-Rad)型号为CFX96;CCK8试剂盒(Biosharp);流式细胞仪型号为Millipore Guava;酶标仪型号为CMax plus。
1.2 细胞培养
人卵巢癌细胞株A2780 被培养于含10%的胎牛血清、青霉素和链霉素(1∶100)的RPMI 1640 培养基中,置于37 ℃,5%CO2及90%相对湿度的细胞培养孵箱中。细胞单层贴壁生长,呈上皮细胞形态,扁平椭圆,每2~3 d传代1次。
1.3 A2780细胞的G418筛选最佳浓度确定
pcDNA3.1(+)载体在真核细胞中表达neo基因,即带有遗传霉素(G418)抗性,首先确定A2780细胞本身对G418的耐受程度,即确定最佳筛选浓度。取对数生长期A2780细胞接种于24孔板,细胞密度1.0×105/mL,每孔G418 浓度分别为50、100、200、400、600、800、1000、1100 μg/mL,培养至第6天1100 μg/mL筛选的卵巢癌A2780细胞全部死亡,因此选择1100 μg/mL作为最佳筛选浓度。
1.4 细胞转染和稳定转染细胞的筛选
取对数生长期A2780细胞接种于6孔板,设置空白对照孔,细胞密度1.5×105/mL,当细胞融合度至70%时,换为无血清培养基,3 h后,用LipofectamineTM2000转染试剂将,pcDNA3.1(+)-XAF1 重组载体及阴性对照pcDNA3.1(+)分别转染进A2780细胞中,6~8 h后换为含血清培养基,转染后72 h 传代至6 孔板,在含有G4181100 μg/mL培养基中连续筛选18 d,细胞克隆集落形成,生长状态良好,验证XAF1的表达并保种,分别命名为A2780/XAF1和A2780/NC。
1.5 RNA提取及实时荧光定量PCR验证XAF1的表达
复苏保种的A2780/XAF1 和A2780/NC,在含有G418(550 μg/mL)的培养基中维持培养,传代2次后,收集对数生长期的细胞,采用TRIzol法提取总RNA,按试剂盒说明书进行逆转录合成cDNA。在NCBI人类基因组数据库设计引物,人XAF1基因上下游引物序列分别为5'-GATGTCTGTCGCAGTGAA-3'和5'-TCTTGGT GCTTTCTTTGA-3',人β-Actin内参基因上下游引物序列为5'-GCACCACACCTTCTACAATGAG-3' 和5'-ACAGCCTGGATGGCTACGT-3',将引物、cDNA 及PCR master mix分别加入PCR反应管,加入ddH2O至20 μL,反应条件:95.0 ℃,30 s 预变性,热循环参数:95.0 ℃,10 s,60.0 ℃,30 s,40个循环,绘制融解曲线,每组重复3次,实验结果以2-ΔCt表示,以对照组值为1,计算A2780/XAF1的mRNA相对表达量[27]。
1.6 克隆形成实验检测细胞增殖及群体依赖性
取对数生长期的A2780/XAF1(实验组)和A2780/NC(对照组)进行计数,每组细胞分别以每皿50、100、200细胞的梯度密度分别均匀接种于含培养基的6 cm培养皿中,置于37 ℃,5%CO2及饱和湿度的细胞培养箱中培养1周。待培养皿中出现肉眼可见的克隆时,弃去上清,PBS浸洗2次,各加入500 μL,0.1%结晶紫染液,染色3 h后撤除染液,用PBS洗3遍,晾干后拍照,计数肉眼可见的克隆。
1.7 CCK8实验检测A2780/XAF1和A2780/NC的增殖活性及对紫杉醇的敏感性
取对数生长期A2780/XAF1 和A2780/NC,按照2×104/mL的密度接种于96孔板,每孔200 μL,每组复5孔,分别于细胞贴壁后1、3 d 加入CCK8,每孔10 μL,37 ℃孵育2 h后,用酶标仪测量450 nm处吸光值(A450nm),细胞增殖活性用吸光值表示。
取对数生长期的A2780/XAF1和A2780/NC,按照5×104/mL的密度接种于96孔板中,100 μL/孔。过夜贴壁后,取出孔板内培养液,按0,40,80,160,320 ng/mL的紫杉醇浓度梯度配置培养液,加入96孔板,每组复5孔。继续培养48 h后,加入CCK8,10 μL/孔,37 ℃孵育2 h。用酶标仪测吸光值A450nm,存活率(%)=A实验组/A对照组×100%,半数抑制浓度即IC50用GraphPad Prism8.3.0计算。
1.8 流式细胞技术检测细胞凋亡
取对数生长期的A2780/XAF1和A2780/NC,按照1.5×105/mL的密度接种于6孔板中。过夜贴壁后,给予不同处理作用24 h后,用不含EDTA的胰酶消化收集各组细胞(包括漂浮细胞),PBS冲洗2遍,按照AnnexinVFITC/PI双染凋亡检测试剂盒(Cat NO:KGA108)说明书进行染色15 min后,于流式细胞仪(型号:Millipore Guava)检测细胞凋亡率。
1.9 流式细胞仪检测细胞周期
取对数生长期A2780/XAF1 和A2780/NC,1.5×105/mL的密度接种于六孔板中,过夜贴壁后,消化细胞,PBS冲洗2遍,用75%乙醇固定,冻于-20 ℃过夜。离心后弃乙醇,PBS洗涤后,按照凋亡周期检测试剂盒说明书测量细胞周期。
1.10 统计学分析
采用SPSS 19.0及GraphPad8.0软件进行统计分析及作图。计量资料以均数±标准差表示,采用非配对t检验,计数资料以率表示,无序多分类行列表采用χ2检验,行Bonferroni校正卡方检验进行两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 成功构建稳定表达XAF1 的卵巢癌细胞A2780/XAF1
未转染A2780 空白对照组与转染质粒的细胞同步进行G418筛选,第8天,空白对照组细胞全部死亡(图1A),第18天,A2780/NC和A2780/XAF1克隆集落形成(图1B、C),细胞形态无明显改变。qPCR实验显示,结果以2-ΔCt表示,以对照组值为1,A2780/XAF1细胞的XAF1mRNA表达量是A2780/NC的658倍(0.075±0.04951vs0.0001±0.00009,P<0.05)。A2780/NC 和A2780/XAF1均能在500 μg/mL G418中维持生长,且A2780/XAF1 的XAF1mRNA 表达量增高,稳定表达XAF1的卵巢癌细胞A2780构建成功。
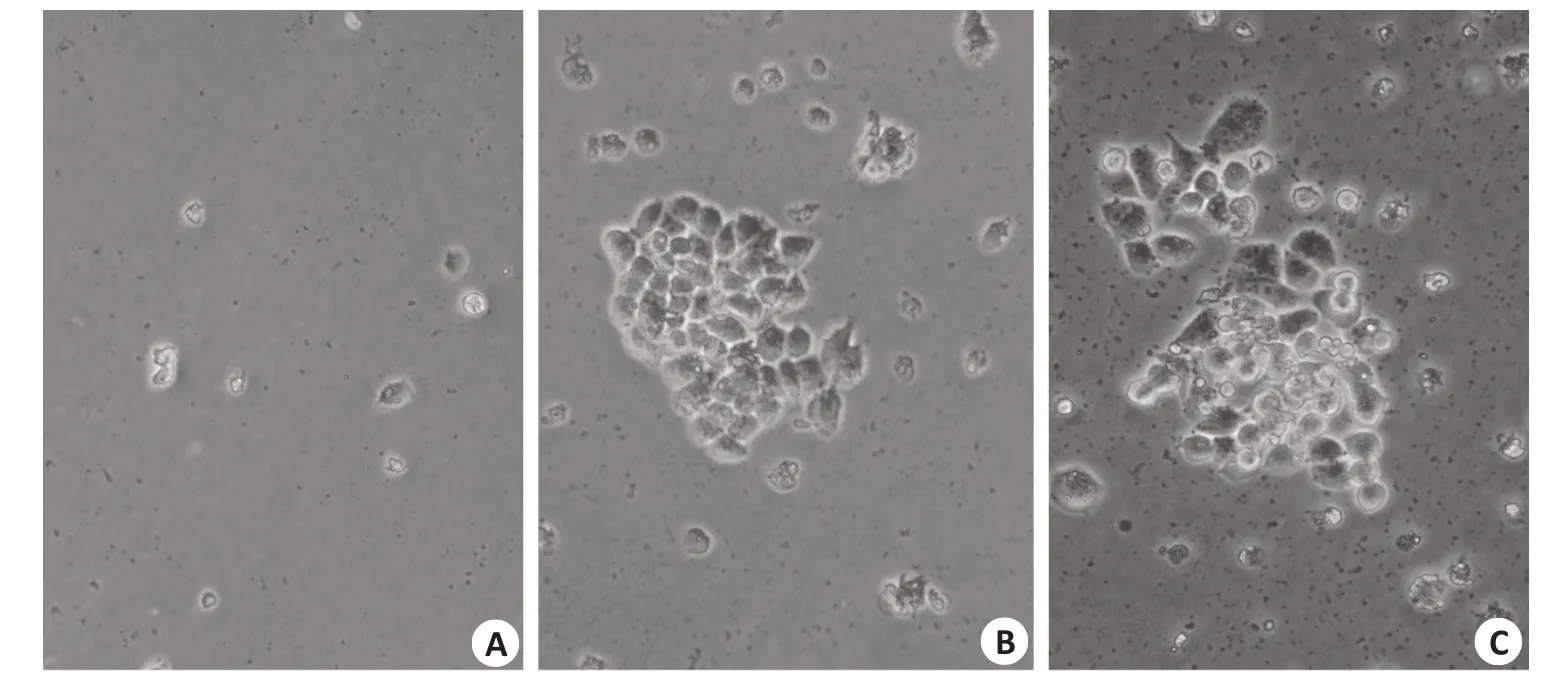
图1 A2780/NC和A2780/XAF1克隆集落形成Fig.1 Clonal colony formation of A2780/NC and A2780/XAF1 cells(Original magnification:×100).A:A2780 blank control cells.B:A2780/NC cells.C:A2780/XAF1 cells.
2.2 XAF1抑制卵巢癌细胞A2780的增殖
经肉眼计数,A2780/NC 的克隆形成率分别64%(32/50)、52%(52/100)及56%(112/200),A2780/XAF1的克隆形成率分别为16%(8/50)、20%(40/100)及20.5%(41/200)。计算两种细胞的平均克隆形成率,进行差异性检验,发现A2780/NC与A2780/XAF1的克隆形成能力差异有统计学意义(图2A,P=0.0016)。
在细胞接种贴壁后第1、3天,A2780/XAF1的增殖活性均比A2780/NC低,差异有统计学意义(图2B),进一步分别计算两种细胞的增殖速度,发现A2780/XAF1的增殖速度比A2780/NC低。
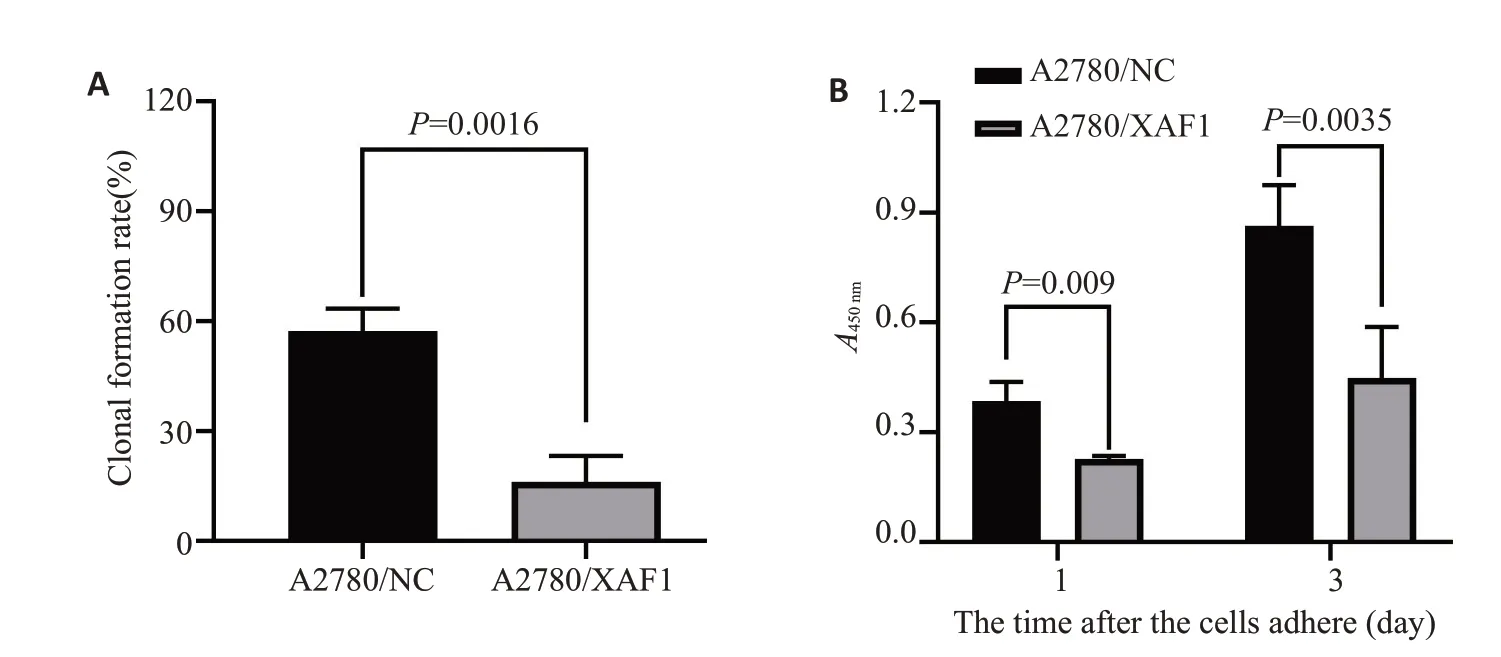
图2 A2780/NC和A2780/XAF1的增殖活性比较Fig.2 Comparison of proliferative activity between A2780/NC and A2780/XAF1 cells.A:Clonal formation rate.B:CCK8 proliferative activity(Optical density at 450 nm).
2.3 XAF1诱导卵巢癌细胞A2780的G2-M期阻滞
我们采用流式细胞仪检测了A2780/NC和A2780/XAF1处于不同细胞周期的比例。统计学分析发现,A2780/NC和A2780/XAF1的细胞周期分布差异存在统计学意义(χ2=150.386,P<0.001),两两比较结果显示,A2780/NC和A2780/XAF1处于G0~G1期、S期的细胞比例差异无统计学意义(χ2=3.888,P>0.05);两组细胞在G0~G1 期、G2-M 期的分布差异有统计学意义(χ2=135.775,P<0.001),A2780/XAF1 组G2-M 期细胞百分比更高;两组细胞在S 期、G2-M期的分布差异有统计学意义(χ2=66.41,P<0.001),A2780/XAF1组G2-M期细胞百分比更高(图3)。
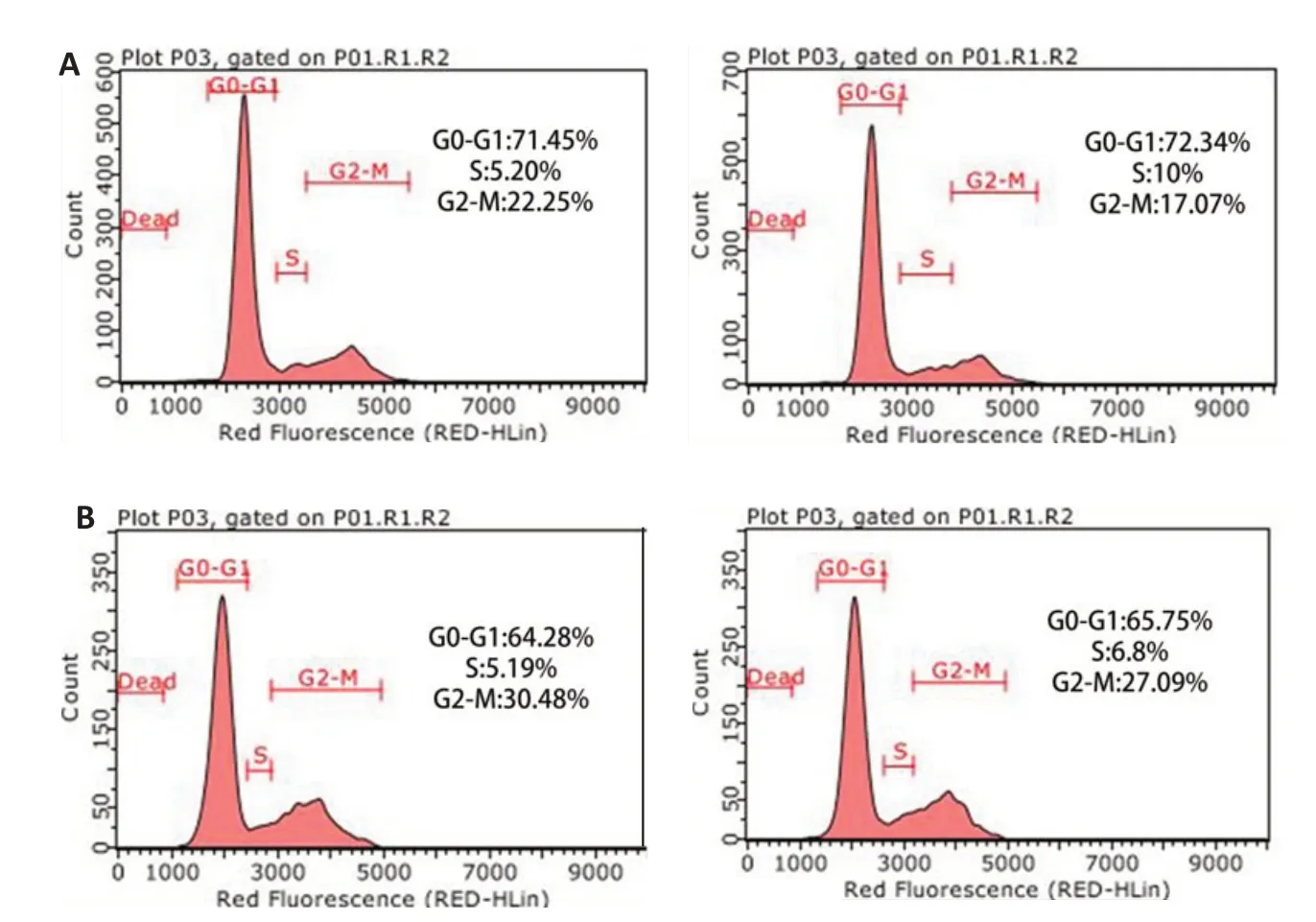
图3 A2780/NC和A2780/XAF1的细胞周期分布Fig.3 Cell cycle distribution ofA2780/NC(A)andA2780/XAF1(B)cells.
2.4 XAF1不仅单独诱发凋亡发生,且促进无血清及紫杉醇诱导的凋亡反应
在缺乏凋亡诱导因子的作用下,A2780/NC 和A2780/XAF1的总凋亡率分别为3.83%、5.39%,早期凋亡率分别为1.64%、2.97%,差异均有统计学意义(P<0.001);在无血清刺激作用后,总凋亡率分别为6.36%、8.13%(P<0.001),早期凋亡率分别为3.14%、4.82%(P<0.001);在紫杉醇80 ng/mL 作用下,总凋亡率分别为6.91%、12.67%(P<0.001),早期凋亡率分别为3.75%、5.95%(P<0.001、图4)。
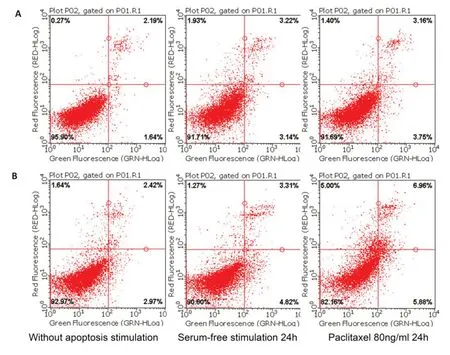
图4 A2780/NC和A2780/XAF1在无凋亡刺激、无血清刺激、紫杉醇作用下的凋亡情况Fig.4 Apoptosis of A2780/NC and A2780/XAF1 cells in the absence of apoptosis stimulation,in serum-free culture and following paclitaxel treatment.A:Dual-channel staining of apoptotic A2780/NC cells.B:Dual-channel staining of apoptoticA2780/XAF1 cells.
2.5 XAF1增加了卵巢癌细胞对紫杉醇的敏感性。
不同紫杉醇浓度下相对于无紫杉醇作用下的卵巢癌细胞A2780相对存活率被计算,结果显示,相对于A2780/NC组,A2780/XAF1细胞存活率更低,差异有统计学意义(P<0.001,图5)。A2780/NC及A2780/XAF1在紫杉醇作用下的半数抑制浓度即IC50分别为896.1 ng/mL(95%CI:530.1~2425 ng/mL)和11.66 ng/mL(95%CI:2.54~22.95 ng/mL)。两因素方差分析结果显示,XAF1与紫杉醇联合对于抑制卵巢癌生长存在协同作用(P<0.001)。
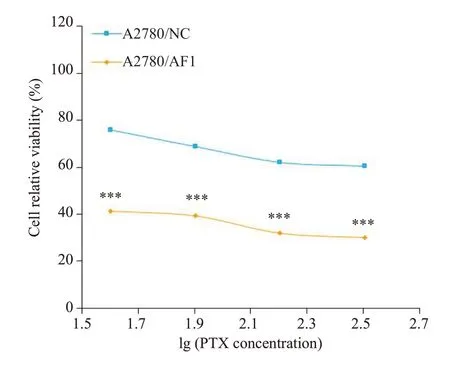
图5 XAF1增加卵巢癌对紫杉醇的敏感性Fig.5 XAF1 increases the sensitivity of ovarian cancer cells to paclitaxel.***P<0.001 vsA2780/NC.
3 讨论
本研究采用脂质体转染法将真核表达载体pcDNA3.1(+)及其XAF1重组载体分别转染至A2780,通过抗性标记筛选使得A2780/NC与A2780/XAF1均能在G418中维持生长,经qPCR鉴定A2780/XAF1 的XAF1mRNA显著增高,说明模型构建成功。该细胞模型易培养,基因表达稳定,实验重复性好,不仅为进一步体外研究卵巢癌中XAF1的相关信号通路提供了便利,还为研究XAF1在复杂多变的在体环境中的作用机制提供了实验工具。同时,我们进一步检测了XAF1基因对卵巢癌细胞增殖、凋亡、细胞周期的影响,结果显示XAF1明显抑制了卵巢癌细胞的生长,促进其凋亡。这一结果从功能层次上说明XAF1基因在卵巢癌的发生发展中起到了抑癌基因的作用,与其他研究结果一致[15]。此外,在细胞周期方面,本研究结果显示XAF1诱导了卵巢癌细胞G2-M期阻滞。这与部分为胃腺癌细胞中的研究结果一致[17,19]。但是,另一项关于人胚肺成纤维细胞研究则发现XAF1稳定过表达则产生与p53一样的G1 期阻滞效应,采用同样的研究方法表明XAF1并不影响宫颈癌细胞的周期分布,有研究分析这一差异是由两种细胞的转化程度不同所致,恶性程度更高、生存能力更强的Hela细胞基因组阻止了XAF1对细胞周期分布的影响[13]。在卵巢癌细胞中,有研究采用重组载体瞬时转染的方式提高SKOV3细胞株中XAF1的表达,发现XAF1诱导了SKOV3卵巢癌细胞G0~G1期细胞阻滞[9]。不同类型细胞基因组不同,故XAF1对其细胞周期的影响有所差异。A2780卵巢癌细胞来源于子宫内膜样卵巢腺癌患者,而SKOV3卵巢癌细胞来源于浆液性卵巢腺癌,COSMIC数据库显示两种组织型别p53突变频率分别为73%、51%[28],p53的突变状态可能是XAF1对细胞周期分布影响结果不一致的原因。最后,我们用CCK8实验探究了XAF1联合紫杉醇对卵巢癌细胞生长的影响,结果显示XAF1提升了卵巢癌对紫杉醇的敏感性,两者之间存在协同作用,是卵巢癌化疗和靶向治疗的潜在增敏靶点。我们前期研究发现下调XIAP 可诱导耐紫杉醇卵巢癌细胞凋亡,逆转紫杉醇耐药[29-30],而XAF1是XIAP的内源性抑制因子,故本次研究再次证实了前期研究结果。
近年来,因卵巢癌化疗耐药及复发的频繁出现,其靶向治疗已经成为众多学者的研究的热点。卵巢癌凋亡调节相关靶向治疗研究包括bcl2家族蛋白和酪氨酸蛋白激酶及凋亡抑制蛋白(IAPs),其中IAPs家族蛋白在抑制内源性和外源性凋亡通路均具有重要作用[31],一项有关多种恶性肿瘤细胞(包括卵巢癌细胞)的研究发现XAF1蛋白一方面可与除Survivin以外的所有IAPs家族蛋白直接相互作用促进凋亡,另一方面通过激活XIAP-RING结构域的E3泛素连接酶促进Survivin的降解,表现为促进凋亡和有丝分裂灾难的双重作用[32]。本研究也存在一定局限性,如未探讨XAF1基因的上下游分子变化,未明确其抑癌作用具体机制,这也将是我们下一阶段研究工作的重点。
综上所述,XAF1基因是卵巢癌发生发展过程中的关键基因,其功能缺失影响相关上下游基因的表达,进而影响卵巢癌细胞的生物学功能。XAF1基因过表达稳定转染细胞株的建立将有利于研究XAF1基因对卵巢癌的作用机制,发现其上下游基因的一系列变化,对卵巢癌发生发展的具体分子生物学机制进行更深入的探讨,并可能为卵巢癌的分子靶向治疗提供新的作用靶点。
