沉默ATG5 及ATG7 可抑制顺铂介导的耐顺铂睾丸癌细胞的自噬和增殖
2021-06-16朱晨露杜家如姚言雪武丹丹童旭辉
朱晨露,杜家如,姚言雪,武丹丹,苑 敏,干 露,童旭辉
蚌埠医学院药学院,安徽 蚌埠233030
睾丸癌是一种发病机制复杂的恶性肿瘤,好发于生育高峰期的年轻男性[1]。顺铂是抗癌疗效强且抗癌谱广的化疗药物[2],且基于顺铂的化学疗法(CBCT)已被纳入睾丸癌,肺癌,膀胱癌等多种癌症的标准治疗中[3]。化疗中的耐药性复发是睾丸癌治疗的一大挑战,因此,探究睾丸癌耐铂类药物的发生机制对于提高睾丸癌的治疗效果具有重要意义。
近年来,化疗中自噬的增强被认为是肿瘤耐药的主要机制[4]。自噬是一个复杂的生理过程,包括吞噬泡的形成,自噬体的形成,自噬溶酶体的形成及自噬溶酶体的降解,可消除错误折叠的蛋白及受损的细胞器以维持细胞内稳态[4]。哺乳动物细胞中自噬体由两个类泛素化的修饰过程组成,涉及自噬相关蛋白ATG5、ATG7和微管相关蛋白LC3[5]。饥饿、疾病、放射、化疗等应激条件会诱导细胞发生自噬[6-9]。化疗过程中触发自噬后,能够为逆境中的肿瘤细胞提供能量和原料,促进肿瘤生存,从而导致耐药性[10]。自噬已被证实在实体瘤,神经胶质瘤,骨肉瘤等多种细胞的耐药过程扮演着着重要的角色[11-13]。然而,自噬是否参与睾丸癌细胞对顺铂的耐药目前尚未明确。课题组前期已经成功建立了耐顺铂睾丸癌细胞I-10/DDP[14],为了探究顺铂是否诱导睾丸癌细胞自噬以及调控自噬对睾丸癌细胞的影响,本研究将观察顺铂处理后,耐药株I-10/DDP中自噬水平的变化及通过分子生物学方法沉默ATG基因后,观察对顺铂作用后的自噬水平及细胞增殖的影响。该研究将为解决睾丸癌耐药问题提供重要的理论依据。
1 材料和方法
1.1 细胞株与细胞培养
小鼠睾丸癌细胞株I-10购于美国ATCC细胞库。课题组前期采用浓度递增法成功构建了耐顺铂睾丸癌细胞株I-10/DDP[14]。细胞培养于加入2.5%(V/V)胎牛血清,15%(V/V)马血清,100 U/mL青霉素,100 U/mL链霉素的F12高糖培养基中。细胞贴壁生长在25 cm2的透气培养瓶中,并培养于37 ℃、含体积分数5%CO2以及饱和湿度的培养箱中。0.25%胰酶细胞消化液(含0.02%EDTA)消化传代,每周传代2~3次。
1.2 主要试剂
F12 高糖培养基、胎牛血清、马血清、opti-MEM(Gibco);ATG5、ATG7 干扰质粒(吉玛基因)、lipfectaminTM2000、预染蛋白(Marker);胰酶消化液、细胞裂解液、苯甲基磺酰氟、BCA蛋白浓度测定盒、结晶紫染色液、SDS-PAGE 蛋白上样缓冲液(×5)、顺铂(DDP)、二甲基亚砜(DMSO)、四甲基偶氮唑蓝(MTT);p62、LC3B、ATG5、ATG7 一抗(CST);羊抗兔二抗、GAPDH、羊抗小鼠二抗。
1.3 shRNA转染—干扰ATG5和ATG7基因
需要干扰的自噬相关基因为ATG5和ATG7,并由上海吉玛制药技术有限公司设计合成。
干扰ATG5 基因的序列为:5'-GCTTCGAGATG TGTGGTTTGG-3'
干扰ATG7 基因的序列为:5'-GAGGCTGGTAA GAACAGTAGC-3'
取对数生长期的I-10/DDP细胞,以1×105cells/mL的密度接种于6孔板中,密度达到60%左右,避光条件下,将5 μL lipfectaminTM2000和5 μL shRNA片段溶液分别与250 μL opti-MEM混合,室温放置5 min后,将两种溶液充分混合并室温放置20 min。用opti-MEM补足至每孔溶液2 mL。8 h后更换为新鲜的含血清培养基,48 h 后将细胞转移至一次性细胞培养瓶中,细胞贴壁后更换含有G418的选择培养基(G418的浓度为0.1 mg/mL)筛选细胞。干扰试验分为以下4组:mock组:只加入lipfectaminTM2000转染组;NC组:未转染质粒对照组;shRNA-ATG5 组:转染了shRNA-ATG5 质粒;shRNA-ATG7组:转染了shRNA-ATG7质粒。
1.4 MTT法检测细胞存活率
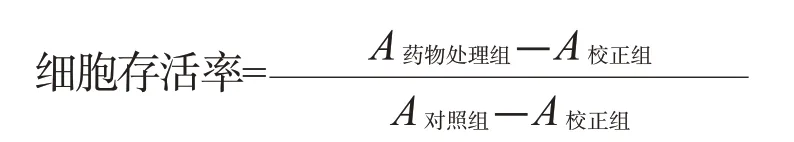
取对数生长期细胞株(或稳转株)以5×104/mL的密度接种于96孔板中,每组5个复孔,待细胞生长至60%左右用含15 μmol/L DDP新鲜培养基处理24 h后,加入15 μL MTT(5 mg/mL)孵育4 h,弃去培养基,每孔加入150 μL DMSO,37 ℃孵育30 min 后,酶标仪检测吸光度值(A490nm),重复3次。
1.5 透射电子显微镜观察细胞内自噬体的形成情况
取对数生长期细胞株(或稳转株)以1×105/mL的密度接种于6孔板中,15 μmol/L DDP处理12 h后收集细胞,4 ℃,12 000 r/min离心5 min,PBS重悬后再离心,最后收集细胞至1.5 mL的离心管中。加入1 mL的固定液(2.5%戊二醛),4 ℃冰箱保存,将样品送至中国科学技术大学附属第一医院临床病理科处理。
1.6 mCherry-GFP-LC3B 转染检测自噬体和自噬溶酶体
mCherry-GFP-LC3B质粒转染可在靶细胞中有效表达红色荧光蛋白mCherry,绿色荧光蛋白GFP和LC3的融合蛋白,通常用于检测自噬流量的变化[15]。红色荧光可指示自噬溶酶体形成的顺利程度,红色荧光越多,绿色荧光越少,从自噬体到自噬溶酶体阶段流通的越顺畅。将细胞(5×104cells/mL)接种到6孔板中,当细胞生长至50%左右,根据mCherry-GFP-LC3B质粒(上海吉玛制药技术有限公司)转染。8 h后更换新鲜培养基,48 h后,加入15 μmol/L DDP(Sigma-Aldrich)处理12 h,在共聚焦显微镜下观察到GFP-LC3荧光。
1.8 集落克隆实验
将细胞株(或稳转株)以5×104cells/mL的密度分别接种3 mL于直径为35 mm的一次性细胞培养皿中,细胞贴壁后,用15 μmol/L DDP处理,观察形成集落后(集落为显微镜下技术大于50个细胞克隆数),弃培养液,用PBS清洗2遍,多聚甲醛固定后,结晶紫染色,实验重复3次,并拍照。
1.9 Western blot
分别收集给药组及转染组细胞,加入适量细胞裂解液裂解细胞后,收集蛋白并定量。制备12%SDS-PAGE凝胶;将蛋白样品上样,电泳,转膜,封闭,孵抗体,一抗(LC3B、p62、ATG5、ATG7)4 ℃孵育过夜,二抗于室温孵育2 h,TPBS 洗膜;ECT 发光试剂盒暗室发光,显影;Bio-Rad 凝胶成像系统采集图像,Bio Imaging system(Gene Genius)扫描灰度值定量分析。
1.10 统计学分析
使用SPSS 20.0进行统计分析,数据表示为均数±标准差,两组之间均数比较采用两样本t检验,两组以上均数比较采用单因素方差分析和SNK-q检验。统计图表采用Graphpad Prism 5.0 绘制,P<0.05为差异具有统计学意义。
2 结果
2.1 顺铂处理后I-10/DDP细胞内自噬水平升高
Western blotting法检测出I-10/DDP细胞在使用顺铂(15 μmol/L)处理后,LC3-Ⅱ的表达水平明显增加(P=0.001),p62的表达水平降低(P=0.01,图1A)。使用透射电子显微镜观察顺铂处理后,I-10/DDP细胞中自噬体数量明显增加(图1B)。使用激光共聚焦显微镜观察到顺铂处理后I-10/DDP内红色和绿色荧光亮点增加,合成的图像中红色荧光亮点(自噬溶酶体)和黄色荧光亮点(自噬体)均增加(图1C)。
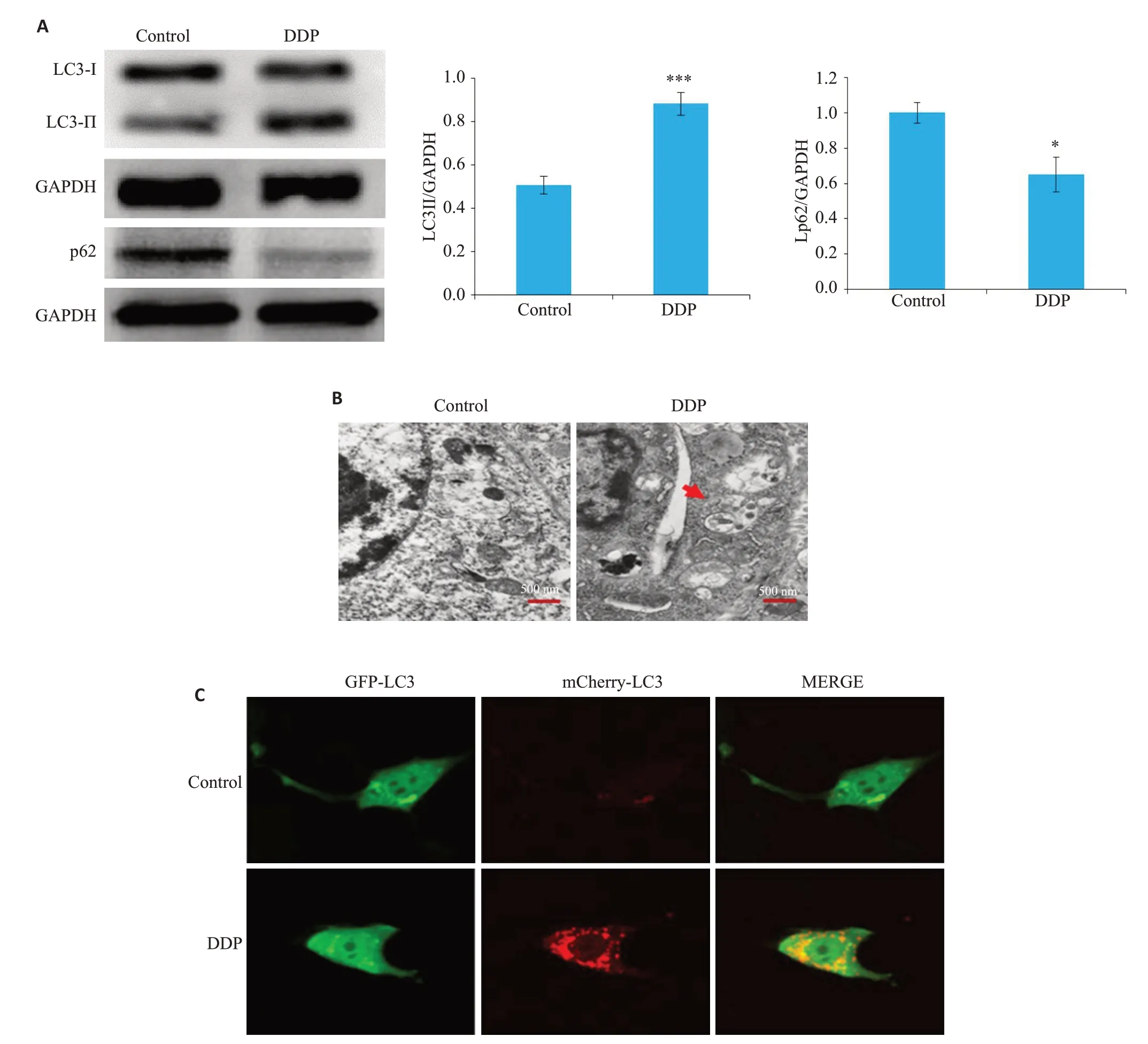
图1 顺铂对I-10/DDP细胞中自噬水平的影响Fig.1 Effect of cisplatin on autophagy in I-10/DDP cells(n=3).A:Expressions of LC3 and p62 in I-10/DDP cells treated with cisplatin.B:Autophagosomes analyzed by transmission electron microscopy(Original magnification:×15 000).C:Autophagosomes and autolysosomes observed with confocal fluorescent microscopy(×400).*P=0.01,***P=0.001 vs control.
2.2 shRNA-ATG5和shRNA-ATG7抑制I-10/DDP细胞中ATG5和ATG7的表达
将shRNA-ATG5 和shRNA-ATG7 干扰质粒转入I-10/DDP 细胞后,Western blotting 法检测出ATG5 和ATG7的表达量明显降低(P=0.005,P<0.001,图2)。
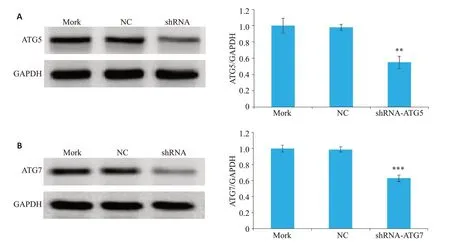
图2 shRNA-ATG5和shRNA-ATG7对I-10/DDP细胞中ATG5和ATG7表达的影响Fig.2 Effect of shRNA-ATG5 and shRNA-ATG7 on expressions of ATG5 and ATG7 in I-10/DDP cells(n=3).A:ATG5.B:ATG7.Mock:Lipofectamine 2000.NC:Nonspecific control.**P<0.01,***P<0.001 vs NC group.
2.3 沉默ATG5、ATG7后抑制顺铂介导的自噬
顺铂(15 μmo/L)处理转染组细胞后,Western blotting 法检测出shRNA-ATG5+DDP 组和shRNAATG7+DDP组细胞中LC3Ⅱ的表达水平与NC+DDP组相比明显降低,p62的表达水平明显增加(图3A)。透射电子显微镜观察到shRNA-ATG5+DDP组和shRNAATG7+DDP组细胞中自噬体的数量明显少于NC+DDP组(图3B),激光共聚焦显微镜观察到shRNA-ATG5+DDP组和shRNA-ATG7+DDP组细胞内红色和绿色荧光亮点与NC+DDP组相比减少,在合成的图像中红色荧光亮点(自噬溶酶体)和黄色荧光亮点(自噬体)数量均减少(图3C)。
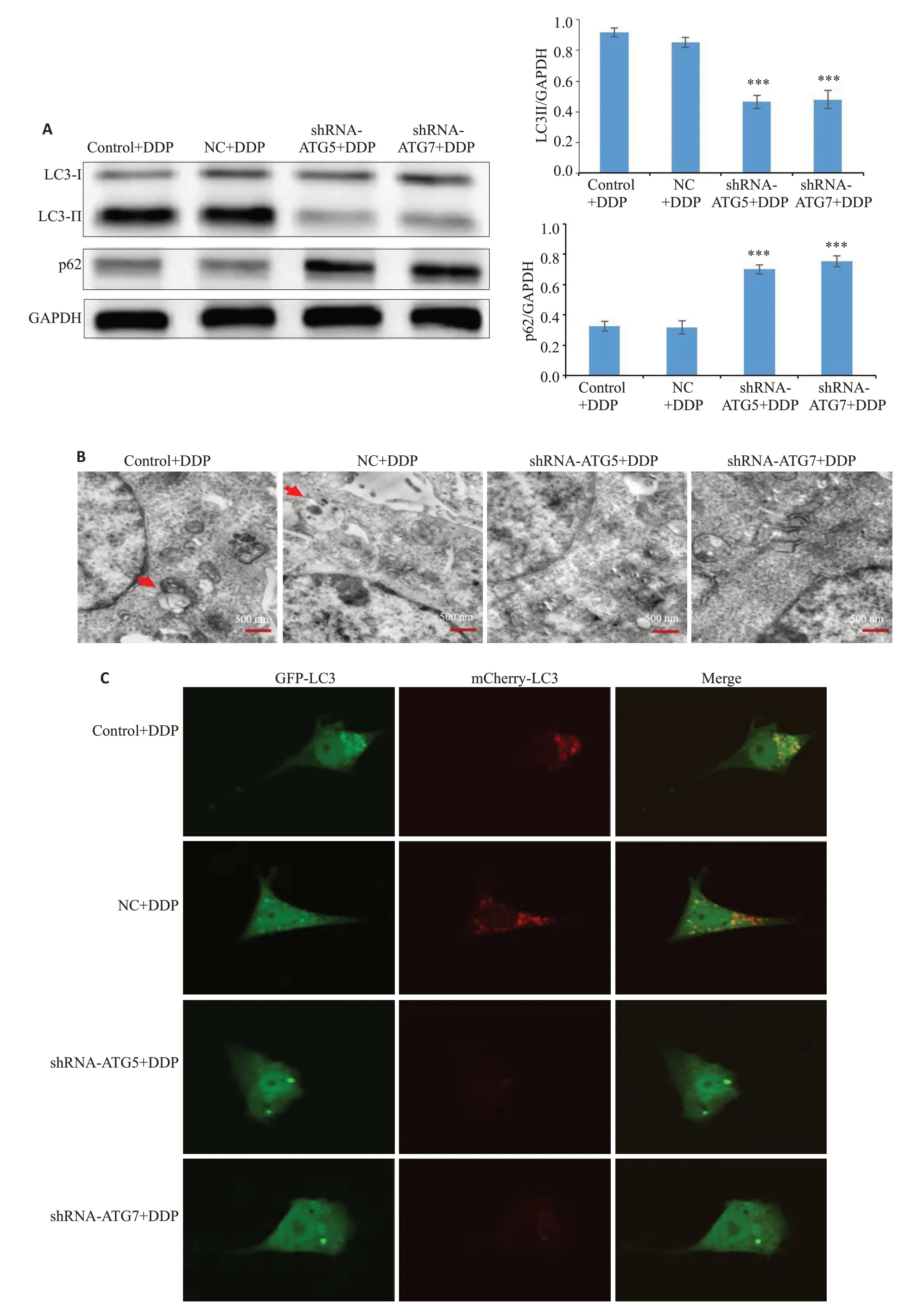
图3 沉默ATG5、ATG7对顺铂介导的I-10/DDP细胞自噬水平的影响Fig.3 Effect of silencing ATG5 and ATG7 on cisplatin-mediated autophagy in I-10/DDP cells(P=3).A:Expressions of LC3 and p62 in I-10/DDP cells.B:Autophagosomes analyzed by transmission electron microscopy (×15 000).C:Autophagosomes and autolysosomes observed with confocal fluorescent microscopy(×400).***P<0.05.
2.4 沉默ATG5和ATG7抑制顺铂作用后的细胞增殖
顺铂(15 μmol/L)处理转染组细胞后,MTT法检测发现shRNA-ATG5+DDP组和shRNA-ATG7+DDP组的细胞存活率明显低于NC+DDP组(P<0.001,图4A)。集落克隆实验检测发现shRNA-ATG5+DDP 组和shRNA-ATG7+DDP 组的克隆形成率明显低于NC+DDP组(图4B)。
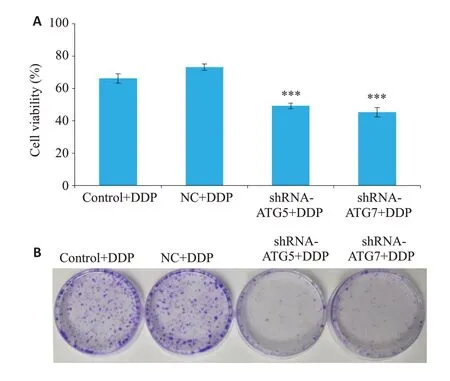
图4 沉默ATG5和ATG7对I-10/DDP细胞增殖的影响Fig.4 Effect of Silencing ATG5 and ATG7 on proliferation in I-10/DDP cells (n=3).A:Cell viability measured by MTT assay.B:Cloning efficiency assessed by colony-forming assay.***P<0.001 vs NC+DDP group.
3 讨论
铂类金属化合物是目前最常用于治疗睾丸癌的一线化疗药物,通过抑制DNA复制和转录,导致DNA断裂和编码错误进而杀死癌细胞[16-17]。然而化疗产生的耐药问题是目前控制与治愈癌症的重要挑战,这也是许多癌症患者化疗失败的原因。
化疗药物刺激可诱导癌细胞自噬,进而维持线粒体功能,减少DNA损伤,并为癌细胞提供氨基酸和ATP等营养物质,导致癌细胞存活期延长,继而产生耐药性[10]。已有研究表明在乳腺癌、宫颈癌、肝癌、胃癌等多种癌症的化疗中会激活自噬,进一步导致化疗耐药性的产生[18-21]。本研究发现,耐顺铂睾丸癌细胞I-10/DDP在使用顺铂处理后,LC3-Π的表达水平明显增加,p62的表达水平降低,细胞中自噬溶酶体和自噬体的数量均增加。以上结果表明顺铂刺激下,睾丸癌耐药株I-10/DDP细胞中自噬水平升高。这提示我们睾丸癌细胞I-10/DDP耐药性的产生可能与顺铂刺激下自噬水平的异常增多有关。
有学者提出,通过药理学或遗传学方法抑制自噬可增强许多靶向疗法的抗肿瘤作用,为临床用药提供理论依据[22-23]。在哺乳动物细胞中,自噬依赖于核心自噬蛋白(ATG)的功能在内质网中合成自噬小体,并进一步调节和控制自噬形成的各个阶段[24]。先前的研究表明[25-26],ATG5 水平的波动在很大程度上影响自噬和凋亡,ATG5直接参与凋亡小体或自噬小体的形成,从而导致癌细胞对药物的敏感性发生变化。巨噬细胞和肝癌细胞的共培养可以诱导肝癌细胞中的自噬,而敲除ATG5可以抑制巨噬细胞诱导的自噬,从而提高奥沙利铂的疗效[27]。另有研究报道[28],下调ATG7 可以增加依赖caspase-9和caspase-3的细胞凋亡,并增强表柔比星的细胞毒性。因此猜测,通过调控ATG相关基因影响自噬水平,在治疗睾丸癌细胞耐药问题上具有一定的研究价值。本研究中使用shRNA质粒沉默自噬相关基因ATG5、ATG7,并用顺铂处理沉默组细胞,结果发现沉默ATG5、ATG7 抑制顺铂介导的自噬作用。我们使用MTT 法和集落形成实验检测抑制自噬后,是否影响细胞对顺铂的敏感性。结果发现沉默ATG5、ATG7的细胞在使用顺铂处理后,其细胞存活率更低,克隆形成率更低。这些结果表明,抑制I-10/DDP细胞自噬,可增强顺铂抑制细胞增殖,提高耐顺铂睾丸癌细胞对顺铂的敏感性。
综上所诉,睾丸癌细胞I-10/DDP耐药性的产生与自噬水平的升高有关,通过沉默ATG5、ATG7可抑制顺铂介导的自噬并抑制睾丸癌细胞增殖。然而,顺铂诱导睾丸癌细胞自噬的机制目前尚未明确。有研究表明,化疗药物调控自噬的机制可能与PI3K/AKT/mTOR[29]、ERK/MAPK[30]、p53[31]等通路有关,以上通路在增强肿瘤细胞的化疗敏感性和避免耐药性方面起着重要作用。课题组后期将对自噬与肿瘤耐药的机制进行深入研究,从而为睾丸癌的临床治疗提供理论依据。
