表达气体囊泡的大肠杆菌能安全地增强高强度聚焦超声的消融效果
2021-06-16蒋富杰杨海燕汪瑶台王狄森邹建中
蒋富杰,杨海燕,王 璐,汪瑶台,唐 瑜,王狄森,王 琦,邹建中
重庆医科大学生物医学工程学院//超声医学工程国家重点实验室//重庆市生物医学工程学重点实验室,重庆400016
高强度聚焦超声(HIFU)已广泛应用于实体肿瘤的治疗[1-3]。随着治疗深度增加,超声波能量会衰减,增加治疗功率和延长治疗时间会带来严重的副作用[4-5]。本课题组前期构建HIFU生物靶向增效剂,通过化学键、静电相互作用、生物特异性结合等方式利用双歧杆菌靶向递送HIFU增效物质,提高HIFU的治疗效率[6-10],但是在肿瘤内定植的细菌未结合HIFU增效物质,以及在靶向肿瘤过程中两者连接的稳定性仍需进一步探讨。
非致病性大肠杆菌 如DH5α[11]、BL21[12-13]、Nissle1917[14]等具有靶向肿瘤乏氧区的特性,能递送效应基因或蛋白用于肿瘤的靶向诊疗。据文献报道,气体囊泡(GVs)是一种气体填充的蛋白纳米结构[15-17],通过基因工程技术将表达GVs的“声学信使基因”(ARGs)转入大肠杆菌BL21(AI),能产生GVs并用于超声显像[18]。GVs能在超声图像上显示,就有可能将其用于HIFU消融肿瘤的增效,因GVs内含有气体,而气体是超声治疗增效的主要物质[19],如果能将表达GVs 的大肠杆菌BL21(AI)用作新型HIFU生物靶向增效剂,则不需体外结合增效物质,便能实现增效HIFU消融的目的。但是表达GVs的大肠杆菌BL21(AI)增效HIFU消融的效果及其安全性未知,如经静脉入血是否引发机体炎性反应,对正常组织是否造成影响有待进一步探讨。因此,本研究欲利用大肠杆菌BL21(AI)“自产”增效物质GVs,探讨其增效HIFU消融的效果及其安全性,为深入研究新型HIFU生物靶向增效剂奠定基础。
1 材料和方法
1.1 材料与仪器
1.1.1 主要实验试剂 大肠杆菌BL21(AI)感受态细胞(上海唯地生物有限公司);pET28a-ARG1质粒(重庆医科大学附属儿童医院超声科惠赠);大肠杆菌BL21(AI)/pET28a-ARG1 菌株(本课题组前期构建保存);4T1乳腺癌细胞(重庆医科大学超声影像学研究所惠赠);LB培养基(青岛海博);葡萄糖、L-阿拉伯糖、氨苄青霉素、异丙基-β-D-硫代半乳糖苷(IPTG)(北京索莱宝),SoluLyse-Tris(L200500 Genlantis)(Sigma),小鼠TNF-α、IL-1β ELISA试剂盒(四正柏生物)。
1.1.2 检测仪器 透射电镜(日立7500);海扶刀®聚焦超声肿瘤治疗系统(重庆海扶医疗科技股份有限公司);Olympus-BX51光学显微镜(OLYMPUS);XT-2000i全自动血液分析仪(SYSMEX);全自动生化分析仪(IDEXX Catalyst DXTM)。
1.2 实验方法
1.2.1 含GVs的大肠杆菌BL21(AI)制备 复苏冻存大肠杆菌BL21(AI)-pET28a-ARG1;将复苏后的菌液接种于含氨苄青霉素的LB固体培养基上,37 ℃孵育。次日挑选长出的菌落接种于含氨苄青霉素、1%葡萄糖LB液体培养基,220 r/min,37 ℃孵育12 h;按1∶20比例扩大培养,220 r/min,37 ℃培养至A600nm=0.5,用0.5%L-阿拉伯糖和0.4 mmol/L IPTG诱导,30 ℃下培养22 h,经350 g,4 ℃离心4 h,收集上层悬浮细菌,即得表达GVs的大肠杆菌(测得1A600≈1.07×109CFU/mL)。重悬于8%的SoluLyse-Tris和250 μL/mL的溶菌酶中,4 ℃旋转孵育1 h,裂解后将液体转移到2 mL 试管中,8 ℃下400 g离心2 h,得到分离纯化的GVs。
1.2.2 动物模型与实验分组 选取4~6周龄雌性BALB/c小鼠136只,体质量20±2 g,由重庆医科大学动物实验中心提供,许可证号:SCXK(渝)2018-0003,本研究符合重庆医科大学实验动物伦理委员会所制定的伦理学标准。常规饲养136只BALB/c小鼠,从中随机选取32只,构建4T1 荷瘤小鼠模型:选取对数生长期的4T1乳腺癌细胞,胰酶消化、离心并重悬调整细胞浓度为1×107/mL,接种100 μL细胞于小鼠右侧大腿根部皮下,待肿瘤长到直径约0.8~1 cm时用于观察大肠杆菌BL21(AI)在荷瘤小鼠体内的分布及HIFU增效实验。余下104 只BALB/c 小鼠也随机分为GVs 组和对照组(n=52),用于一般情况、血培养、血常规、血生化及炎性因子指标的检测。GVs组经尾静脉注射含GVs的大肠杆菌BL21(AI)-pET28a-ARG1 悬液200 μL(浓度为1×108CFU/mL),对照组注射无菌PBS 200 μL。
1.2.3 大肠杆菌BL21(AI)在重要脏器和瘤内的分布 选取24只4T1荷瘤小鼠,随机分为GVs组和对照组,每组12只,于注射后第1、4、15天,每个时间点选取4只,以无菌操作将荷瘤小鼠心、肝、脾、肺、肾和肿瘤组织取出,置于2 mL无菌PBS中,经组织匀浆器匀浆后,将匀浆液按照10倍比例稀释。取100 μL终稀释液接种于含氨苄青霉素LB琼脂培养基,37 ℃培养12 h,观察平板菌落生长情况。
1.2.4 HIFU辐照及评价(1)HIFU辐照选取8只4T1荷瘤小鼠,随机分为GVs组和对照组,每组4只,于注射后第4 天,在超声引导下行HIFU 辐照,工作频率为1MHz,点辐照,治疗功率150 W,辐照时间3 s;(2)凝固性坏死体积HIFU辐照后24 h处死荷瘤小鼠,完整剥离肿瘤,沿声束长轴方向切开肿瘤,37 ℃、2%氯化三苯基四氮唑(TTC)染色40 min,测算凝固性坏死体积:V(mm3)=(π/6)×长度×宽度×深度;(3)肿瘤组织病理观察经HIFU辐照后的肿瘤组织于4%多聚甲醛溶液中固定,经过脱水、石蜡包埋、切片、HE染色,光学显微镜下(×100倍)观察肿瘤组织损伤。
1.2.5 一般情况 选取16只正常BALB/c小鼠,随机分为GVs组和对照组,每组8只,注射后15 d内观察小鼠的精神状态、运动情况、进食、进水以及存活情况,每2 d记录小鼠体质量的变化。
1.2.6 血培养 选取24只正常BALB/c小鼠,随机分为GVs组和对照组,每组12只,于注射后第12、24和48 h,每个时间点4只,无菌采集小鼠静脉血液500 μL,稀释于4.5 mL无菌PBS中,取100 μL稀释液接种于含氨苄青霉素抗性的LB固体培养基,放入37 ℃恒温培养箱,连续观察5 d,计数平板菌落数。
1.2.7 血常规检测 选取32只正常BALB/c小鼠,随机分为GVs组和对照组,每组16只,于注射前、注射后第1、4、15天,每个时间点4只,经小鼠眼眶取血500 μL,进行血常规检测,记录白细胞、红细胞、血小板、血红蛋白计数。
1.2.8 肝、肾功生化指标检测 选取32只正常BALB/c小鼠,随机分为GVs组和对照组,每组16只,于注射前、注射后第1、4、15天,每个时间点4只,经小鼠眼眶取血1.5 mL,促凝后低温离心3000 r/min,10 min,收集上层血清,测定肝功生化指标谷丙转移酶(ALT)、谷草转移酶(AST)和肾功生化指标肌酐(CREA)、尿素氮(BUN)。
1.2.9 炎性因子检测 按照试剂盒的说明,采用ELISA试剂盒测定GVs 组和对照组血清中肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)的水平。
1.2.10 肝、脾组织病理学检查 实验结束后,收集小鼠的肝、脾组织,用4%多聚甲醛溶液固定、脱水、石蜡包埋、切片,HE染色,在光学显微镜下观察肝、脾组织结构和细胞形态并拍照(×200倍)。
1.3 统计学分析
使用SPSS 25.0对实验数据进行统计分析,计量资料以均数±标准差表示,满足正态分布的数据采用t检验,不满足正态分布的数据采用非参数秩和检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 表达GVs的大肠杆菌BL21(AI)表征
成功制备表达GVs的大肠杆菌BL21(AI),肉眼观呈乳白色,因内部GVs的浮力作用使菌液漂浮在培养基上层(图1A);透射电镜(TEM)可见大肠杆菌BL21(AI)内部含有中空、两端呈双锥状的圆柱体状GVs,直径50~150 nm,长度100~400 nm,如箭头所示(图1B);在4 ℃条件下,经多次离心、裂解以及重悬得到分离纯化后GVs,TEM可观察其形态,如箭头所示(图1C)。
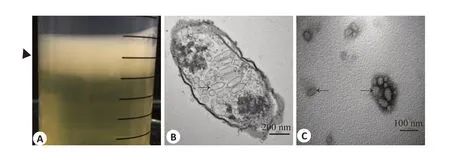
图1 表达GVs的大肠杆菌BL21(AI)表征Fig.1 Characterization of E.coli BL21 (AI) expressing GVs.A: E.coli after induction showing the presence of buoyant GVs;B:TEM of E.coli BL21 (AI) expressing GVs(Original magnification:×60 000).The black arrow indicates GVs.C:TEM of GVs(black arrows,×120 000).
2.2 大肠杆菌BL21(AI)在重要脏器和瘤内的分布
GVs组心、肝、脾、肺和肾等重要脏器平板上的细菌随着时间延长逐渐被清除,而肿瘤组织平板一直有细菌生长(图2A)。通过计数平板上的菌落发现,从第1天至15天,心、肝、脾、肺和肾组织上的菌落数逐渐减少,至15 d时检测不到;而肿瘤组织内的细菌数在第4天时达到最大值(图2B)。
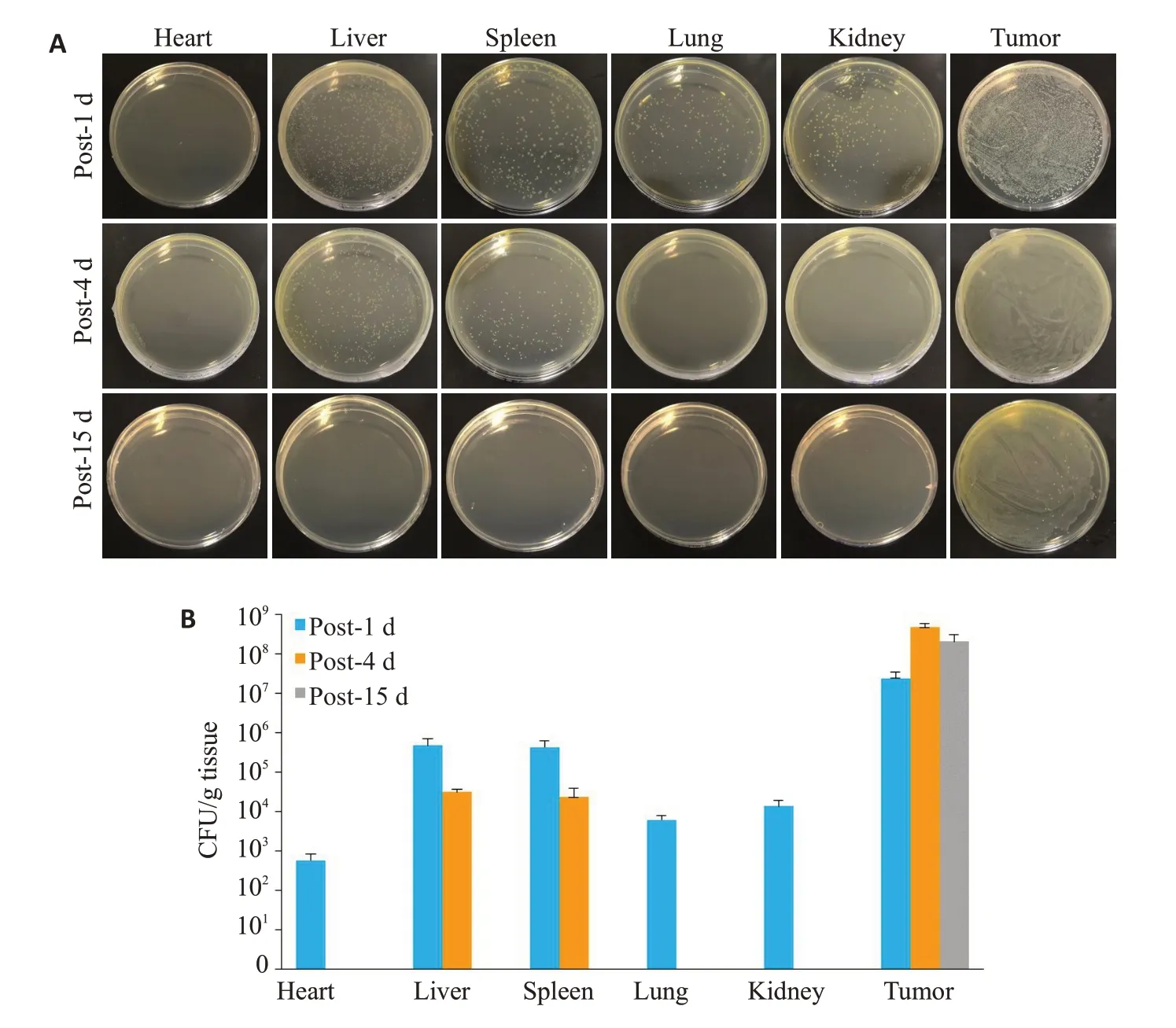
图2 大肠杆菌BL21(AI)在体内的分布Fig.2 In vivo biodistribution of E.coli BL21 (AI).A:Homogenates of solid LB agar plates of bacterial colonization in various organs at different time points after injection of E.coli BL21(AI).B:Quantification of bacterial colonization in various organs of 4T1-bearing mice.
2.3 HIFU消融效果
2.3.1 凝固性坏死体积 HIFU辐照后,GVs组和对照组肿瘤组织经TTC染色,可见灰白色区域为凝固性坏死,而红色区域为未坏死区(图3)。对照组凝固性坏死体积均值为24.80±2.23,GVs组为76.06±6.51,差异有统计学意义(P<0.001)。
2.3.2 肿瘤组织病理学变化 在光学显微镜下观察到对照组未消融区域与消融区分界不明显,消融区存在较多散在的细胞碎片,而GVs组分界明显,消融区域内细胞变形和细胞核固缩、裂解,大量细胞质被染成红色(图4)。
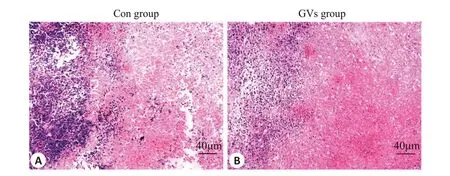
图4 HIFU辐照后肿瘤组织病理切片Fig.4 Cross sections of tumor tissue after HIFU ablation (HE staining,×100).A:Control group.B:GVs group.
2.4 体质量变化
在15 d内未发现对照组和GVs组小鼠死亡,GVs组小鼠的体质量在注射第2天与对照组相比略有下降(P=0.037),但是之后开始呈上升趋势,至第4天时生长速度与对照组保持一致(图5)。
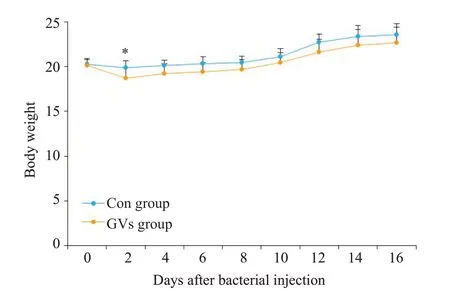
图5 体质量变化Fig.5 Body weight changes in the control group and GVs group.*P<0.05 vs control group.
2.5 血液培养检测
通过平板菌落计数发现,在注射后12、24、48 h血液中均未检测出细菌,说明血液中表达GVs的大肠杆菌BL21(AI)在12 h 之内已经被清除掉,表明大肠杆菌BL21(AI)不能在血液中繁殖,对照组均无细菌检出。
2.6 血常规变化
注射后第1天,GVs组白细胞下降,与对照组相比有明显差异(P=0.003),第4天GVs组白细胞回升,与对照组相比无明显差异(P=0.72),第15天与对照组相比无明显差异(P=0.59);第1、4、15天GVs组红细胞与对照组相比无明显差异(P=0.94,P=0.69,P=0.27);第1、4、15 天GVs 组血红蛋白与对照组相比无明显差异(P=0.63,P=0.41,P=0.76);第1、4、15天GVs组血小板与对照组相比无明显差异(P=0.51,P=0.86,P=0.81,图6)。
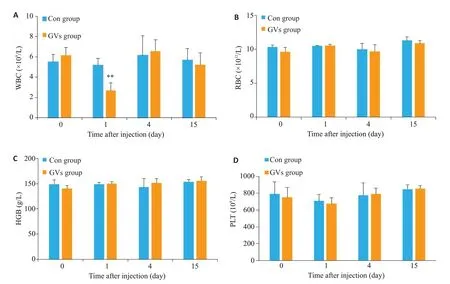
图6 GVs组和对照组血常规变化Fig.6 Blood routine changes in the control group and GVs group.A:White cell counts;B:Red blood cell;C:Hemoglobin counts;D:Platelet counts.**P<0.01 vs control group.
2.7 肝、肾功生化指标变化
第1、4、15天GVs组ALT与对照组相比无明显差异(P=0.71,P=0.35,P=0.12);第1、4、15天GVs组AST与对照组相比无明显差异(P=0.59,P=0.77,P=0.46);第1、4、15 天GVs 组CREA 与对照组相比无明显差异(P=0.51,P=0.47,P=0.62);第1、4、15天GVs组BUN与对照组相比无明显差异(P=0.90,P=0.97,P=0.86,图7)。
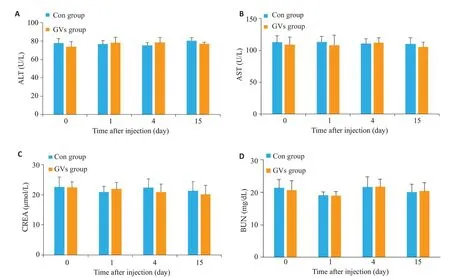
图7 肝、肾功生化指标变化Fig.7 Blood biochemical indexes of liver and kidney functions in the control group and GVs group.A:ALT.B:AST.C:CREA.D:BUN.
2.8 血清细胞因子变化
注射后第1天实验组TNF-α水平增加,明显高于对照组(P=0.003),第4、15天TNF-α的水平与对照组相近(P=0.16,P=0.48);实验组IL-1β水平在第1天增加,明显高于对照组(P=0.019),第4、15天IL-1β水平与对照组相近(P=0.57,P=0.56,图8)。
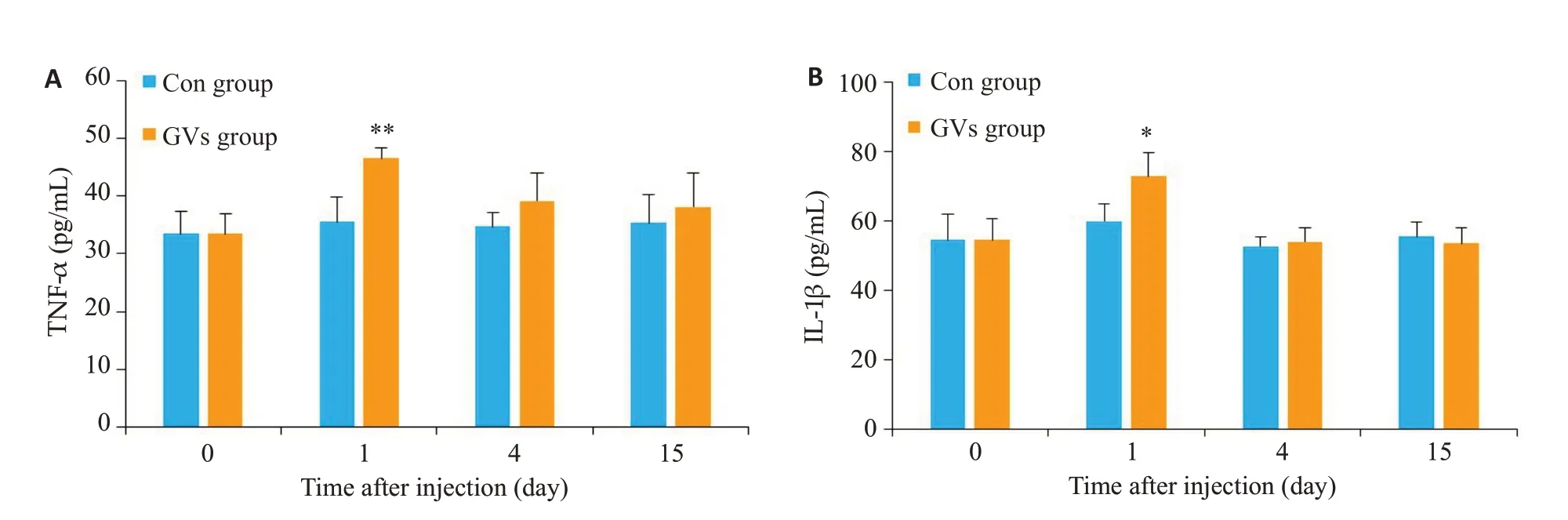
图8 血清细胞因子变化Fig.8 Changes in serum levels of TNF-α(A)and IL-1β(B)in the control group and GVs group.*P<0.05,**P<0.01 vs control group.
2.9 肝、脾组织病理学变化
注射后15 d,对照组与GVs组肝脏组织病理切片可见肝索条带清晰,肝细胞饱满,细胞核呈蓝紫色,细胞质呈红色,未见明显病理改变;对照组与GVs组脾脏组织病理切片髓质结构清晰,未见明显病理改变(图9)。
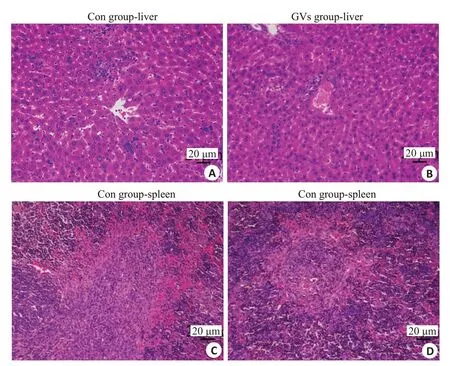
图9 肝、脾组织病理切片Fig.9 Pathological examination of the liver and spleen tissues in the control group and GVs group (HE staining,×200).A:Liver of control group.B:Liver of GVs group.C:Spleen of control group.D:Spleen of GVs group.
3 讨论
近年来,关于非致病性活菌通过静脉注射用于靶向肿瘤的治疗已有大量报道[20-22]。在动物肿瘤模型中的研究发现减毒鼠伤寒沙门氏菌VNP20009[23]、双歧杆菌[24]等经静脉进入机体后在治疗剂量内不会对宿主造成不利影响,而且还具有一定的抗肿瘤活性,但为了更有效的递送抗肿瘤药物或者抑癌分子用于肿瘤治疗,通常需要对细菌进行改造。本研究利用非致病性大肠杆菌BL21 系列菌株[25],通过基因工程改造使其体内表达GVs,这种体内自带增效物质的生物材料可作为增效HIFU消融的物质,结果表明在一定剂量下通过静脉进入血液不会对血液学和重要脏器组织产生明显损伤,并能有效增强HIFU的消融效果。
研究结果表明经静脉注射浓度为1×108CFU/mL表达GVs的大肠杆菌BL21(AI)在血液内12 h便会被全部清除不会在血液中大量繁殖和生存,不会引起菌血症,而且随着时间延长,分布于正常组织中的细菌也会被清除,可能的原因是肝窦和脾网状鞘内的巨噬细胞吞噬并消灭进入血液的非致病性细菌,因此血液中的非致病性细菌浓度能快速降低,分布于正常组织中的细菌也会被逐渐清除[26]。通过对血液生理、生化指标及细胞因子的检测发现,虽然在注射之初引起白细胞数量下降,TNF-α和IL-1β升高,但是都能恢复至正常水平。革兰氏阴性菌表面含有脂多糖[27],而一定量的脂多糖可以激活单核巨噬细胞系统,导致白细胞数量发生变化[28-29],非致病性大肠杆菌脂多糖大多是血清敏感型,随着自身免疫功能的调节,能较快使血液生理指标恢复正常[30],非致病性大肠杆菌还可以降低体内的炎症反应,并在免疫反应中产生适度水平的细胞因子[31],而对血小板、红细胞、血红蛋白以及肝、肾功血生化指标未造成明显影响。肝、脾的组织病理学检查也表明其组织相容性较好,Zhang等[32]发现静脉注射的非致病性大肠杆菌能快速地从血液中清除,而且对小鼠的体质量以及肝、脾脏器的重质量无明显影响。本研究也观察到经静脉注射后小鼠的体重、精神状态、饮食及活动度未见异常,表明经静脉注射表达GVs的大肠杆菌BL21(AI)的安全性较好。
HIFU消融结果表明,表达GVs的大肠杆菌BL21(AI)与PBS相比能够增强HIFU的消融效果,可能的原因为GVs是气体填充的蛋白质纳米结构,这种含气的纳米结构在接受超过195 kPa的声脉冲波压力时,会裂解并释放出内部气体[33-34],而HIFU消融时声场焦域处的声强很高,焦点处的声压幅值可达MPa量级[35],足以引起GVs的崩解并释放气体。因此,GVs具有如超声造影剂等含气结构能增强超声空化效应和热效应的作用[36]。基因工程修饰后的大肠杆菌BL21(AI)仍具有靶向肿瘤乏氧区的能力,表达GVs的大肠杆菌BL21(AI)能靶向定植于肿瘤组织,并且大肠杆菌BL21(AI)体内表达的GVs在HIFU消融时可增强空化效应和热效应,达到增强HIFU消融肿瘤的效果。
综上所述,本研究利用体内稳定表达GVs的大肠杆菌BL21(1×108CFU/mL),可以安全且有效地增强HIFU消融肿瘤组织的效果,为自带增效物质的细菌用于增效HIFU奠定了基础。但本研究为初步探讨,具体增效机制和安全性仍需要更加深入、全面的研究。
