姜黄素通过Wnt/β-catenin 信号通路诱导人晶状体上皮细胞的凋亡和细胞周期阻滞
2021-06-16朱梦云崔双慧郝泽宇王文锐杨清玲陈昌杰王剑锋
朱梦云 ,崔双慧 ,郝泽宇 ,王文锐 ,杨清玲 ,陈昌杰 ,王剑锋,周 琦
1蚌埠医学院第一附属医院眼科,安徽 蚌埠 233004;2癌症转化医学安徽省重点实验室,安徽 蚌埠233030
后发性白内障(PCO)是白内障囊外摘除术术后视力再次下降的主要原因,成年人发生率为30%~50%,而儿童发生率为100%[1]。PCO发生的主要原因是白内障手术术后残余的晶状体上皮细胞(LECs)过度增殖、移行于后囊膜,并转化成纤维细胞,产生细胞外基质,引起后囊膜的混浊和皱褶[2]。目前临床上主要采用YAG激光后囊切开术治疗PCO,而Nd:YAG激光治疗的并发症较多。抗代谢药物虽对体外培养的晶体上皮细胞具有抑制作用,因其副作用而未能应用于临床[3]。姜黄素(Cur)是中药姜黄的最主要有效活性成分,具有抗炎、抗氧化、抗肿瘤细胞生长和转移的作用[4-6]。研究表明姜黄素能够抑制晶状体上皮细胞增殖和诱导细胞凋亡,但是其分子机制尚不清楚[7]。本研究拟在前人的研究基础上进一步从Wnt/β-catenin信号通路来探讨姜黄素诱导晶状体上皮细胞凋亡和细胞周期阻滞的分子机制,以期为姜黄素用于临床防治PCO提供理论基础。
1 材料和方法
1.1 材料与试剂
实验用细胞株:人晶状体上皮细胞株(Human Len cell,HLEC-SRA01/04)购自广州赛库生物技术有限公司,姜黄素(麦克林生化科技公司),高糖型DMEM培养基(Gibco),胎牛血清(Lonsera),Annexin Ⅴ-FITC/PI凋亡试剂盒(Biosharp);聚偏氟乙烯(PVDF膜)、ECL化学发光试剂盒(Millipore);β-catenin、Cyclin D1、c-myc、Caspase-3、Caspase-9、Bax 及Bcl-2 抗体均(武汉博士德),Cyclin B1、CDK1及β-actin抗体(proteintech);辣根过氧化物酶(HRP)标记的山羊抗兔、兔抗鼠二抗(Biosharp)。
1.2 方法
1.2.1 细胞培养及分组 人晶状体上皮细胞株SRA01/04细胞培养于含20%胎牛血清、1%青霉素/链霉素的DMEM培养基中,置于37 ℃、5%CO2的培养箱中培养,待细胞融合度为80%~90%时进行传代培养。将HLEC-SRA01/04细胞分为4组,分别为对照组(不进行任何处理的HLEC-SRA01/04细胞)、实验组(分别用终浓度为20、40、60 μmol/L姜黄素处理HLEC-SRA01/04细胞24 h或48 h)。
1.2.2 MTT法检测HLEC-SRA01/04细胞增殖抑制率
取状态良好的细胞胰酶消化并离心后,使用含20%FBS的完全培养基重悬细胞,制成细胞悬液,以每孔5×103个细胞接种于96孔板,每孔加入100 μL的培养基,常规培养24 h使细胞同步化。24 h后换新鲜DMEM培养基并分别加入浓度为0、20、40、60 μmol/L的姜黄素,每组均设6个复孔,置于培养箱里分别培养24 h,48 h后,每孔加入20 μL MTT溶液,置于培养箱孵育4 h。4 h后弃旧培养液,每孔加入150 μL DMSO,置摇床上低速震荡10 min,使结晶物充分溶解。酶标仪检测波长490 nm处的吸光度值(A490nm),分别计算细胞增殖抑制率[(A对照组-A实验组)/A对照组×100%]。
1.2.3 AnnexinⅤ-FITC/PI染色检测细胞凋亡 取处于对数生长期的HLEC-SRA 01/04细胞制备细胞悬液后接种至6孔板中,每孔加入2 mL培养基,按照实验分组进行加药处理,48 h后收集上清,用不含EDTA胰酶消化离心,收集全部细胞,用4 ℃预冷的PBS洗涤细胞2次;按照凋亡试剂盒说明书进行操作,室温避光孵育10~20 min,CytoFLEX流式细胞仪上机检测,并将实验重复3次。
1.2.4 PI染色检测细胞周期 收集对数生长期的细胞制备成细胞悬液接种至6孔板中,37 ℃培养箱24 h,按照实验分组进行加药处理,48 h弃上清,用不含EDTA胰酶消化离心,收集全部细胞,用4 ℃预冷PBS洗涤细胞2次,并用70%酒精4 ℃过夜。按照周期试剂盒说明书进行染色,37 ℃孵育30 min,300 目过滤膜过滤,CytoFLEX流式细胞仪上机检测,并将实验重复3次。
1.2.5 罗丹明123(Rho123)流式细胞仪测线粒体膜电位 调整细胞悬液浓度后接种于6孔板中,每孔加入2 mL培养液,再进行相关的加药处理。48 h后终止培养,0.25%不含EDTA胰酶消化离心,收集全部细胞,用PBS洗涤细胞,再加入1 mL温育含Rho123的PBS稀释液,避光,37 ℃孵育60 min。然后用PBS再洗涤细胞两次,重悬后转入流试管中,流式细胞仪上机检测,并将实验重复3次。
1.2.6 Western blot法检测相关蛋白的表达 按照实验分组处理细胞48 h,消化细胞后用预冷的PBS 洗涤,加入蛋白裂解液提取总蛋白,采用蛋白质二甲喹啉甲酸法(BCA法)进行蛋白定量分析;加入5×SDS上样缓冲液至终浓度为1×,蛋白于95 ℃煮10 min;蛋白样品总量为20 μg;Protein Lead上样量为5 μL,100 V、10%十二烷基硫酸钠聚丙烯胶电泳(SDS-PAGE)1 h;电泳结束后将蛋白转置PVDF膜;将膜放入封闭液中置于摇床室温封闭2 h;孵育一抗,4 ℃孵育过夜;TBS-T缓冲液洗涤PVDF膜3次,每次10 min;HRP标记的羊抗兔、羊抗鼠二抗(1∶5000)37 ℃孵育2 h后洗膜,进行BIO-RAD成像系统拍照,Image J软件分析灰度结果,每组实验重复3次。
1.3 统计学方法
采用统计学软件SPSS 21.0分析数据,计量资料,以均数±标准差表示,四组差异比较采用单因素方差分析,差异有统计学意义时,进一步采用LSD-t检验进行两两比较,P<0.05表示差异有统计学意义。
2 结果
2.1 姜黄素对HLEC-SRA01/04细胞增殖的影响
MTT结果显示,相同时间点内随着姜黄素浓度的增加,各实验组细胞抑制率逐渐增高(P<0.001);且随着培养时间延长,不同浓度的姜黄素(0、20、40、60 μmol/L)对HLEC-SRA01/04细胞增殖的抑制率也逐渐增高(P<0.001,表1)。
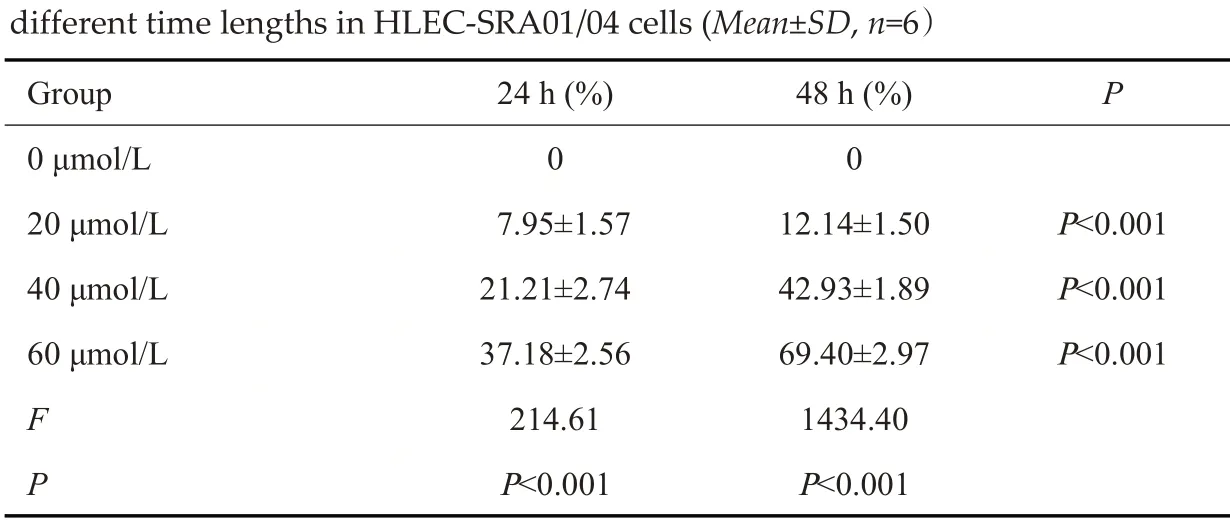
表1 姜黄素不同浓度及不同作用时间对HLEC-SRA01/04细胞增殖的抑制率的比较Tab.1 Inhibition rates of curcumin treatment at different concentrations for
2.2 姜黄素对HLEC-SRA01/04细胞凋亡的影响
流式细胞仪结果显示,不同浓度(0、20、40、60 μmol/L)姜黄素处理的HLEC-SRA01/04 细胞凋亡率分别为(6.09±1.18)%、(28.18±2.86)%、(41.25±2.08)%、(79.89±4.45)%;各实验组与对照组比较,P均小于0.001,且随着姜黄素浓度的增加,HLEC-SRA01/04细胞凋亡率明显增高(F=340.16,P<0.001,图1)。为了进一步了解姜黄素诱导HLEC-SRA01/04细胞的凋亡机制,我们通过Rho123法和Western blot法分别检测线粒体膜电位和线粒体凋亡相关蛋白:如图2所示,随着姜黄素浓度的增加,HLEC-SRA01/04细胞线粒体膜电位和抑制凋亡蛋白Bcl-2蛋白水平逐渐下降,而caspase-9、caspase-3和促凋亡蛋白Bax蛋白水平逐渐增加,各组蛋白两两比较结果(图2E~H)。
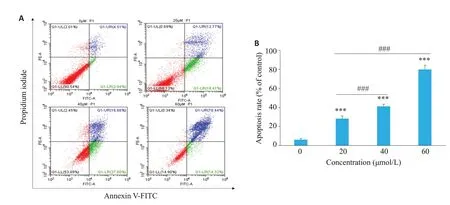
图1 姜黄素对HLEC-SRA01/04细胞凋亡的影响Fig.1 Apoptosis rate of HLEC-SRA 01/04 treated with different concentrations of curcumin for 48 h.A:AnnexinⅤ-FITC/propidium iodide apoptosis assay.B:Quantitative analysis of the result.***P<0.001 vs 0 μmol/L;###P<0.001.

图2 Rho123法和Western blot分别检测不同浓度姜黄素对晶状体上皮细胞的线粒体膜电位和线粒体凋亡相关蛋白表达水平的影响Fig.2 Apoptosis rate of HLEC-SRA 01/04 treated with different concentrations of curcumin for 48 hours.A-B:Flow cytometric analysis of MMP(ΔΨm) by Rho123.C:Quantitative analysis of the result.D-H:caspase-9、caspase-3、Bax and Bcl-2 expressions detected by Western blot in HLEC-SRA01/04 incubated with curcumin for 48 h.*P<0.05 vs 0 μmol/L,***P<0.001 vs 0 μmol/L;#P<0.05.
2.3 姜黄素对人晶状体上皮细胞的周期影响
根据MTT 的结果分析,姜黄素处理HLEC-SRA 01/04细胞48 h后,药物达到最有效抑制细胞增殖效果,故选取姜黄素处理细胞48 h后作为后续实验处理时间。如图3示细胞被阻滞于G2/M期,对照组及姜黄素(20、40、60 μmol/L)组中G2/M 期细胞百分率分别为(12.473±1.421)%、(16.366±0.715)%、(22.047±0.073)%、(38.850±1.120)%;与对照组比较,实验组G2/M期细胞率差异有统计学意义(F=427.70,P<0.001),两两比较结果(图3B)。并对G2/M期细胞周期蛋白Cyclin B1和CDK1蛋白进行检测,姜黄素可以显著下调两种蛋白的表达水平见图3C~E。

图3 姜黄素对HLEC-SRA01/04细胞周期的影响Fig.3 Effect of curcumin on G2/M phase in HLEC-SRA01/04.A-B:Cell cycle distribution was assessed by flow cytometry.C-E:Western blot evaluation of the expression of G2/M phase cell cycle-related proteins Cyclin B1,CDK1 in HLEC-SRA01/04.*P<0.05 vs 0 μmol/L,***P<0.001 vs 0 μmol/L;#P<0.05,###P<0.001.
2.4 Western blot检测β-catenin、c-myc、cyclin D1的表达
姜黄素干预HLEC-SRA01/04 细胞48 h,人晶状体上皮细胞β-catenin表达量逐渐降低,而下游靶蛋白c-myc、Cyclin D1表达量逐渐降低(图4A)。不同浓度组各蛋白表达水平比较,差异均有统计学意义,各蛋白两两组间比较(图4B、C)。

图4 Western blot检测β-catenin、c-myc、cyclin D1的表达Fig.4 Western blotting for detecting the expression of β-catenin,c-myc and cyclin D1.*P<0.05 vs 0 μmol/L;#P<0.05.
3 讨论
后发性白内障(PCO)是白内障术后最常见的并发症,可导致对比敏感度下降、囊袋收缩,影响术后视功能[8]。PCO发生与手术时患者的年龄、是否有糖尿病、手术方式、人工晶状体的材料等因素有关[9]。PCO发病率在成年人中达30%~50%,在儿童中,由于儿童晶状体上皮细胞增生能力极强,白内障术后PCO发病率为100%[10]。目前临床上常用YAG激光后囊膜切开术治疗PCO,但并发症较多[11],因此,人们把治疗PCO的希望寄托于药物。近年来天然药物防治PCO的研究逐渐成为热点,其中姜黄素抑制晶状体上皮细胞增殖的作用最强[12]。姜黄素是中药姜黄的主要成分,是天然存在的多酚类化合物,毒性很低,曾被用作食品添加剂,并且具有抗炎、抗氧化、防癌抗癌、抗纤维化、以及促进凋亡等作用[13-15]。有研究证明,姜黄素通过抑制Wnt/βcatenin信号通路来抑制晶状体上皮细胞的增殖[16],另有研究也表明姜黄素能有效地抑制晶状体上皮细胞增殖和诱导其凋亡[7];在本课题的研究中,我们从Wnt/βcatenin信号通路诱导HLEC-SRA01/04细胞凋亡和细胞周期阻滞方面入手,并探寻其凋亡和发生细胞周期阻滞的可能机制。
本实验通过MTT法,发现随着姜黄素药物浓度的增加和作用时间的延长,姜黄素抑制HLEC-SRA01/04细胞增殖的效果增强。随后,我们通过流式细胞仪技术发现姜黄素诱导晶状体上皮细胞SRA01/04细胞凋亡并将其细胞周期停滞于G2/M 期。Western blot 实验结果表明姜黄素可以抑制Wnt/β-catenin 通路相关蛋白(β-catenin,Cyclin D1和c-myc)的表达。
Wnt/β-catenin信号通路与晶状体上皮细胞的增殖密切相关[16],Wnt/β-catenin信号通路主要通过Wnt因子与卷曲蛋白和低密度脂蛋白受体相关蛋白结合,激活轴蛋白和靶蛋白,使糖原合成酶-3β的去磷酸化,引起β-catenin蛋白在细胞浆内的不断积累,当β-catenin蛋白在胞浆内积累到一定程度的时候转入细胞核中,与T细胞因子和淋巴增强因子结合形成复合物,促进下游靶基因c-myc和Cyclin D1的转录,从而影响细胞的增殖、凋亡、迁移和干细胞的分化能力[17-18]。有研究表明,姜黄素能够下调这一通路中下游靶蛋白Cyclin D1和c-myc的表达,降低分裂期细胞的比例,从而抑制细胞增殖诱导细胞凋亡[19]。本研究发现姜黄素抑制晶状体上皮细胞中的β-catenin,Cyclin D1和c-myc的相对蛋白表达,提示姜黄素可以通过抑制Wnt/β-catenin通路抑制PCO中晶状体上皮细胞的生长。
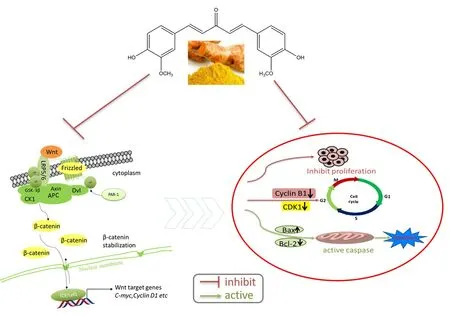
图5 姜黄素通过Wnt/β-catenin 信号通路诱导人晶状体上皮细胞凋亡和细胞周期阻滞Fig.5 Curcumin induces human lens epithelial cell apoptosis and cell cycle arrest by inhibiting Wnt/β-catenin signaling pathway.
为了进一步研究姜黄素是否是通过诱导细胞凋亡和阻滞细胞周期来抑制晶状体上皮细胞SRA01/04增殖,我们通过流式细胞仪观察到姜黄素处理后的HLEC-SRA01/04细胞凋亡率增加并将细胞周期阻滞在G2/M期。细胞凋亡是有基因调控的细胞主动死亡过程[20]。在细胞凋亡发生过程中,多种线粒体通路相关促凋亡蛋白(如Bax、caspase-3、caspase-9)转移至线粒体,导致线粒体的结构破坏、内膜对氢离子的通透性增加进而引起线粒体膜电位下降甚至消失[21]。其中caspase-3是细胞凋亡过程中最主要的剪切酶,本研究结果显示,姜黄素可促进caspase-3和Bax蛋白表达水平升高进而促进HLEC-SRA01/04细胞凋亡。线粒体是细胞凋亡调控的活动中心,Bcl-2家族蛋白主要通过调节线粒体功能来调节细胞的凋亡,最终活化caspase-9进而激活caspase-3导致细胞凋亡[22-24]。徐哲等研究表明姜黄素可以通过促进晶状体上皮细胞凋亡抑制其增殖,但LECs 细胞凋亡途径不明。本研究发现,姜黄素促进LECs细胞中促凋亡蛋白(caspase-3,caspase-9和Bax)的表达水平和导致其线粒体膜电位下降,这提示了姜黄素是通过线粒体凋亡信号通路促进LECs细胞凋亡。
有研究表明,姜黄素可以通过减弱Wnt 信号通路,使髓母细胞瘤细胞停滞于G2/M期[25]。在细胞周期中[26-31],首先Cyclin B1 是G2/M期转换所需要的重要蛋白,其次CDK1 的Thr14,Tyr15 和Thr161 在上游被Myt1等激酶磷酸化,激活了CDK1-Cyclin B1复合体,调节G2期到M期的转换,进而启动细胞的有丝分裂进程。本研究中,姜黄素可以将晶状体上皮细胞周期阻滞在G2/M期且随着姜黄素浓度的增加G2/M期相关蛋白Cyclin B1和CDK1表达水平逐渐下降,结果提示姜黄素通过下调Cyclin B1和CDK1蛋白表达水平,导致晶状体上皮细胞周期停滞于G2/M期,从而影响晶状体上皮细胞SRA01/04细胞进行有丝分裂。
综上所述,姜黄素通过抑制晶状体上皮细胞中Wnt/β-catenin信号通路中β-catenin的蛋白表达和相关下游靶基因的转录,诱导其细胞凋亡和细胞周期阻滞于G2/M期,从而抑制晶状体上皮细胞增殖。这揭示了姜黄素可能抑制白内障手术后残余的晶状体上皮细胞的异常增殖。但是,PCO的发病机制复杂,可能是多条通路和靶点共同作用的结果,需要在未来的实验中进一步探索。
