CRISPR/Cas13a重组蛋白表达纯化及其连带剪切酶活性的鉴定
2021-05-24张雨杭孙亚宁李青梅郭军庆邓瑞广张改平
王 勋,张雨杭,孙亚宁,李青梅,李 鸽,王 丽,郭军庆,邓瑞广,张改平,
(1.河南农业大学 牧医工程学院,河南 郑州 450002; 2.河南百奥生物工程有限公司,河南 郑州 450002; 3.河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002)
规律间隔成簇短回文重复序列(Clustered regularly interspaced short palindromic repeats,CRISPR)广泛存在于细菌和古细菌基因组中,参与抵抗外源遗传物质的入侵,主要由CRISPR相关蛋白(CRISPR-associated protein,Cas)参与完成。依据Cas蛋白在防御过程中参与的角色,可将CRISPR/Cas系统分为Class 1(由多个Cas蛋白形成的复合物参与外源核酸的切割)和Class 2(由单一的Cas蛋白切割外源核酸)。由于Class 2 CRISPR/Cas系统较为简单,被开发为基因编辑工具,引起人们广泛关注和应用。其中,CRISPR/Cas9系统已广泛应用于基因功能研究、模式动物构建及植物遗传育种等各个领域[1-5]。随着分子生物学、信息学与遗传学的发展,一种全新的Class 2 CRISPR/Cas13系统于2015年被发现[6]。研究表明,Cas13是一个由RNA所引导的RNA切割酶,在crRNA的引导下能精确剪切细菌细胞中的特定RNA序列[7-8]。然而,Cas13与传统的Cas9又有所不同。在细菌体内,Cas9通过特异性地降解病毒基因组来防御入侵,而Cas13在特异性地破坏入侵病毒基因组之后仍保持活性,继续以一种连带剪切酶活性(Collateral RNase activity)对感染细菌细胞内所有RNA进行破坏,迫使感染细菌各基因在转录水平的全面下调,进入休眠状态,以避免入侵RNA病毒由于随机突变造成的免疫逃逸[9]。
利用Cas13的连带剪切酶活性,一种全新核酸诊断系统于2017年被开发出来(图1),该系统通过加入一种荧光基团/猝灭基团特殊标记的荧光报告底物(Quenched fluorescent RNA reporter),当检测体系中存在靶标核酸时,Cas13a在crRNA的引导下与之匹配并活化,对报告RNA进行切割使荧光基团与其猝灭基团分离,进而将靶标核酸的存在转变为荧光信号[10]。
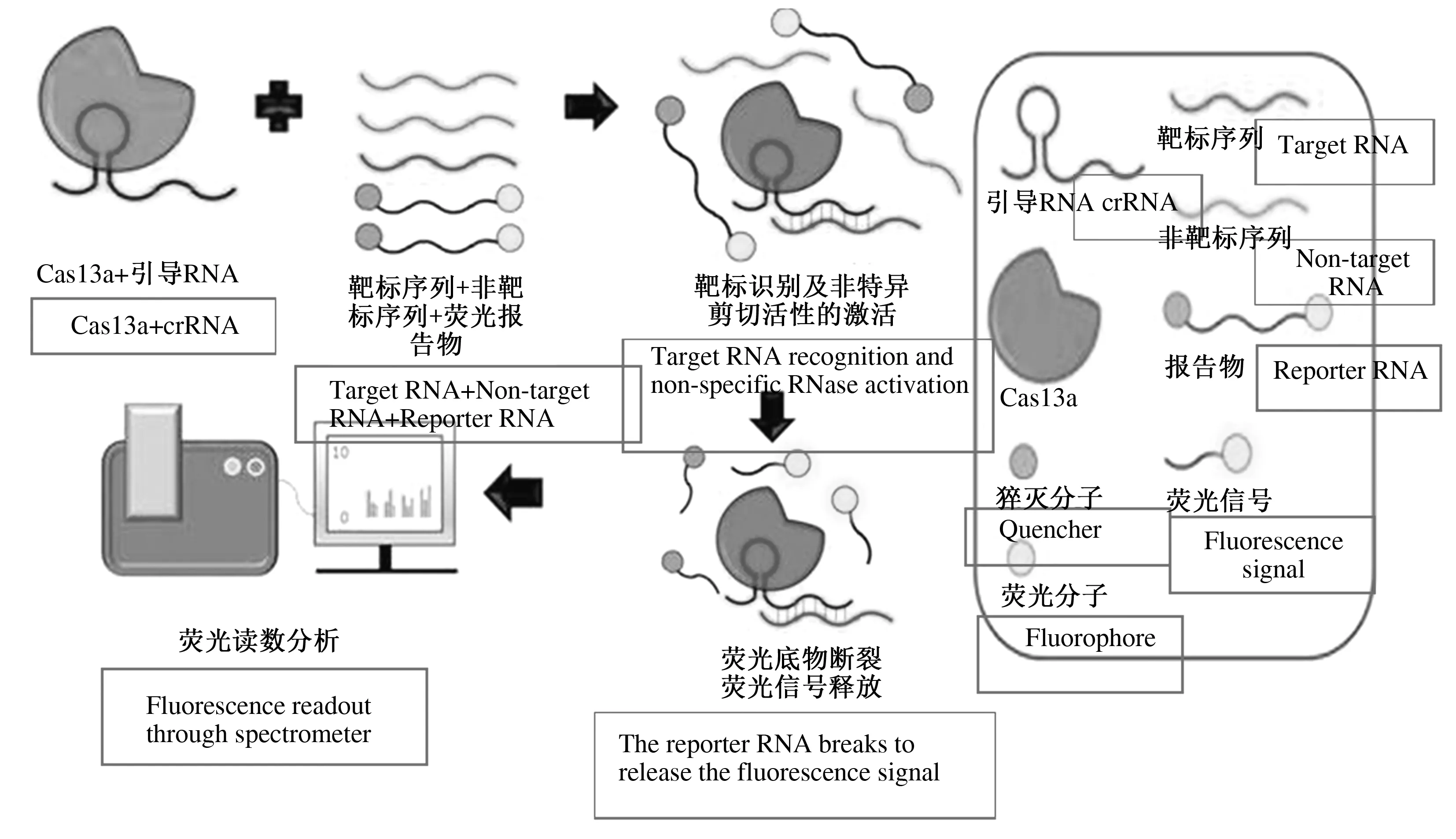
图1 Cas13a核酸诊断系统原理Fig.1 Schematic of nucleic acid detection by Cas13a
自Cas13的这种连带剪切酶活性被首次证实,一系列具有这种特性的Cas家族蛋白被相继发现并应用于核酸检测:(1)SMARGON等[11]在2016年鉴定出14个具有类似Cas13a连带剪切酶活性的Cas13b家族蛋白;(2)CRISPR-Cas12a检测系统不但能够对人乳头瘤病毒(Human papillomavirus,HPV)在单分子水平进行快速专一检测,且能够对HPV16、HPV18进行鉴别检测[12];(3)在不可培养古生菌基因组中鉴定出的Class 2 Cas家族新成员Cas14,也被证实是RNA引导的DNase且具有连带剪切特性,并被应用于对人唾液样品中HERC2基因的单核苷酸多态性(Single nucleotide polymorphisms,SNP)分析[13]。此外,利用不同具有连带剪切酶活性的Cas蛋白对切割底物序列的偏好性,结合不用荧光基团的标记策略,GOOTENBERG等[13]综合PsmCas13b(FAM-rUrUrUrUrUrU-Q)、LwaCas13a(TEX-rArU-Q)、CcaCas13b(Cy5-rUrA-Q)、AsCas12a(HEX-TTATT-Q)的蛋白特性,实现了对包括登革热病毒、寨卡病毒在内的4种靶标进行了多联检测。同时,将SHERLOCK/DETECTR系统与侧流层析技术(Lateral flow assay,LFA)进行了结合,实现了非小细胞肺癌(Non-small cell lung cancer,NSCLC)EGFR L858R点突变及外显子19核酸缺失突变的活体可视化鉴别检测[14],寨卡病毒、登革热病毒、西尼罗河热病毒和黄热病毒的四联鉴别检测[15],登革热4种血清型的四联核酸鉴别检测,2015—2016年美国流感流行毒株的SNP分析[16]。快速诊断和监测预警是疫病防控的关键环节,而基于LwaCas13a重组蛋白连带剪切酶活性建立的检测方法具有敏感、特异、快速、简便的特点,对于疫病的精准诊断意义重大。为此,对LwaCas13a重组蛋白进行原核表达及镍柱亲和层析纯化,以期建立LwaCas13a连带剪切酶活性的检测方法,为CRISPR/Cas13a新型诊断技术在重大动物疫病中的应用奠定基础。
1 材料和方法
1.1 细胞与试剂
LwaCas13a表达载体pET His6-TwinStrep-SUMO-LwaCas13a购自淼灵质粒共享平台(https://www.miaolingbio.com),质粒编号pC013,载体图谱信息公布于https:// benchling.com/s/seq-66Cf Lwu7sL MQM bcXe7Ih。质粒提取试剂盒购自康为世纪公司(CW2105S),Rosetta(DE3)感受态细胞购自TOLOBIO公司(#CC96109),Taq酶购自Takara公司,DL2000 DNA Marker购自Transgene公司,蛋白质 Marker购自Solarbio公司,镍填料购自GE Healthcare公司,HRP-conjugated anti-6×His 抗体购自Protech公司,RNA转录试剂盒购自Promega公司,RNA纯化试剂盒购自Thermo公司,RNA酶抑制剂(RNase inhibitor)购自NEB公司,荧光报告底物购自Thermo公司。
1.2 LwaCas13a重组蛋白的诱导表达
1.2.1 质粒的提取 将pET His6-TwinStrep-SUMO-LwaCas13a甘油菌划线至含有1 mg/L氨苄青霉素的LB固体培养基平板培养后,挑取单菌落至含有1 mg/L氨苄青霉素的LB液体培养基中活化扩大培养,按质粒提取试剂盒说明书进行质粒提取,Nanodrop测定质粒质量浓度,-80 ℃保存。
1.2.2 重组表达载体的构建 将提取的LwaCas13a质粒导入感受态细胞Rosetta(DE3),完成转化后,将转化产物涂布于含有1 mg/L氨苄青霉素的LB固体培养基平板培养。挑取上述平板中单克隆菌落至含有1 mg/L氨苄青霉素的LB液体培养基中振荡培养后,进行测序验证;将测序完全正确的单克隆培养保存在含15%甘油的冻存管中。
1.2.3 LwaCas13a重组蛋白的表达与条件优化 将冻存的表达菌按1∶100比例接种于含有1 mg/L氨苄青霉素的LB液体培养基活化培养;将活化培养的菌液按1∶100比例接种于含有1 mg/L氨苄青霉素的LB液体培养基中培养至OD600为0.6,加入终浓度为1 mmol/L 的IPTG诱导表达,并对诱导温度(16、20、24、37 ℃)和时间(3、6、9、12、15、18、21、24 h)进行优化。收集菌液,在4 ℃条件下6 000 r/min离心10 min,弃上清,收集菌体;用Lysis Buffer(20 mmol/L Tris-HCl,pH值 8.0,500 mmol/L NaCl,1 mmol/L DTT)重悬菌体并超声破碎菌体至菌液澄清透亮。将破碎后的菌体在4 ℃条件下13 000 r/min离心90 s,分离裂解菌体上清和沉淀。以8% SDS-PAGE电泳分析诱导表达菌体及其裂解上清和沉淀,并以HRP-conjugated anti-6×His抗体作为一抗进行Western blot检测。
1.3 LwaCas13a表达蛋白的纯化
通过镍亲和层析纯化LwaCas13a表达蛋白。将菌体裂解上清上样镍亲和层析柱,用5个柱体积Lysis Buffer充分洗涤柱体,以洗去杂蛋白质,分别用4倍柱体积的20 mmol/L咪唑洗脱液(20 mmol/L Tris-HCl, pH值8.0,500 mmol/L NaCl,20 mmol/L咪唑)、100 mmol/L咪唑洗脱液(20 mmol/L Tris-HCl, pH值8.0,500 mmol/L NaCl,100 mmol/L咪唑)、500 mmol/L咪唑洗脱液(20 mmol/L Tris-HCl, pH值8.0,500 mmol/L NaCl,500 mmol/L咪唑)对蛋白质进行洗脱。洗脱液采用SDS-PAGE检测,并以HRP-conjugated anti-6×His抗体作为一抗进行Western blot分析。
1.4 酶活性检测反应体系的建立
根据GOOTENBERG等[17]设计的探针crRNA 及靶标Target RNA(表1),对LwaCas13a的连带剪切酶活性检查方法进行优化。
由上海生工生物工程有限公司合成1对分别带有T7启动子序列的正向DNA oligo及其反向互补DNA oligo,并将DNA oligo经95 ℃变性后通过温度梯度降温(1 ℃/90 s),得到带有T7启动子序列的双链DNA转录模板。
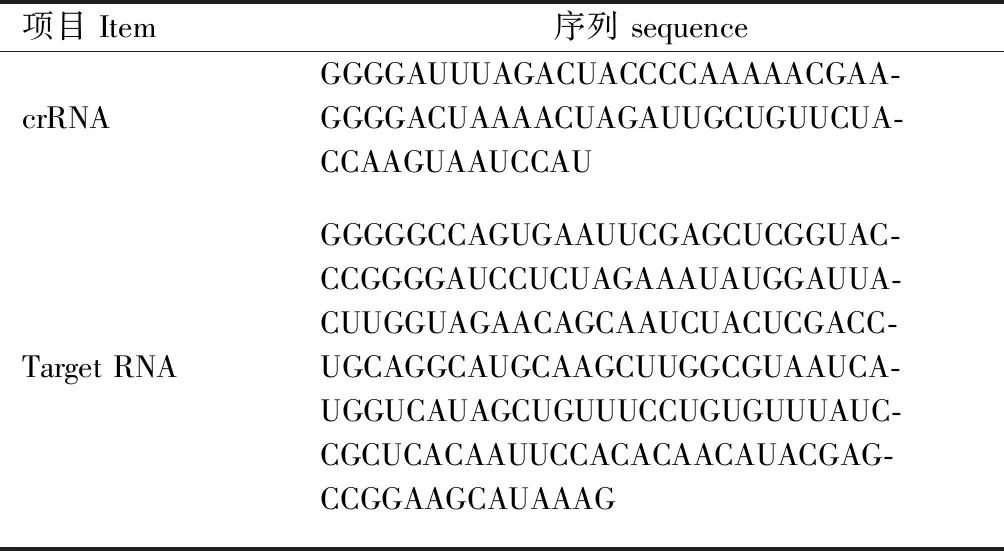
表1 crRNA与Target RNA序列Tab.1 Sequences of crRNA and Target RNA
按照RNA转录试剂盒说明书进行体外转录。20 μL的反应体系:2×转录Buffer 10 μL,DNA转录模板1 μg,T7转录酶Mix 2 μL,DEPC水补至20 μL。转录反应体系在37 ℃水浴孵育1 h后,加入RNA转录试剂盒中的RQ-1 DNase 1 μL,继续在37 ℃水浴孵育30 min消解转录DNA模板。向RNA纯化试剂盒纯化柱中加入650 μL DEPC水,室温静置15 min;将纯化柱放于水平转子的离心机中,750×g离心2 min;弃滤液,将转录产物立即加于纯化柱中,750×g离心2 min;收集滤液即纯化RNA,Nanodrop测定质量浓度后-80 ℃保存。
1.5 LwaCas13a酶活性检测
LwaCas13a酶活性检测反应体系: 在50 μL Reaction Buffer(20 mmol/L HEPES, 60 mmol/L NaCl, 6 mmol/L MgCl2,pH值6.8)体系中,LwaCas13a重组蛋白 54 nmol/L,探针crRNA 30 nmol/L,Target RNA 300 nmol/L,RNA酶抑制剂 (40 000 U/mL)2 μL,荧光报告底物125 nmol/L。除试验组外,分别以缺失体系中各个组分作为阴性对照,以RNase A作为阳性对照。在37 ℃、Ex/Em=490/520 nm荧光读值条件下对LwaCas13a RNase活性进行动力学测定。
2 结果与分析
2.1 LwaCas13a重组蛋白可溶性表达条件的优化
在16、20、24、37 ℃条件过夜诱导10 h,并对诱导菌体破碎后的上清和沉淀进行SDS-PAGE检测。结果表明(图2),与未诱导对照组相比,在4个诱导温度的破碎上清中均出现了1条与目的蛋白预期大小(143.4 ku)一致的条带。同时,随温度的增加,破碎后沉淀中该条带的含量逐步增加,表明过高的温度不利于该蛋白质的可溶性表达。因此,选择16 ℃作为最适培养温度。
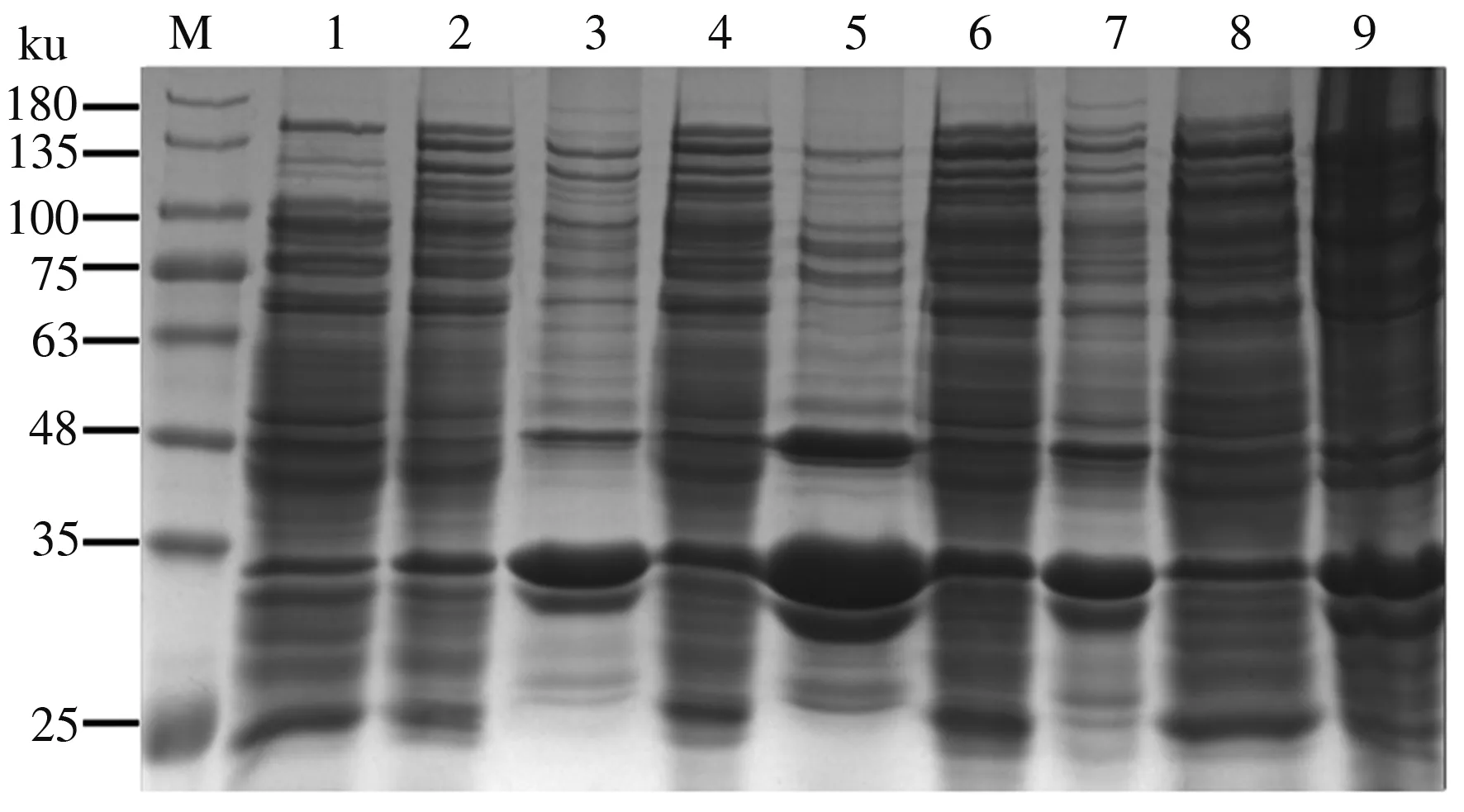
M:蛋白质 Marker;1:未诱导菌体;2:诱导上清(16 ℃);3:诱导沉淀(16 ℃);4:诱导上清(20 ℃);5:诱导沉淀 (20 ℃);6:诱导上清(24 ℃);7:诱导沉淀(24 ℃);8:诱导上清(37 ℃);9:诱导沉淀(37 ℃)
在16 ℃培养温度下,在诱导后3、6、9、12、15、18、21、24 h,对菌体的破碎上清进行SDS-PAGE检测,结果表明(图3),诱导后培养3~15 h,随培养时间的增多,该蛋白质含量逐渐增高;诱导后培养15~24 h,该蛋白质含量逐渐降低,可能是由于过长的培养时间而导致蛋白质降解。
如图3所示,在16 ℃条件下诱导培养15 h时,上清样品SDS-PAGE结果中LwaCas13a重组蛋白对应条带最为明显,即在16 ℃诱导培养15 h时,蛋白质表达量最大。
经16 ℃诱导培养15 h后,超声裂解LwaCas13a诱导表达菌体,离心分离裂解菌体上清和沉淀,分别进行SDS-PAGE检测和Western blot分析(图4)。SDS-PAGE结果显示,在诱导后的菌体中存在1条目的条带;该条带同时存在于诱导后菌体破碎的上清液中(图4A)。Western blot结果显示,LwaCas13a重组蛋白能够与HRP-conjugated anti-6×His 抗体特异性结合(图4B)。可见,经过16 ℃诱导15 h, LwaCas13a重组蛋白实现了可溶性原核表达。
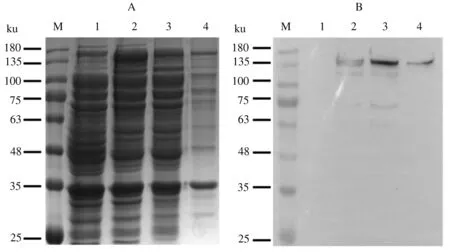
M:蛋白质 Marker;1:诱导前菌体;2:诱导后菌体;3:超声破碎上清;4:超声破碎沉淀
2.2 LwaCas13a重组蛋白的纯化
超声裂解LwaCas13a诱导表达菌体,离心分离裂解菌体上清进行蛋白质纯化。对上样后的纯化柱进行洗脱,并对洗脱液进行SDS-PAGE分析(图5),发现菌体上清中存在目的条带,流穿液中不存在目的条带,证明LwaCas13a重组蛋白能较好地吸附纯化柱;在20 mmol/L咪唑洗脱液条件下,杂蛋白质被大量洗脱;在100 mmol/L咪唑洗脱液条件下,LwaCas13a重组蛋白被洗脱下来,得到纯度较高的LwaCas13a重组蛋白,起到了富集纯化的作用;在500 mmol/L咪唑洗脱液条件下,没有蛋白质洗脱,证明LwaCas13a重组蛋白在100 mmol/L咪唑洗脱液条件下已经完全洗脱。
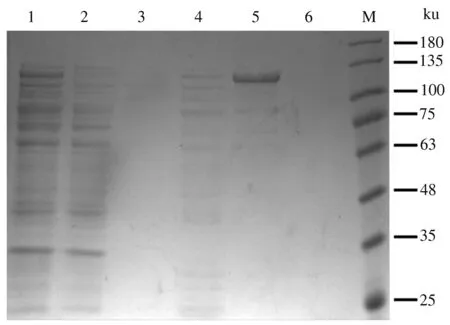
1:菌体上清;2:流穿液;3:洗涤液;4:20 mmol/L咪唑洗脱液;5:100 mmol/L咪唑洗脱液;6:500 mmol/L咪唑洗脱液;
2.3 LwaCas13a连带剪切酶活性测定方法的鉴定
根据LwaCas13a重组蛋白特性,在LwaCas13a酶活性检测反应体系中,LwaCas13a重组蛋白在crRNA的引导下与Target RNA匹配并活化,使荧光报告底物荧光基团与其猝灭基团分离,从而产生荧光信号。由图6可知,通过对试验组以及不同组分缺失对照组的分析发现,LwaCas13a酶活性检测反应体系中任一组分的缺失,都无法检测出明显酶活。
通过对阳性对照组与含RNA酶抑制剂组分析证明,RNA酶抑制剂对RNA酶有抑制作用,但对LwaCas13a重组蛋白没有抑制作用,同时,RNA酶抑制剂的加入,可以保护Reaction Buffer体系中各RNA组分的完整。
在LwaCas13a酶活性检测反应体系中,对Target RNA浓度从1 mmol/L到15.6 nmol/L进行梯度稀释,并控制其他组分不变,LwaCas13a检测Target RNA敏感性为31.2 nmol/L(图7)。
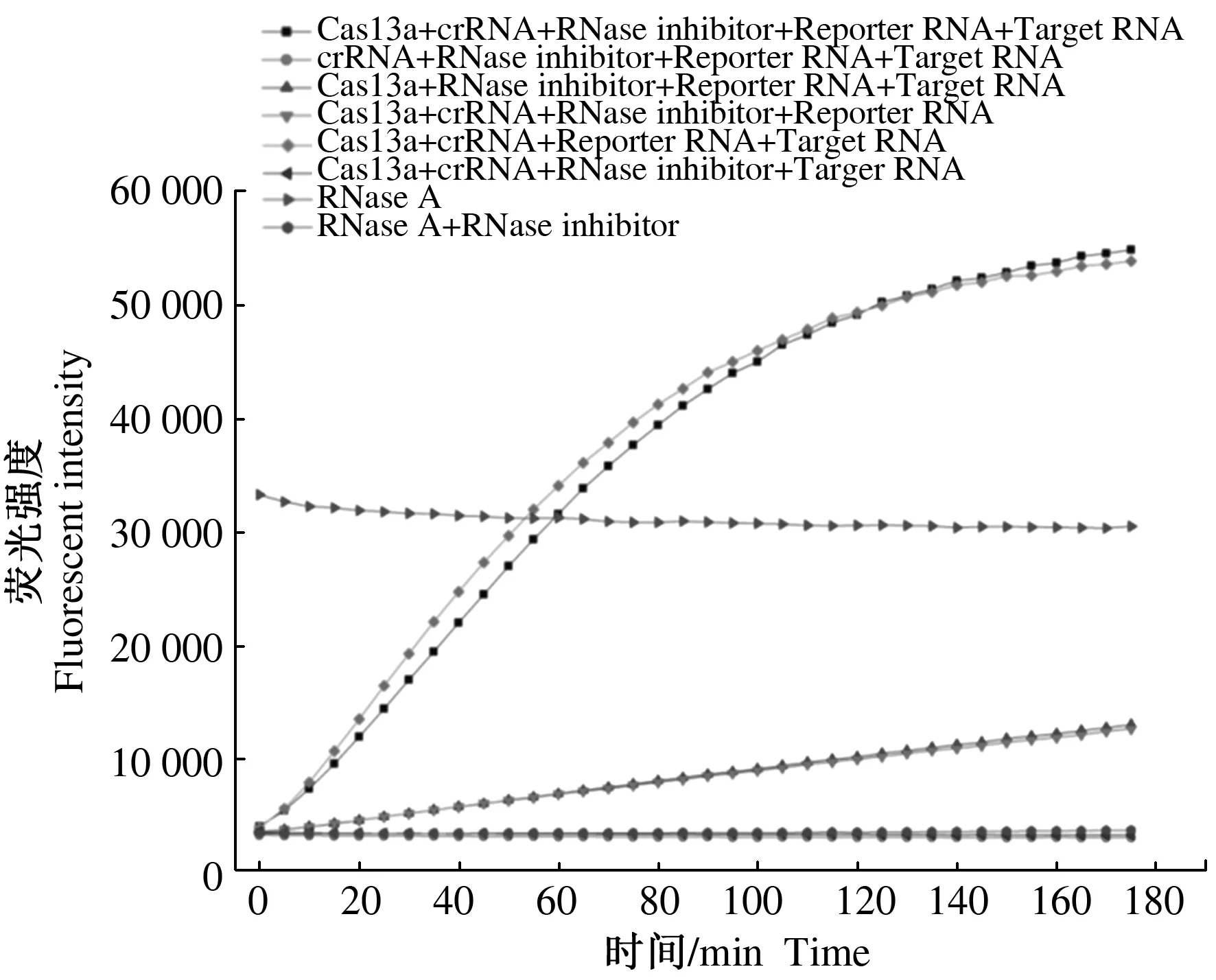
图6 LwaCas13a 重组蛋白酶活性的动力学测定Fig.6 Kinetics of LwaCas13a RNase activity
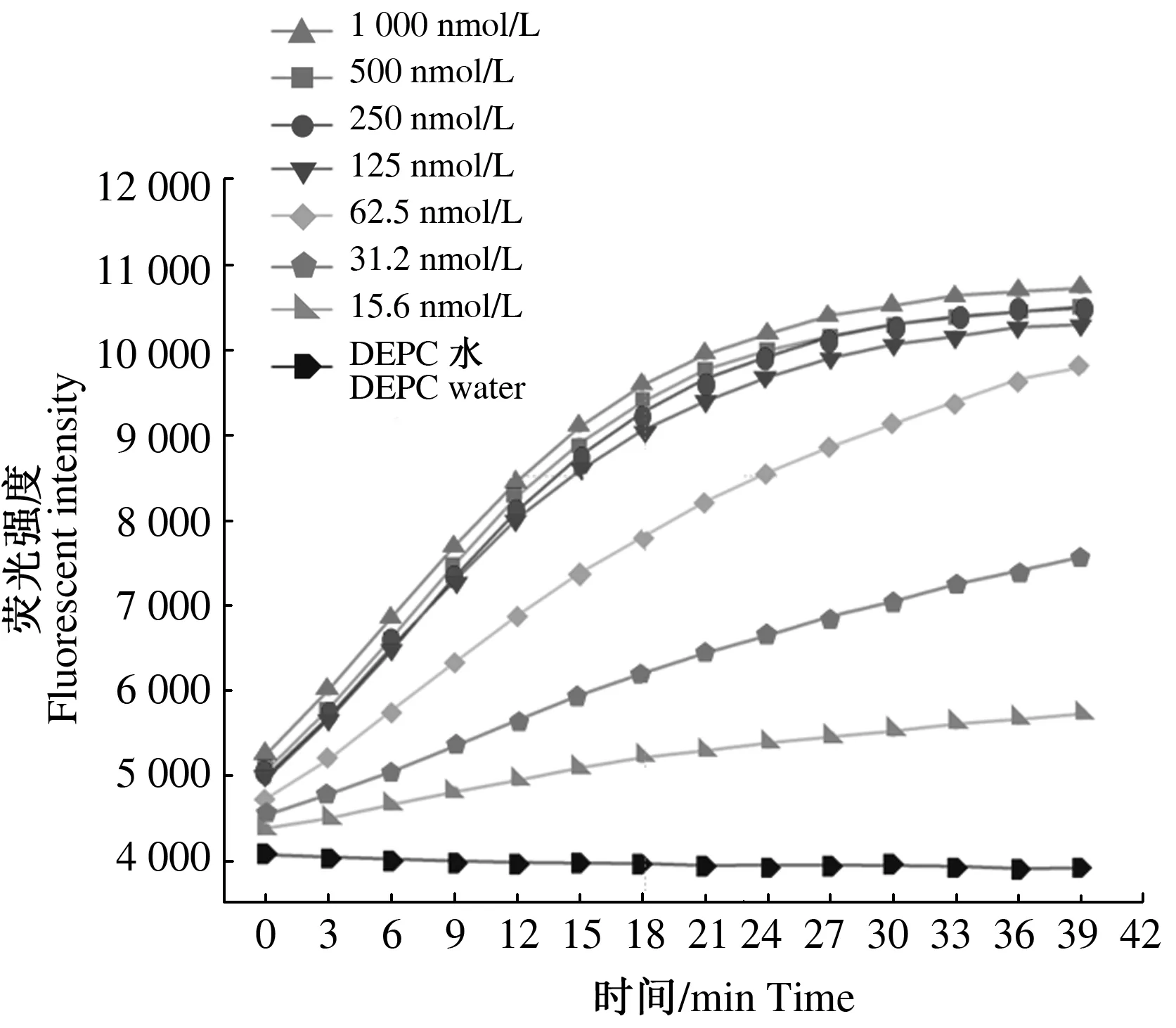
图7 LwaCas13a 重组蛋白检测RNA靶标敏感性Fig.7 Detection limit of LwaCas13a in detecting RNA target
3 结论与讨论
LwaCas13a作为CRISPR/Cas家族成员,具有良好的核酸识别特异性,可识别2个以上碱基突变的差异,非常适用于具有鉴别诊断需求的实际应用。如猪瘟强毒株与兔化弱毒疫苗株的感染与免疫鉴别诊断、细菌的16S DNA或真菌的18S DNA菌种鉴定以及病毒的基因分型鉴定等。由于该方法对临床样本检测敏感性较低,可进一步结合核酸扩增技术提高检测的敏感性[18-21]。由于LwaCas13a连带剪切酶活性检测方法是在37 ℃等温条件下进行,对温控仪器要求较低,与传统的PCR扩增技术相比,更适合与近年来快速发展的等温扩增技术相结合(重组酶聚合酶等温扩增或环介导等温扩增反应等),实现核酸诊断的便捷检测[22-24]。此外,本研究结合胶体金试纸技术,可以将结果由荧光检测变成可视化检测,进一步脱离对大型仪器设备的依赖,具有临床检查的潜力。
本研究对LwaCas13a重组蛋白进行了原核可溶性表达,并通过镍柱亲和层析法对其进行了纯化,建立了LwaCas13a连带剪切酶活性的检测方法,为CRISPR/Cas13a新型诊断技术在重大动物疫病中的应用奠定基础。
通过对CRISPR/Cas13a新型核酸诊断技术方法的建立,利用Cas家族蛋白对核酸识别的高度特异性以及LwaCas13a特有的连带剪切酶活性,在我国重大动物疫病鉴别及多联诊断方面具有重要的应用前景。
