基于网络药理学探讨溪黄草黄酮类成分对酒精性肝病的作用机制
2021-05-11钟景斌刘文彬
钟景斌,刘文彬,王 晖*
1广东药科大学中药学院;2广东药科大学生命科学与生物制药学院 广东省生物活性药物研究重点实验室,广州 510006
ALD是指长期饮酒诱发肝脏出现损伤性的疾病,其以酒精性脂肪肝为表现,可转化为酒精性肝炎、肝纤维化,进一步可恶化为肝硬化,甚至演变为晚期的肝细胞癌等系列疾病[1]。逐年增加的酒精消费量与我国慢性肝病中ALD的发病率呈正比关系,而大多数患者对ALD认识不够,忽略ALD的危害性,其并发症和死亡率较高,亟需成为公众关注的健康问题之一。现有研究表明,酒精介导的肝损伤、肝脏脂肪变性、氧化应激、肠道菌群介导免疫炎症、细胞自噬等方面参与ALD发病机制[2],但其发病机制复杂,尚未完全阐述清楚。目前暂无确切治疗ALD的方法及药物,因此,寻找、开发治疗ALD药物成为研究的焦点,而中药在降低ALD的肝功能异常指标与改善患者临床症状中具有广阔治疗前景。
溪黄草为唇形科香茶菜属植物线纹香茶菜Isodonlophanthoides(Buch.-Ham.ex D.Don)H.Hara干燥地上部分,其变种狭基线纹香茶菜、纤花线纹香茶菜或同属植物溪黄草亦作为溪黄草的来源。溪黄草有清热利湿、退黄、凉血散瘀功效,治疗湿热黄疸、泻痢、急性黄疸型肝炎、急性胆囊炎等疾病。其成分复杂,二萜类、三萜类、黄酮类等成分是其发挥抗肿瘤、保肝、利胆、抗氧化、抗菌抗炎、清除自由基等药理作用的物质基础[3]。目前,溪黄草的研究主要集中在其水提物对肝损伤、肝纤维化、肝癌等作用研究[4,5],而对其药效成分、分子靶点等相关方面有待深入研究。近年来,黄酮类成分在防治酒精性肝损伤中取得一定进展,溪黄草黄酮能通过增强抗氧化应激能力对酒精导致急性肝损伤有预防保护作用,显著减轻肝脏病理损伤,降低脂质过氧化指标[6],但缺乏溪黄草黄酮对ALD的分子靶点、通路调控机制的深入研究,为此,本文借助网络药理学与分子对接技术探讨溪黄草黄酮类成分治疗ALD的作用机理,为其临床应用提供理论依据。
1 材料与方法
1.1 溪黄草黄酮类成分获取
通过CNKI数据库、PubMed数据库以溪黄草或线纹香茶菜为关键词进行检索,通过文献查对、收集来源于线纹香茶菜植物的溪黄草黄酮类成分,再利用PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获取每个化合物的分子式、CAS号、下载2D结构的SDF文件;进而通过TCMSP数据库(http://tcmspw.com/tcmsp.php)检索成分名称、查对化学结构式,获取溪黄草黄酮类成分的口服利用度(oral bioavailability,OB)、类药性(drug-like,DL)信息,建立溪黄草黄酮类化合物信息数据库。
1.2 溪黄草黄酮类成分靶点反向预测与筛选
将“1.1”项下得到的每个成分的SDF格式文件导入到PharmMapper数据库(http://lilab-ecust.cn/pharmmapper/)获得溪黄草黄酮类成分潜在的靶点。将获得的靶点对应的PDB ID号通过UniProt数据库(https://www.uniprot.org/uploadlists/)中的Retrieve/ID mapping的转化功能,限定物种为人,排除非人源的靶点,经上述数据库转化操作,获得校正后的基因名称。
1.3 溪黄草黄酮类成分与ALD的交集靶点获取
在Genecard数据库(https://www.genecards.org/)中以“alcoholic liver disease”为关键词进行检索,获取ALD疾病的相关靶点。在该数据库中,Score值越高表示该靶点与疾病相关程度越高。然后,通过Venny2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)将“1.2”项下获得的溪黄草黄酮类成分预测靶点经去重后与ALD疾病靶点取交集靶点。
1.4 构建靶点的PPI网络
将“1.3”项的交集靶点导入STRING数据库中“multiple proteins”选项中,在“organism”处选择物种来源为人,交互作用大于0.4的靶点,并隐藏游离的节点,运行后即可得到溪黄草黄酮类成分对ALD作用的PPI网络。度值越大代表靶点在PPI网络中越处于核心作用,下载STRING数据库的生成有关PPI网络信息的“TSV”文件,将其导入Cytoscape3.7.0软件,通过Network Analyzer功能进行分析网络中节点的度值,筛选核心靶点。
1.5 GO与KEGG富集分析
通过DAVID数据库(https://david.ncifcrf.gov/summary.jsp)将交集靶点导入基因列表中,选择“OFFICIAL-GENE-SYMBOL”,选定物种为“Homo sapiens”,获取数据对GO功能和KEGG通路进行分析,设置P<0.05,根据靶点富集程度进行降序,筛选排名靠前的生物过程和通路,并对数据进行可视化。
1.6 成分-靶点-通路网络的构建
将“1.1”项的溪黄草黄酮类成分、“1.3”项的交集靶点、“1.5”项的通路导入Cytoscape3.7.0软件构建溪黄草黄酮类成分对ALD的作用成分-靶点-通路网络图。利用Network Analyzer功能进行拓扑分析,根据度值大小筛选排名前5位成分进行分子对接验证[7]。
1.7 分子对接验证
在TCMSP数据库中下载“1.6”项的度值前5位的黄酮类成分的mol.2文件,建立活性成分配体库。利用AutoDockTools(1.5.6)对每个成分进行加氢、计算电荷、加Root后保存“pdbqt”格式文件。在PDB数据库(https://www.rcsb.org/)中下载“1.4”项的核心靶点的度值排名靠前的靶点信息,下载格式为pdb格式,作为核心靶点受体库。利用PyMol(2.3.4)将靶点蛋白去除配体、水分子后导入AutoDockTools(1.5.6)进行加氢、计算电荷,并保存为“pdbqt”格式文件。由蛋白的配体所处的结构位置为活性口袋,并利用AutoDock Tools确定对接盒子的大小和中心进行分子对接处理,并通过PyMol(2.3.4)进行受体配体的相互作用模式分析。当结合能<0可以判断受体配体二者之间自发结合,结合能越低,活性成分越容易与受体结合。
2 结果
2.1 溪黄草黄酮类成分收集
通过检索文献[8,9]获得12种来源于线纹香茶菜中的溪黄草黄酮类成分,通过PubChem数据库查找,匹对成分的结构信息,在TCMSP数据库中获取每个成分的OB、DL值,如表1所示。带“*”号的成分由于OB值较低,但部分成分其生物活性较强,药理作用明确,所以纳入构建溪黄草黄酮类成分的数据库。如芦丁具有多种药理活性,研究证实,其通过减低TGF-β1、IL-1β、结缔组织生长因子和胶原蛋白的表达具有抗肝纤维化,且表明其通过抑制NF-κB活化、促炎细胞因子及Nrf2的释放、减弱由胆管结扎(BDL)诱导肝损伤的氧化应激[10]。
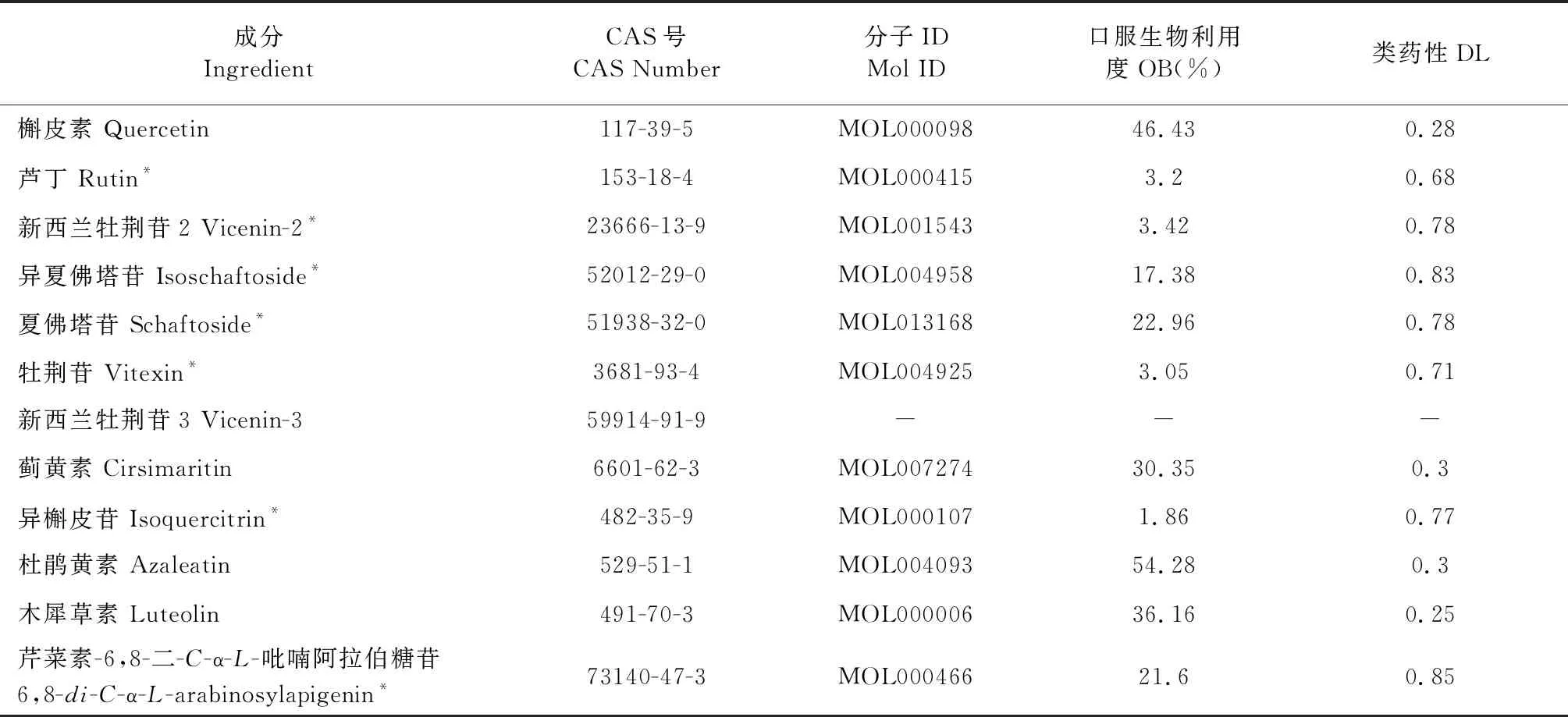
表1 溪黄草中12个黄酮类成分信息
2.2 溪黄草黄酮类成分靶点
通过PharmMapper、Uniprot数据库获取成分靶点信息,经删除无效与重复靶点,共获取溪黄草黄酮类成分作用靶点382个。
2.3 交集靶点的收集
通过Genecard数据库的检索,根据相关评分(relevance score)设置筛选条件为≥5,筛选出4 267个与酒精性肝病相关的靶点。通过韦恩图Venny2.1.0绘制获得172个交集靶点,为溪黄草黄酮类成分治疗酒精性肝病潜在的靶点(见图1)。
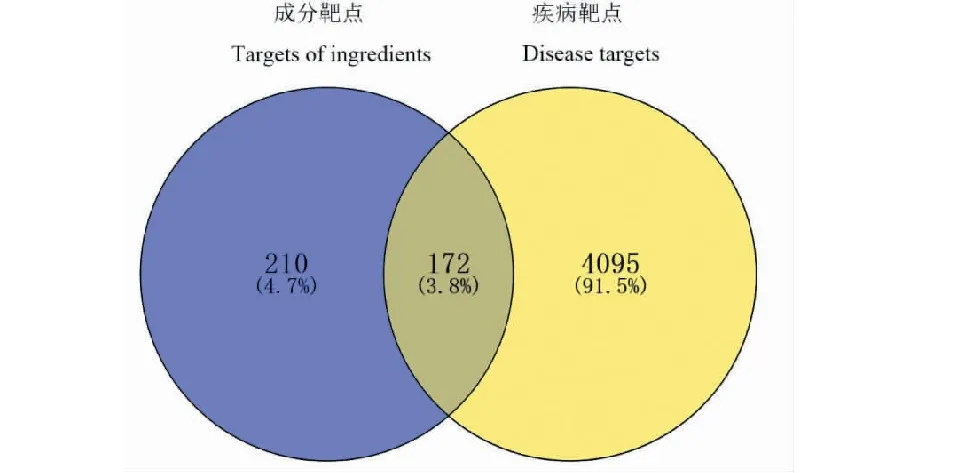
图1 溪黄草黄酮类成分靶点与酒精性肝病靶点的交集靶点
2.4 靶点的PPI网络构建与分析
将172个交集靶点导入STRING数据库,得到成分与疾病靶点的PPI网络,PPI网络中显示节点168个,边942条,平均节点度值为11.2。以节点度值为评价参数,设置度值≥23为筛选条件,筛选出24个核心靶点,节点度值(degree)越大说明其在PPI网络中越重要,可能在发挥生物学功能中起着重要的作用。使用Cytoscape3.7.0对STRING数据库获得的数据进行分析,节点越大,相应的度值越大,颜色越红。并通过Cytoscape3.7.0中的Cytohubba插件筛选出核心靶点。如图3所示。选取度值排名靠前的核心靶点:HSP90AA1(degree:50)、VEGFA(degree:49)、CCND1(degree:48)作为分子对接验证的靶点。

图2 蛋白质相互作用网络
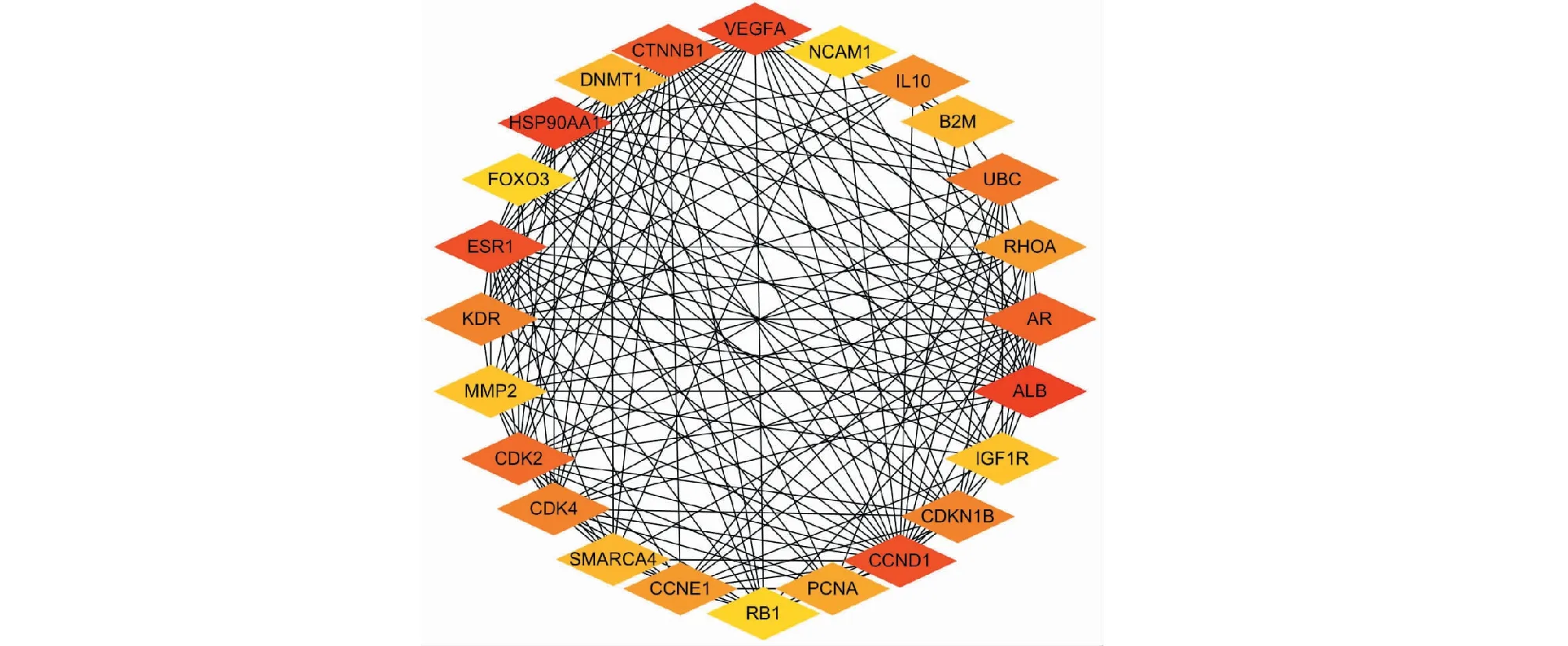
图3 24个核心靶点的相互作用网络
2.5 GO与KEGG富集分析
由GO富集结果得知,在P<0.05条件下,得到生物学功能条目共有92条,其中涉及生物过程(biological process,BP)为52条,溪黄草黄酮类成分主要参与包括RNA、DNA转录的正负调控、细胞凋亡正负调节,血管内皮生长因子受体信号,Notch信号通路、NF-κB调节,Wnt信号通路的调节、STAT3蛋白的丝氨酸磷酸化、DNA损伤的内在凋亡、细胞周期调节、脂质稳态等生物学过程,表明溪黄草黄酮类成分作用于ALD主要参与涉及细胞周期调控、氧化应激、脂质代谢、炎症途径等反应。细胞成分(cellular component,CC)富集了24条,主要参与胞外体、细胞表面、焦点粘附、转录因子复合体、Toll样受体1-Toll样受体2蛋白复合物等。分子功能(molecular function,MF)共富集16条目,涉及三磷酸腺苷结合、锌离子结合、染色质结合、转录调节区DNA结合、金属内肽酶活性、类固醇结合、受损的DNA结合、氧化还原酶活性等重要生物功能(见图4,BP、CC、MF根据富集基因数量只展示前10的条目)。由KEGG富集分析得到27条通路(P<0.05),溪黄草黄酮类成分主要参与多条癌症通路、PI3K/Akt信号通路、癌症中的蛋白多糖、病毒致癌作用、乙型肝炎、FoxO信号通路、p53信号通路、细胞周期、PPAR信号通路、丙氨酸/天冬氨酸和谷氨酸代谢等重要通路发挥作用。如图5所示对前20条重要通路进行可视化处理。
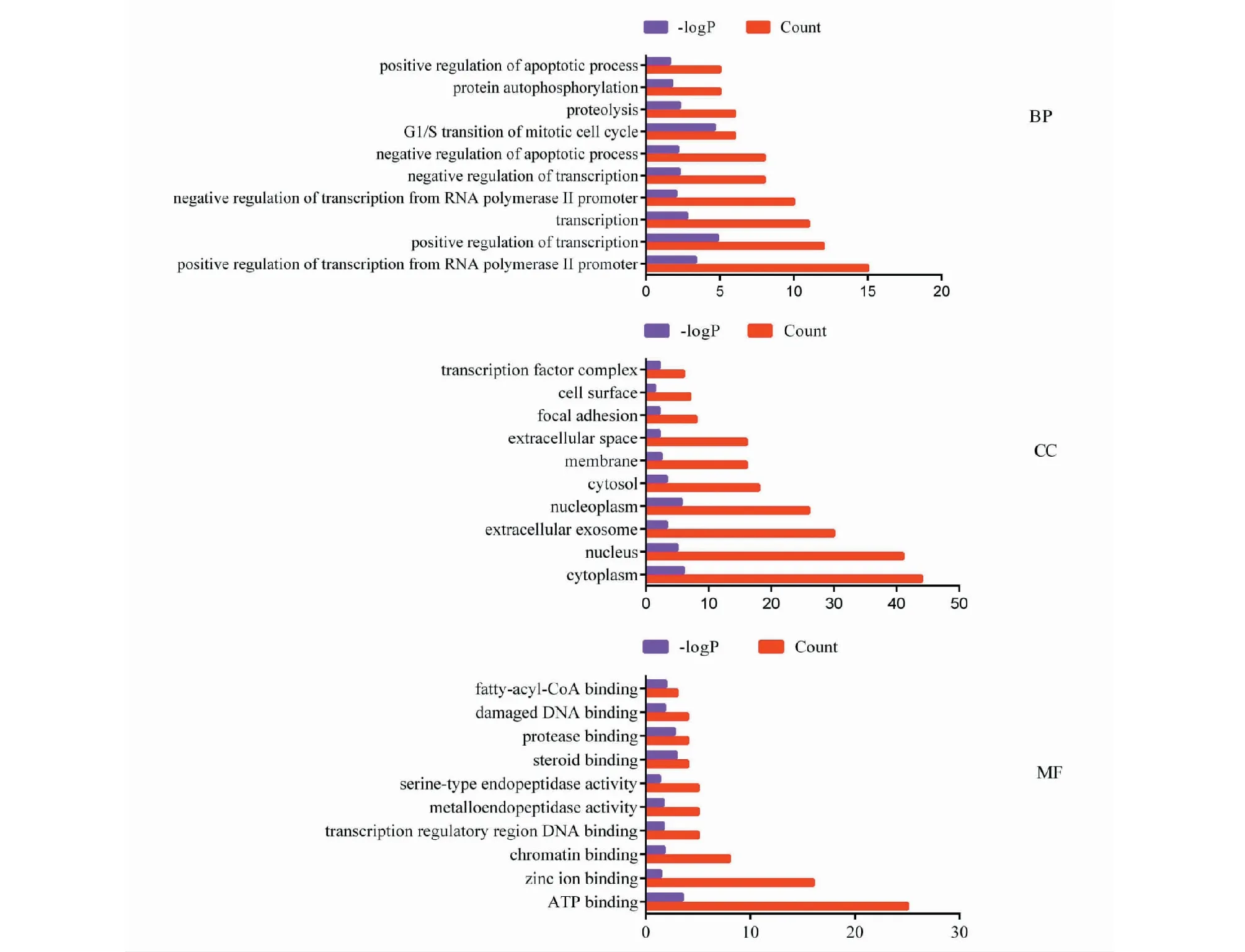
图4 关键靶点的GO富集分析
2.6 成分-靶点-通路网络的构建结果
将12种溪黄草黄酮类成分,172个交集靶点,27条重要通路使用Cytoscape3.7.0构建溪黄草黄酮类成分-靶点-通路网络(见图6)。该网络图包含211个节点,634条边,其中12个黄色菱形节点代表了溪黄草黄酮类成分,172个红色倒三角形代表了交集靶点,27个深蓝色三角形代表重要的通路,边表示成分、靶点、通路三者之间联络关系。根据度值的大小,筛选出前5个成分作分子对接验证,分别为vitexin(degree:43)、quercetin(degree:41)、isoschaftoside(degree:40)、vicenin 2(degree:38)、azaleatin(degree:36)。
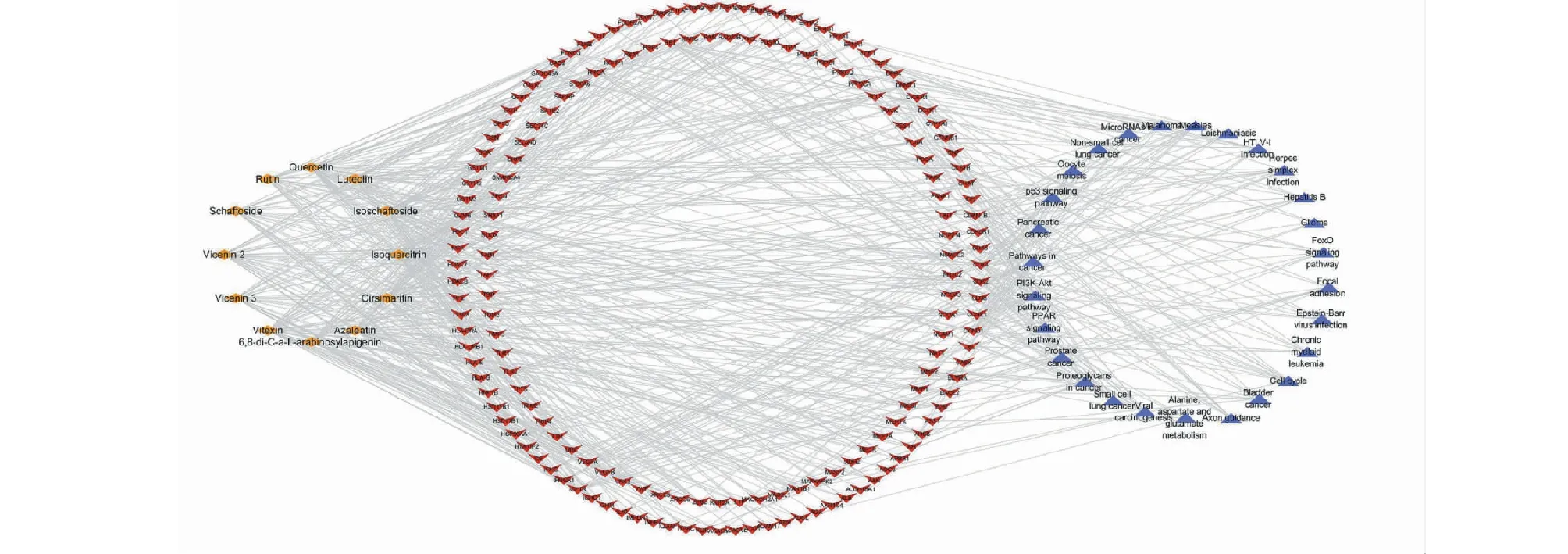
图6 溪黄草黄酮类成分-靶点-通路网络
2.7 分子对接验证分析
配体与受体在结合时,构象越稳定其能量越低,相互作用的可能性越大。以结合能≤-5 kJ/mol为判断相互作用能力的依据。如表2显示,5个溪黄草黄酮类成分的结合能均<0,说明其能与靶点产生自发性结合。其中,在HSP90AA1靶点中,5个成分全部与靶点产生较好的结合特性,而在VEGFA靶点中,只有quercetin与其产生相互作用能力。在CCND1靶点中,quercetin与azaleatin两种成分的结合能为-5 kJ/mol,与其产生较好结合效应。从总体上进行推测,分子对接显示溪黄草黄酮类成分与核心靶点有较好的结合活性。利用PyMol(2.3.4)将5个配体成分中结合能最低的成分与3个靶点绘制成分与靶点对接模式图。Isoschaftoside-HSP90AA1的结合位点为Asp-93、Leu-107、Tyr-139氨基酸残基,quercetin-VEGFA通过Glu-23、Gly-52、Leu-25氨基酸残基发挥作用效应,quercetin-CCND1的结合位点为Glu-115、Lys-72、Gln-71、Lys-123、Thr-120氨基酸残基(见图7)。
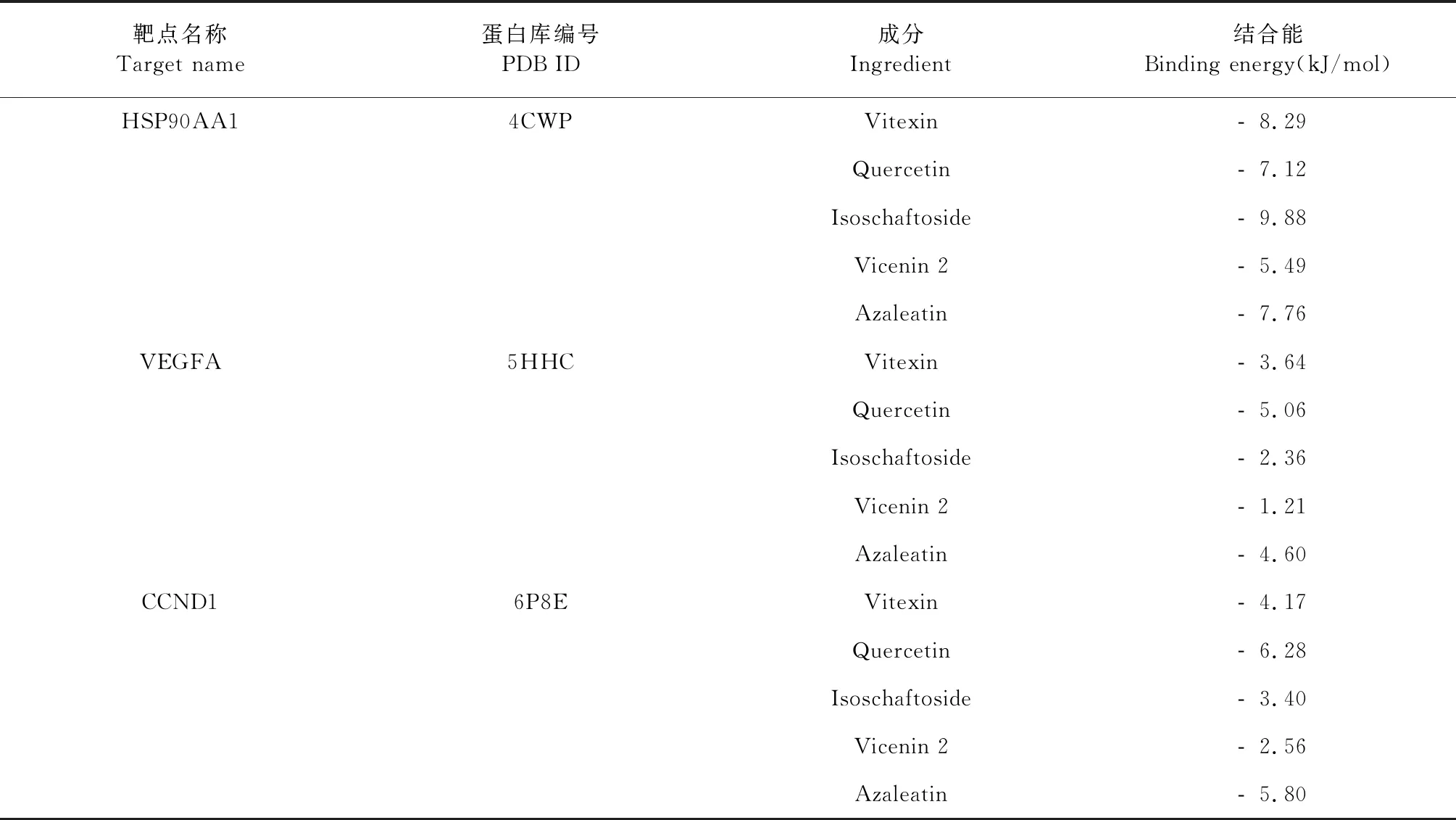
表2 部分成分与靶点分子对接结果
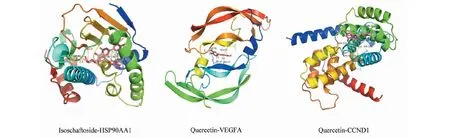
图7 成分-靶点对接相互作用模式
3 讨论
通过对溪黄草黄酮类成分分析,从构建的网络图中筛选度值排名前5的成分。其中,牡荆苷为黄酮碳苷类成分,可调控凋亡信号,最近研究显示[11],牡荆苷对酒精诱导肝损伤有保护作用,可能与调节Sirt1/p53介导线粒体凋亡途径减少肝细胞凋亡、降低氧化应激和炎症水平有关。槲皮素能降低长期摄入酒精导致血清中ALT、AST、TG含量升高,通过降低脂蛋白2(PLIN2)水平,激活AMPK信号促进脂肪吞噬,表明其对酒精导致的肝脂肪变性有保护作用[12]。由于肝星状细胞的活化是引起肝纤维化的原因,其通过调节TGF-β1/Smads和PI3K/Akt通路之间的相互作用来减弱肝星状细胞的活化,并减少自噬而缓解肝纤维化加重的趋势[13]。异夏佛塔苷能显著抑制非小细胞肺癌A549细胞存活率,其抗肿瘤机制与调控细胞凋亡有关[14]。新西兰牡荆苷2能降低肝损伤标志物ALT、AST水平和炎症因子的表达,抑制MAPK激活、调控TLR信号通路减轻由LPS诱导肝损伤引起的炎症反应,表明其具有保肝作用[15]。因此,可推测上述的溪黄草黄酮中核心成分通过调控细胞凋亡、降低氧化应激、抗肝纤维化、降低炎症水平等方面发挥干预ALD的潜在作用。
由核心靶点网络图可知,溪黄草黄酮类成分作用于ALD的靶点有24个核心靶点,并对HSP90AA1、VEGFA、CCND1、IL10、FOXO3等度值较大的靶点进行文献分析。热休克蛋白90AA1(HSP90AA1)转导能促进癌症相关成纤维细胞慢性炎症的信号,通过激活NF-κB和STAT3转录,分泌炎症细胞因子诱导炎症反应。而炎症反应能加速ALD的发展,在酒精性肝硬化中HSP90AA1诱导与NLRP3炎性小体呈正相关,抑制HSP90AA1进而降低NLRP3炎性体活性使炎症细胞因子分泌减少,减轻炎症反应[16]。血管内皮生长因子A(VEGFA)能诱导内皮细胞增殖、诱导新血管生成,其与肝细胞癌,尤其是酒精性肝硬化的生理病理有关。酒精摄入会增加肝脏氧气的消耗,易诱导缺氧诱导因子(HIFs)的活化,促进VEGFA转录,引起ALD中肝纤维化的发生[17]。细胞周期蛋白D1(CCND1)主要功能为促进细胞增殖,但其过度表达可致细胞增殖失控,促进恶性肿瘤细胞的侵袭和转移。过表达的CCND1与肝细胞癌相关,而在体外研究表明槲皮素下调CCND1表达以干扰HepG2细胞的细胞周期和增殖[18]。另外,IL-10是在免疫调节和炎症中发挥多效作用的细胞因子,可抑制ALD中炎症细胞因子LPS、TNF-α、IL-6的产生,通过减少肝脏炎症和脂肪变性发生而保护肝脏[19]。叉形头转录因子O亚型3(FOXO3)广泛参与细胞自噬、凋亡、氧化应激反应等生物学过程,其能诱导凋亡基因的表达,在肝细胞癌中表现出抗肿瘤特性[20]。综上,预测的核心靶点参与了ALD的发病机制,推测溪黄草黄酮类成分可通过作用这些核心靶点发挥潜在的治疗机制。
从KEGG富集通路中可知溪黄草黄酮类成分治疗ALD可能通过PI3K/Akt信号通路、FoxO信号通路、p53信号通路等关键通路发挥作用。其中,PI3K/Akt信号通路通过激活下游相应的效应分子参与细胞增殖、凋亡、葡萄糖代谢等生理活动发挥作用。另有研究证实,通过抑制PI3K/Akt信号传导,降低氧化应激和炎症因子水平,对活化的肝星状细胞有抑制作用,进而阻止肝纤维化的发展[21]。在ALD发病机制中,氧化应激与细胞凋亡被认为是其重要的机制之一,而细胞处于氧化应激状态时,可激活PI3K/Akt信号通路及相关响应因子。推测PI3K/Akt通路为ALD发病机制的关键信号通路。FOXO蛋白是生长因子和应激调节的转录因子,作为氧化应激介体参与氧化应激过程,在细胞DNA损伤和修复、调控代谢等过程具有重要的作用。p53为肿瘤抑制因子,其调控细胞增殖、衰老、细胞凋亡等代谢活动,介导癌症、糖尿病、肝病等疾病的代谢过程。类黄酮物质黄腐酚通过调控NF-κB/p53信号通路抑制人肝癌HepG2的生长、凋亡[22]。上述三条通路在治疗ALD中主要参与了氧化应激过程、炎症反应、细胞自噬、抗细胞纤维化等过程,可进一步推测溪黄草黄酮类成分调节这些关键通路发挥治疗ALD作用机理。另外,结合分子对接的技术,初步模拟成分与靶点之间相互作用关系,结合能的大小直接反映预测结果的可靠性。
本研究通过网络药理学和分子对接相结合的方法,确定溪黄草中黄酮类成分具体药效物质,从多个方面探讨了黄酮类成分治疗ALD的分子靶点、调控通路的作用机制,体现了溪黄草黄酮类成分具有多靶点多途径的作用特点,且其预测的结果与文献报道相符,为后续深入研究溪黄草黄酮防治ALD的作用机制提供理论依据。
