美洲大蠊多糖的水解工艺及其抗氧化活性研究
2021-05-11肖培云杨永寿
顾 婷,和 英,肖培云,杨永寿
大理大学药学院,大理 671000
美洲大蠊(PeriplanetaamericanaL.)是蜚蠊属中最大的昆虫之一[1]。蜚蠊药用价值在《神农本草经》和明代的《本草纲目》早有记载[2]。20世纪80年代以来,以李树楠教授为主的科研人员致力于美洲大蠊的药用研究,将人工饲养的美洲大蠊乙醇提取物内服或者外用,用于治疗溃疡、癌症等[3]。研究发现,美洲大蠊的化学成分包括:蛋白质、氨基酸、肽类、糖类、脂肪酸、信息素及其他,有抗肿瘤、抗肝纤维化、抑菌、抗病毒、抗氧化等生物活性[4]。
糖类物质是地球上数量最多的有机化合物,占总生物量的3/4,而多糖类物质约占其中总量的90%[5]。多糖的生物活性主要包括抗肿瘤、降血糖、抗衰老、增强骨髓造血机能、调节免疫等,且基本无毒副作用,因而受到人们的广泛关注,在医药领域极具应用前景[6]。其活性与其相对分子质量、化学组成、苷键构型、连接方式和空间构型有关[7]。为了解美洲大蠊多糖的特性,可以采用水解反应,分析单糖组成及含量的变化,为美洲大蠊多糖的质量控制提供依据。实验以美洲大蠊多糖为实验对象,在单因素实验的基础上,以高效液相色谱图中单糖总峰面积为指标,利用响应面实验,优化美洲大蠊多糖的水解工艺以获得单糖含量最高的工艺,此外,对美洲大蠊多糖的抗氧化活性进行了研究,为美洲大蠊多糖的结构鉴定和后续开发利用提供参考。
1 仪器与材料
1.1 仪器
Agilent 1260高效液相色谱仪(美国安捷伦公司);TU-1901双光束紫外分光光度计(北京普析通用仪器有限责任公司);AL240-IC型分析天平(梅特勒-托利多仪器有限公司);HYQ-3110涡旋混匀器(美国精骐有限公司)。
1.2 材料
美洲大蠊药材(云南省大理州弥渡县美蠊养殖基地)经大理大学云南省昆虫生物医药研发重点实验室杨自忠教授鉴定为昆虫纲蜚蠊科昆虫美洲大蠊PeriplanetaamericanaL.;葡萄糖(Glu,批号171206)、甘露糖(Man,批号170921)、半乳糖(Gal,批号171206)、鼠李糖(Rha,批号171024)、岩藻糖(Fuc,批号170831)、木糖(Xyl,批号170912)、盐酸氨基葡萄糖(Gah,批号171210)、阿拉伯糖(Ara,批号171219),均购于上海融禾医药科技有限公司,以上单糖纯度均﹥98%。
2 实验方法
2.1 美洲大蠊多糖提取
称取500 g美洲大蠊药材,料液比1∶10,60 ℃回流提取2次,2 h/次,4 000 rpm,离心15 min,取上清液,石油醚脱脂,60 ℃浓缩。加入4倍体积的95%乙醇溶液醇沉24 h,离心,取沉淀,加水溶解,加入1/4体积的Sevage试剂(氯仿∶正丁醇=4∶1),震荡10 min,离心,取水相,浓缩,冷冻干燥后即得美洲大蠊多糖。
2.2 PMP-HPLC衍生化法测定美洲大蠊多糖的单糖组成
2.2.1 美洲大蠊多糖水解液的配制
精密称取美洲大蠊多糖20 mg,置安剖瓶中,1 mL蒸馏水溶解,加2 mol/L三氟乙酸(TFA),充氮,熔封,置于烘箱中水解。将安剖瓶中水解液转移至旋蒸瓶中,加少量甲醇洗涤安剖瓶,洗液转移至旋蒸瓶中,50 ℃旋蒸至干,重复加甲醇,蒸干至无酸味。依次精加1、0.5、0.5 mL水超声溶解样品,并将其转移至EP管中,离心即得美洲大蠊多糖水解液。
2.2.2 混合单糖对照品溶液的配制
精密称取葡萄糖、甘露糖、半乳糖、鼠李糖、岩藻糖、木糖、盐酸氨基葡萄糖、阿拉伯糖各约1 mg分别置EP管中,精加1 mL水溶解,即得各单糖对照品溶液。移液枪吸取葡萄糖50 μL、甘露糖30 μL、半乳糖40 μL、鼠李糖20 μL、岩藻糖10 μL、木糖10 μL、盐酸氨基葡萄糖30 μL、阿拉伯糖15 μL至EP管中即得混合单糖对照品溶液。
2.2.3 衍生化反应
精密吸取混合单糖对照品溶液100 μL和美洲大蠊多糖水解液200 μL,分别加入0.5 mol/L PMP甲醇溶液与0.3 mol/L氢氧化钠溶液各200 μL,混匀,70 ℃水浴反应100 min,冰浴冷却,加250 μL 0.3 mol/L的盐酸溶液,混匀。氯仿洗涤3次,每次2 mL,离心,取上清,0.45 μm微孔滤膜过滤,即得单糖标准品及多糖PMP衍生物。
2.2.4 HPLC条件
色谱柱:ZORBAX Eclipse XDB-C18柱(4.6 mm×250 mm,5 μm);柱温:35 ℃;流速:0.8 mL/min;检测波长:250 nm;流动相:A:0.025 mol/L磷酸盐缓冲液(pH 6.86),B:乙腈。梯度洗脱条件(以B的比例记录):0~20 min,16.5→17%;20~35 min,17→22%;进样量:10 μL。
2.3 单因素实验(n=3)
2.3.1 TFA用量考察
精密称取美洲大蠊多糖5份,20 mg/份,置安剖瓶中,1 mL蒸馏水溶解,分别加入2、3、4、5、6 mL TFA,充氮,熔封。置于烘箱中,110 ℃水解8 h,后将安剖瓶中水解液转移至旋蒸瓶中,加少量甲醇洗涤安剖瓶,洗液转移至旋蒸瓶中,50 ℃旋蒸至干,重复加甲醇,蒸干至无酸味。依次精加1、0.5、0.5 mL水超声溶解样品,并将其转移至EP管中,精密吸取美洲大蠊多糖水解液200 μL,分别加入0.5 mol/L PMP甲醇溶液与0.3 mol/L氢氧化钠溶液各200 μL,混匀,70 ℃水浴反应100 min,冰浴冷却,加250 μL 0.3 mol/L的盐酸溶液,混匀。氯仿洗涤3次,每次2 mL,离心,取上清,0.45 μm微孔滤膜过滤,得多糖PMP衍生物,HPLC上机检测,计算单糖总峰面积。
2.3.2 水解时间考察
精密称取美洲大蠊粗多糖5份,20 mg/份,置安剖瓶中,1 mL蒸馏水溶解,加3 mL TFA,充氮,熔封。置于烘箱中,110 ℃分别水解0.5、1、1.5、2、4 h,然后将安剖瓶中水解液转移至旋蒸瓶中,后续操作与“2.3.1”项下一致,HPLC上机检测,计算单糖总峰面积。
2.3.3 水解温度考察
精密称取美洲大蠊粗多糖5份,20 mg/份,置安剖瓶中,1 mL蒸馏水溶解,加3 mL TFA,充氮,熔封。置于烘箱中,90、100、110、120、130 ℃水解1 h,然后将安剖瓶中水解液转移至旋蒸瓶中,后续操作与“2.3.1”项下一致,HPLC上机检测,计算单糖总峰面积。
2.4 响应面实验优化美洲大蠊的水解工艺
在单因素实验基础上,依据Design-Expert 8.0.6 Trial软件,运用Box-Behnken中心组合实验设计原理,以水解时间、水解温度、TFA用量三个因子为自变量,以美洲大蠊多糖水解出来的单糖总峰面积为响应值,对美洲大蠊多糖的水解条件进行优化,响应面实验的因素及水平见表1。

表1 响应面实验因素水平表
2.5 数据处理
使用统计软件Design-Expert 8.0.6进行响应面实验分析。
2.6 美洲大蠊多糖抗氧化活性研究
2.6.1 清除DPPH自由基能力的测定
参照Li等[8]和Feng等[9]方法,并做相应调整。精密称取7.87 mg DPPH,无水乙醇定容至100 mL(0.02 mmol/L)。分别精取2 mL不同浓度(0.01、0.02、0.04、0.06、0.08、0.10 mg/mL)的样品和维生素C(Vc)溶液,精加2 mL DPPH溶液,混合均匀,室温放置30 min后,4 000 rpm离心10 min,取上清液于517 nm处测吸光度。
其中,A0:2 mL无水乙醇+2 mL DPPH溶液的吸光度;A1:2 mL样品溶液+2 mL DPPH溶液的吸光度;A2:2 mL样品溶液+2 mL无水乙醇的吸光度。
2.6.2 总还原能力的测定
参照Wang等[10]方法,并做相应修改。在10 mL离心管中分别精取0.025 mol/L pH 6.86的磷酸盐缓冲液2 mL和不同浓度(0.04、0.08、0.12、0.16、0.20、0.24 mg/mL)的样品和Vc溶液2 mL,精加2 mL 1%铁氰化钾,混匀后于50 ℃反应20 min。取出后精加2 mL 10%三氯乙酸终止反应,4 000 rpm离心10 min。精取上清液2 mL,精加入2 mL蒸馏水和0.5 mL 0.1% FeCl3,混匀后静置10 min,在700 nm处检测吸光度。
还原能力=A1-A2
其中,A1:样品组吸光度;A2:样品本底吸光度(以等体积蒸馏水代替FeCl3溶液)。
2.6.3 羟自由基清除率的测定
参照Li等[11]方法,并做相应修改。精取9 mmol/L FeSO4、9 mmol/L水杨酸-乙醇溶液各1 mL,1 mL不同浓度(0.4、0.8、1.2、1.6、2.0 mg/mL)的样品及Vc溶液。精加1 mL 1% H2O2启动反应,37 ℃反应30 min,以蒸馏水为参比,在510 nm处测定各浓度样品的吸光度。
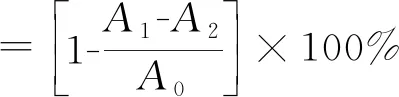
式中,A0:1 mL水杨酸+ 1 mL FeSO4+1 mL水+1 mL H2O2;A1:1 mL水杨酸+ 1 mL FeSO4+1 mL样品+1 mL H2O2;A2:1 mL水杨酸+ 1 mL FeSO4+1 mL样品+1 mL H2O。
2.6.4 ABTS自由基清除能力的测定
参考Zhang等[12]方法,略作修改。将等体积7.4 mmol/L的ABTS和2.6 mmol/L的过硫酸钾溶液混合,室温避光下静置12~16 h,制成ABTS储备液。用pH 7.4的磷酸缓冲液稀释储备液,使其在734 nm下的吸光度在(0.70±0.02),制成ABTS工作液。精取不同浓度(0.01、0.02、0.04、0.08、0.16、0.32 mg/mL)的多糖样品及Vc溶液各1 mL,精加ABTS工作液6 mL,混合均匀,室温下静置6 min,测定734 nm下的吸光度。
其中,A0:1 mL 蒸馏水+ 6 mL ABTS工作液的吸光度;A1:1 mL样品液+ 6 mL ABTS工作液的吸光度;A2:1 mL样品液+ 6 mL蒸馏水的吸光度。
3 结果
3.1 单因素实验结果
TFA用量考察结果:在水解温度为110 ℃,水解时间8 h的条件下,TFA用量为3 mL时,单糖总峰面积达到最大;水解时间考察结果:在TFA用量为3 mL,水解温度110 ℃条件下,水解1 h,单糖总峰面积达到最大;水解温度考察结果:在TFA用量为3 mL,水解时间1 h的条件下,水解温度为120 ℃时,单糖总峰面积达到最大。
3.2 美洲大蠊多糖水解的响应面结果
3.2.1 响应面设计及结果
根据单因素实验所得结果进行响应面设计,PMP-HPLC柱前衍生法测定各组单糖总峰面积,响应面实验设计及结果如表2所示。
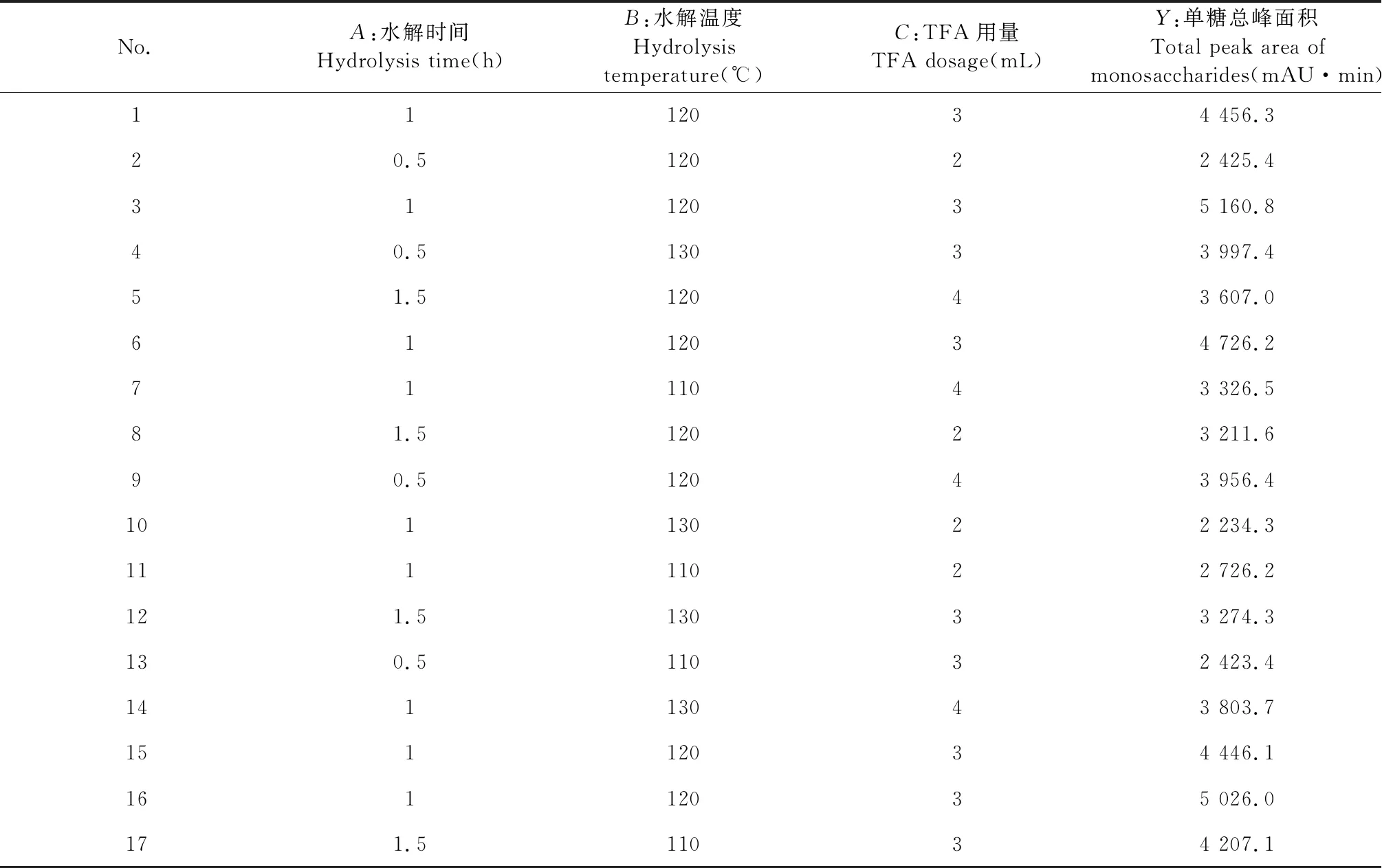
表2 响应面实验设计及结果(n=3)
利用Design-Expert 8.0.6软件对表2中所得的实验数据进行分析,以单糖总峰面积Y对自变量进行模型拟合,通过决定系数(R2)和方差分析对拟合模型进行评价,通过比较各拟合方程的拟合度,得到二次多项回归拟合方程:Y=4 763.08 + 187.18A+78.31B+ 512.01C-626.70AB-283.90AC+242.27BC-505.05A2-782.48B2-957.93C2。
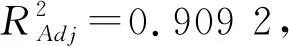
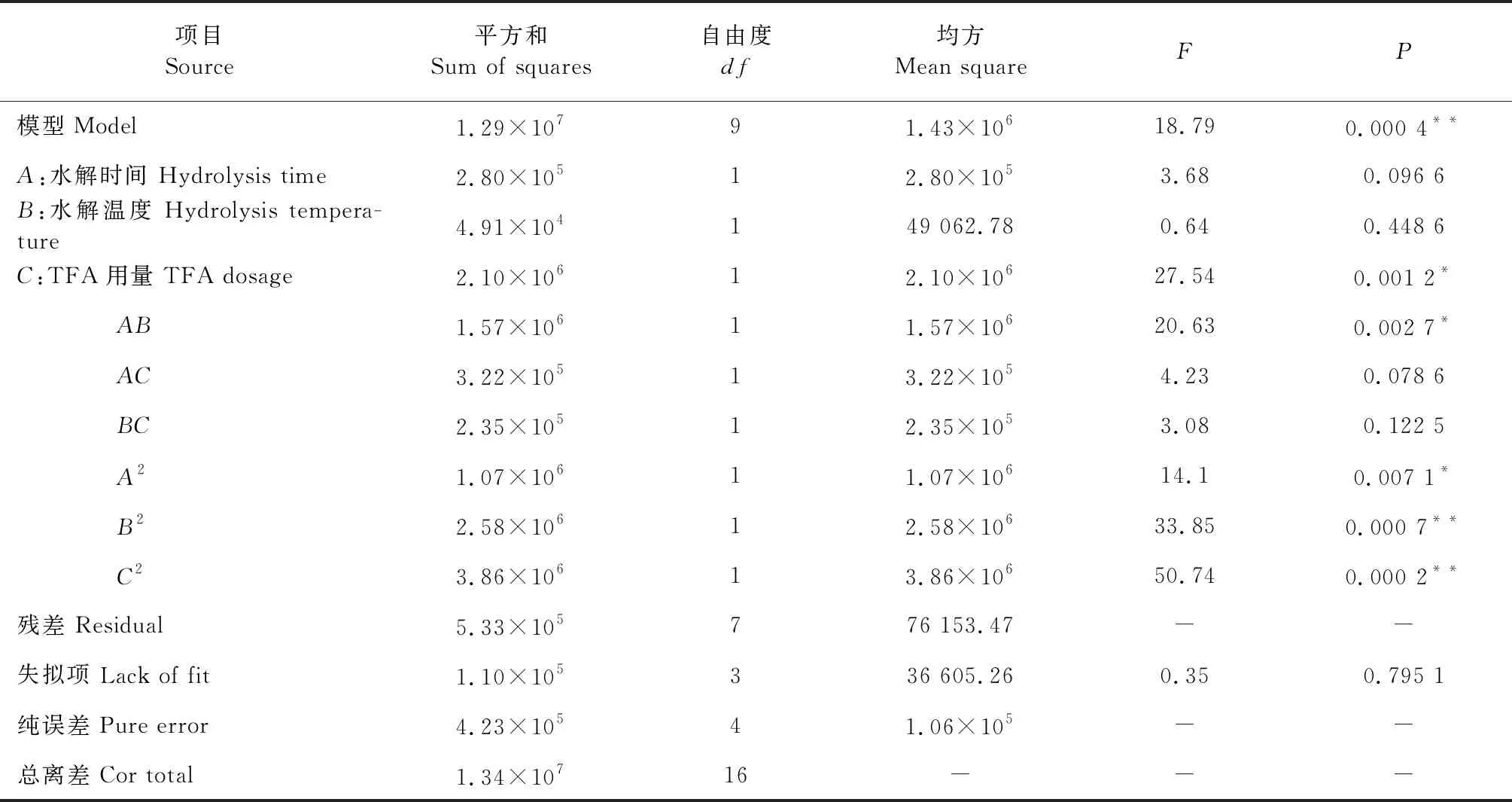
表3 回归模型的方差分析
3.2.2 响应面曲面分析
采用Design-Expert 8.0.6软件对实验结果进行分析,作出响应面的3D和等高线分析图,可以形象地反应出各自变量对总峰面积的影响。由图1~3可知,在所选范围内存在极值即响应面最高点,也是等值线最小椭圆的中心点,曲面坡度大,说明变化明显;响应面图能较直观反映出各因素与响应值的关系及各个因素间的交互作用。此外,等高线的形状可反映出交互效应的强弱,椭圆形表示两因素交互作用显著,而圆形则与之相反。由图还可知,水解时间与水解温度这两者之间存在显著的交互作用;而TFA用量和水解温度之间无显著交互作用;TFA用量和水解时间之间也无显著交互作用;交互作用强弱为:AB>AC>BC,与方差分析结果一致。

图1 水解时间和水解温度等高线(a)及对单糖总峰面积(b)影响的响应面
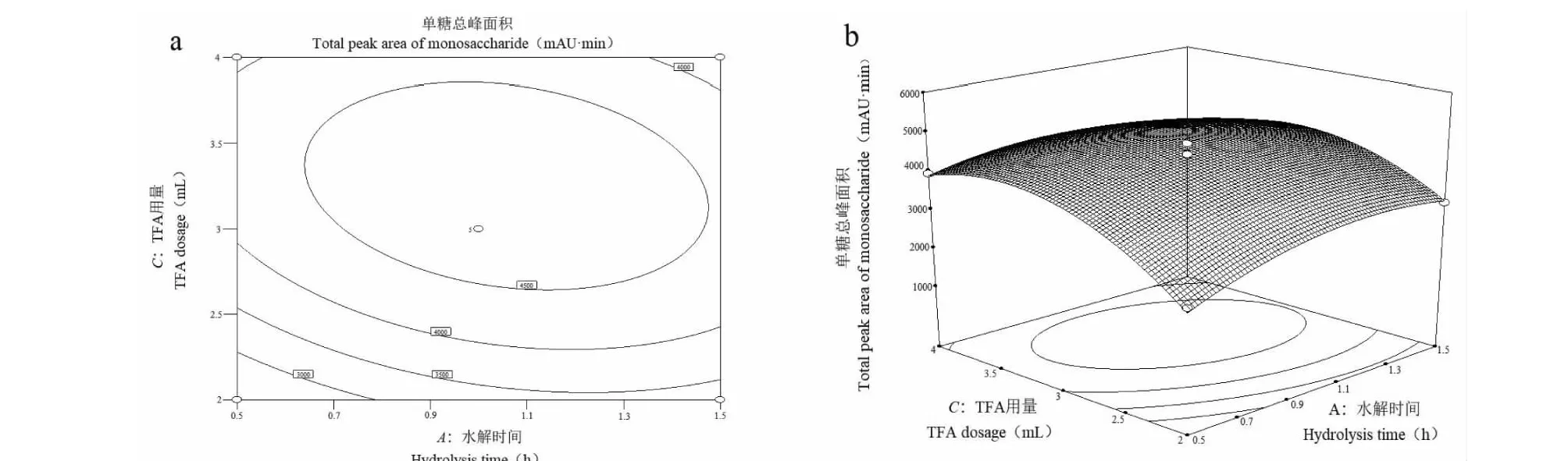
图2 TFA用量和水解时间等高线(a)及对单糖总峰面积影响的响应面图(b)

图3 TFA用量和水解温度等高线(a)及对单糖总峰面积影响的响应面图(b)
3.2.3 验证实验
响应面实验预测的最佳水解条件为:水解时间1.04 h,水解温度120.62 ℃,TFA用量3.26 mL,模型预测值为4 839.97。为了检验模型的可行性,考察预测结果的可靠性,在优化的工艺参数下进行验证试验,考虑到实际操作条件,实际校正后将最佳工艺参数修正为:水解时间1 h,水解温度120 ℃,TFA用量3.5 mL,所得总峰面积为4 740.15,与模型预测值相对误差为2.1%。图4为优化条件下测定的美洲大蠊单糖及标准单糖液相色谱图。
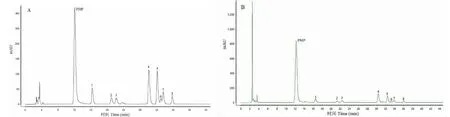
图4 混合对照品(A)及美洲大蠊单糖组成(B)HPLC色谱图
3.3 美洲大蠊多糖抗氧化活性结果
3.3.1 美洲大蠊多糖对DPPH自由基的清除能力
用“2.6.1”项方法测定Vc和美洲大蠊多糖对DPPH自由基的清除曲线,见图5,随着给药浓度的增加,Vc和美洲大蠊多糖对DPPH自由基的清除能力增强,当美洲大蠊多糖浓度为0.08 mg/mL时,清除率为88.34%,此时,Vc的清除率为96.43%。美洲大蠊多糖对DPPH自由基清除作用的IC50数值为0.028 mg/mL,结果显示美洲大蠊多糖有一定的清除DPPH自由基的能力。
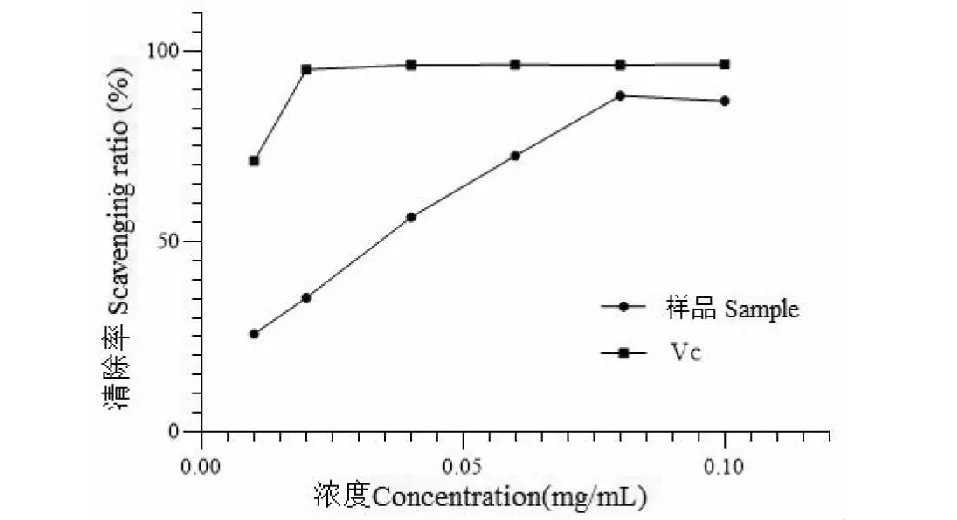
图5 美洲大蠊多糖对DPPH自由基的清除率
3.3.2 美洲大蠊多糖的还原能力
用“2.6.2”项方法测定Vc和美洲大蠊多糖的总还原能力,结果见图6,随着多糖和Vc浓度的增加,美洲大蠊多糖的还原力都出现较为明显的上升。当Vc的浓度达到0.16 mg/mL时,吸光度值达到最大,为1.214;而当美洲大蠊多糖的浓度为0.16 mg/mL时,吸光度为0.667,虽还原能力不及Vc,但本实验仍能证明美洲大蠊多糖具有一定的还原能力。
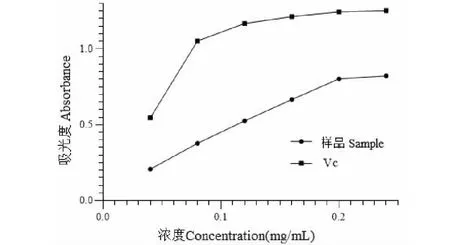
图6 美洲大蠊多糖的总还原能力
3.3.3 美洲大蠊多糖对OH自由基的清除能力
由图7可知,在多糖浓度为0.4~1.6 mg/mL时,OH自由基清除率随着多糖浓度的增加而增加,当多糖浓度达到1.6 mg/mL时,清除率为94.28%,此时,Vc清除率为99.91%,二者清除能力较为接近。美洲大蠊多糖对OH自由基清除作用的IC50值为0.78 mg/mL,表明美洲大蠊多糖具有良好的清除OH自由基的能力。
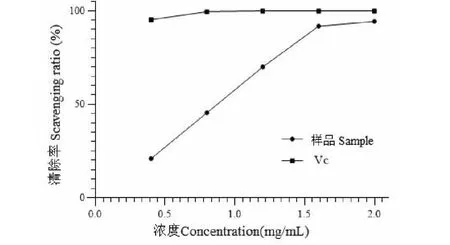
图7 美洲大蠊多糖对OH自由基的清除率
3.3.4 美洲大蠊多糖清除ABTS自由基的能力
由实验结果(见图8)可知,美洲大蠊多糖在0.01~0.16 mg/mL时,美洲大蠊多糖清除ABTS自由基能力曲线相对较陡,清除能力随多糖浓度增加地较快;当多糖在0.16~0.32 mg/mL时,曲线较平缓;当多糖浓度为0.32 mg/mL,美洲大蠊多糖对ABTS自由基的清除率为97%,此时,Vc清除能力为102%。美洲大蠊多糖和Vc对ABTS自由基清除能力的IC50值分别为0.07、0.035 mg/mL,表明美洲大蠊多糖有一定的清除ABTS自由基的能力。
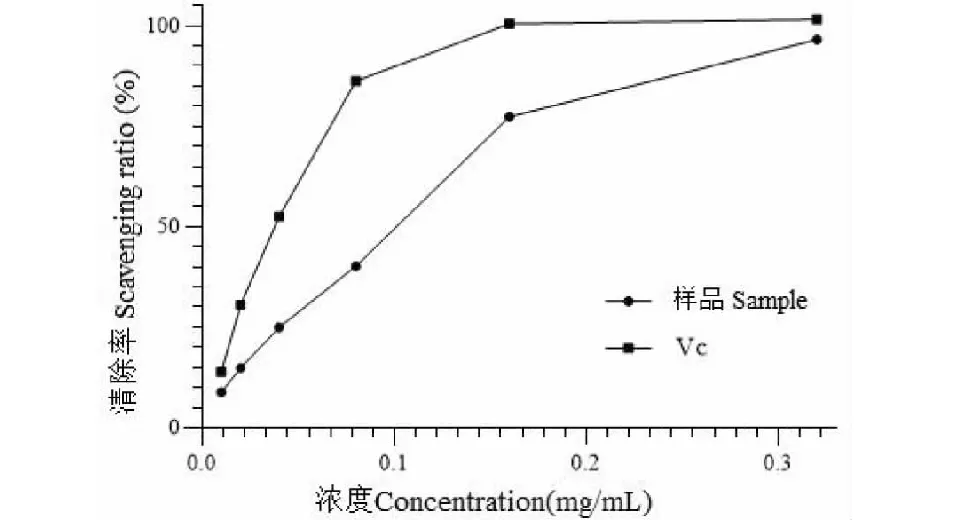
图8 美洲大蠊多糖对ABTS自由基的清除率
4 结论与讨论
本研究采用单因素实验与响应面实验相结合的方法,对美洲大蠊多糖的提取工艺条件进行了优化,并对其抗氧化能力进行了初步评价。得到美洲大蠊多糖水解的最佳工艺条件为:水解时间1 h,水解温度120 ℃,TFA用量3.5 mL,总峰面积为4 740.15。抗氧化活性测定结果表明,美洲大蠊多糖具有较好的抗氧化活性,其对DPPH、OH、ABTS自由基具有较好的清除能力,IC50分别为0.028、0.78、0.07 mg/mL,且具有一定的还原能力。Zhang等[13]发现霸王花多糖中半乳糖和阿拉伯糖的比例与其清除ABTS自由基的IC50存在一定的正相关性。Shang等[14]将5种食用真菌多糖的化学组成及单糖组成与抗氧化活性(IC50)进行Pearson相关性分析发现,岩藻糖、甘露糖和半乳糖的含量对多糖的ABTS自由基清除活力有影响;葡萄糖和甘露糖含量对多糖的OH自由基清除活力有显著影响,岩藻糖含量和多糖的超氧阴离子的IC50值呈正相关。Ai[15]发现甘露糖、鼠李糖、半乳糖、阿拉伯糖对茶多糖抗氧化活性有较大影响。相关文献表明,多糖的抗氧化活性与其单糖组成及各单糖的含量有着密切关系。实验发现美洲大蠊多糖对DPPH、OH、ABTS自由基具有较好的清除能力,HPLC测试结果发现其水解液含有甘露糖、盐酸氨基葡萄糖、鼠李糖、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖,摩尔比为17.0∶13.2∶9.6∶53.4∶21.8∶1.0∶4.6∶1.3;美洲大蠊多糖抗氧化作用可能与其单糖组成有关,而水解后的美洲大蠊多糖抗氧化活性能否保持或增加,有待实验的进一步研究。
