CD14+CD16-HLA-DR+与PD-1单抗治疗非小细胞肺癌的疗效及预后的关系研究*
2021-04-28姚学敏么伟楠陈明达宋君利贾敬好
孙 璐,王 巍,李 婵,姚学敏,么伟楠,陈明达,宋君利,贾敬好
河北省唐山市人民医院肿瘤内科,河北唐山 063000
肺癌是目前全球范围内病死率及发病率均处于第一位的严重恶性肿瘤,有研究指出,80%以上的肺癌患者属于非小细胞肺癌[1]。近年来我国临床中综合运用化疗、手术、放疗、靶向治疗等方案进行综合干预,但非小细胞肺癌患者的临床预后仍难以令人满意,患者的5年生存率仍不足两成[2]。非小细胞肺癌肿瘤细胞中常异常高表达程序性死亡配体-1(PD-L1),其可与活化后的T细胞表面表达的程序性死亡受体-1(PD-1)结合并起到抑制免疫应答的作用,加速促进肿瘤细胞免疫逃逸,并可有效提高肿瘤微环境抵抗免疫的效果。患者体内的免疫抑制状态在非小细胞肺癌的发生和发展过程中具有十分重要的作用,免疫细胞亚群及细胞因子还可能进一步调控远处转移、肿瘤血管生成,免疫抑制微环境也可能进一步调控肿瘤的进展[3]。免疫治疗的临床疗效与肿瘤微环境中免疫抑制细胞群有关,主要的抑制细胞群有髓系抑制性细胞和调节性T细胞[4]。人体内髓系抑制性细胞常被标记为CD14+CD16-HLA-DR+和CD14+CD16-HLA-DR-/low两种亚群。虽然PD-1单抗对患者进行治疗具有一定的临床疗效,但PD-1单抗的临床疗效与患者髓系抑制性细胞种类的关系及其是否可作为影响患者临床疗效和预后的影响因素,相关报道较为罕见。本研究选择本院收治的非小细胞肺癌患者作为研究对象,分析CD14+CD16-HLA-DR+与PD-1单抗的临床疗效和患者预后的相关性,为临床应用提供依据。
1 资料与方法
1.1一般资料 选择本院2018年6月至2019年4月收治的60例非小细胞肺癌患者作为研究对象。年龄>50岁者37例,≤50岁者23例;男46例,女14例;有吸烟史者40例,无吸烟史者20例;依照患者组织病理学检查结果,鳞癌28例,腺癌27例,其他5例;依照患者肿瘤分化程度结果,高分化5例,中分化32例,低分化23例;依照患者TNM分期结果,Ⅰ期13例,Ⅱ期14例,Ⅲ期13例,Ⅳ期20例;CD14+CD16-HLA-DR+患者37例(CD14+CD16-HLA-DR+组),CD14+CD16-HLA-DR-/low患者23例(CD14+CD16-HLA-DR-/low组),两组年龄、性别、吸烟史、病理组织学检查结果、肿瘤分化程度、TNM分期一般资料比较,差异无统计学意义(P>0.05),见表1。纳入标准:(1)患者年龄不小于18岁;(2)经细胞学和组织病理学检查,所有患者均确诊为非小细胞肺癌;(3)入组前未接受其他抗肿瘤方案进行治疗;(4)美国东部肿瘤协作组(ECOG)评分不高于2分;(5)患者器官脏器功能严重受损(血清肌酐≤1.5倍正常上限值、肌酐清除率≥50 mL/min、血小板计数≥100×109/L、中性粒细胞绝对值≥1.5×109/L、血清胆红素≤1.5倍正常上限值、丙氨酸氨基转移酶和天门冬氨酸氨基转移酶均≤2.5倍正常上限值);(6)患者本人及其法定监护人均对本研究知情并签署知情同意书。排除标准:(1)肿瘤病灶为复发性肿瘤;(2)原发于其他脏器或部位肿瘤的肺部转移病灶;(3)入组前两周存在急性炎症或长期存在慢性炎症;(4)妊娠或哺乳期女性;(5)存在其他肿瘤;(6)存在自身免疫性疾病;(7)伴随出现肿瘤相关出血;(8)不遵医嘱用药和治疗;(9)患者本人或其法定监护人申请主动退出本研究。本研究经本院伦理委员会批准实施。

表1 CD14+CD16-HLA-DR+组患者及CD14+CD16-HLA-DR-/low组患者临床资料的比较[n(%)]

组别n肿瘤分化程度高分化中分化低分化TNM分期Ⅰ期Ⅱ期Ⅲ期Ⅳ期CD14+CD16-HLA-DR+组373(8.11)21(56.76)13(45.95)8(21.62)8(21.62)9(24.32)12(32.43)CD14+CD16-HLA-DR-/low组232(8.7)11(47.38)10(43.48)5(21.74)6(26.09)4(17.39)8(34.78)χ20.2981.653P 0.8620.648
1.2方法
1.2.1治疗方法 本研究中所有患者均在入组后及时依照美国国立综合癌症网络指南中推荐的给药方案给予铂类化疗方案进行干预治疗,包括培美曲塞二钠联合卡铂/顺铂方案、多西他赛/紫杉醇联合卡铂/顺铂方案、长春瑞滨联合卡铂/顺铂方案、吉西他滨联合卡铂/顺铂方案等,后患者经影像学检查仍为进展,此时采用PD-1单抗(派姆单抗,美国,默沙东)进行治疗,以21 d为1个周期,持续治疗6个周期,每个周期开始第1天给予2 mg/kg的PD-1单抗进行静脉滴注。
1.2.2检查方法 在患者入组后接受治疗前采集空腹静脉血5 mL,使用密度梯度离心法分离并提取患者外周血中淋巴细胞,所用的人外周血淋巴细胞分离液购自南京福麦斯生物科技有限公司,并严格遵照试剂盒说明书进行操作提取。共提取5份,每份100 μL,分别加入:(1)PE/Cy7-IgG1k荧光抗体和FITC-CD4荧光抗体;(2)PE Armenian Hamster IgG荧光抗体、PE/Cy7-CD16荧光抗体和FITC-CD4荧光抗体;(3)PE-HLA荧光抗体、PE/Cy7-CD16荧光抗体和FITC-CD4荧光抗体;(4)PE-IgG1k荧光抗体、PE/Cy7-CD16荧光抗体和FITC-CD4荧光抗体;(5)PE-DR荧光抗体、PE/Cy7-CD16荧光抗体和FITC-CD4荧光抗体。将5组细胞悬液避光震荡后孵育20 min,依照试剂盒说明书进行操作,后使用流式细胞仪(德国,美天旎)检测淋巴细胞中各因子的表达情况。
1.3观察指标 本研究中参照患者影像学检查结果并根据RECIST Version1.1对患者的临床疗效进行评估,其中患者肿瘤消失且持续时间不低于4周则判定为完全缓解,患者肿瘤最大径之和减少30%以上且持续时间不低于4周则判定为部分缓解,患者出现其他新发肿瘤或可观测肿瘤最大径之和增加20%以上则判定为进展,患者病情介于疾病进展和部分缓解之间则判定为稳定。此外,本研究对患者进行长期随访追踪,记录患者生存率,总生存时间(OS)为患者确诊至死亡或失访时间。
2 结 果
2.1患者治疗后的临床疗效 结果显示,所有患者经治疗后完全缓解1例,部分缓解19例,稳定29例,进展11例。
2.2CD14+CD16-HLA-DR+组患者及CD14+CD16-HLA-DR-/low组患者治疗临床疗效的比较 结果显示,CD14+CD16-HLA-DR+组患者完全缓解和部分缓解共16例,稳定19例,进展2例;CD14+CD16-HLA-DR-/low组患者完全缓解和部分缓解共4例,稳定10例,进展9例,两组患者治疗临床疗效比较,差异有统计学意义(χ2=12.003,P=0.007)。
2.3患者生存情况分析 结果显示,所有患者治疗结束后1年内共死亡7例。CD14+CD16-HLA-DR+组患者治疗后1年内共死亡1例,CD14+CD16-HLA-DR-/low组患者治疗后1年内死亡6例,CD14+CD16-HLA-DR+组患者生存率明显优于CD14+CD16-HLA-DR-/low组患者,差异有统计学意义(P<0.05)。
2.4CD14+CD16-HLA-DR+表达情况与患者治疗临床疗效及预后的关系分析 Logistic回归模型分析结果显示,CD14+CD16-HLA-DR+是非小细胞肺癌采用PD-1单抗治疗后临床疗效及预后的独立影响因素(P<0.05),见表2。
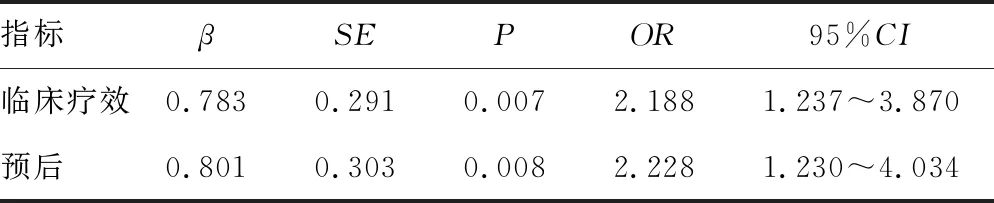
表2 CD14+CD16-HLA-DR+表达情况与患者治疗临床疗效及预后质量关系分析
3 讨 论
有研究指出,临床中常依照生物学行为不同将肺癌分为小细胞肺癌和非小细胞肺癌,其中非小细胞肺癌占全部肺癌的80%以上[5]。国内研究指出,我国近年来65%以上的肺癌患者在确诊时其病情已发展至晚期,且大部分早期患者在诊断后最终将进一步转移和复发,目前我国肺癌临床5年生存率仍不足10%[6]。有研究指出,在全部肿瘤谱系中仅有一小部分肿瘤发生于胚系突变,绝大多数肿瘤的发生与环境因素和体细胞突变密切相关,其中不同形式的慢性炎症和环境因素改变可能促进肿瘤的发生、发展[7]。近年来随着相关研究的不断深入,免疫系统的异常改变在肿瘤发生发展过程中所起到的重要作用也逐渐被揭示,且两者间的关系也随着越来越深入的研究而被全球范围内的学者所认同,因此也有大量的免疫治疗方案在临床中得以广泛应用并取得了较理想的临床疗效[8]。
正常的生理状态下人体内的免疫系统可及时有效地识别并清除微环境中异常突变的肿瘤细胞,但肿瘤细胞也会为了进一步生长和生存采取不同策略对抗免疫系统,有效实现抑制机体内正常的免疫系统,并在体内的多重抗肿瘤免疫应答系统中得以幸存[9]。有学者将肿瘤细胞逃避免疫应答系统称为免疫逃逸,并提出抗肿瘤-免疫循环概念以进一步系统地理解肿瘤免疫的多步骤、多环节及其复杂性[10]。不同肿瘤可通过多途径和多环节影响抗肿瘤免疫系统,异常抑制免疫系统的有效识别和杀伤作用,协助肿瘤细胞逃避免疫系统,产生免疫耐受并可能进一步促进肿瘤的发生、浸润、转移和发展[11]。抗肿瘤免疫系统的效应机制主要包括体液免疫和细胞免疫两大体系,其中在抗肿瘤免疫系统中细胞免疫是主要的实现形式,而体液免疫在其中主要起辅助作用,和细胞免疫相互协同共同杀伤肿瘤细胞[12]。相较于健康者,肺癌患者外周血中NK细胞、CD4+T细胞、CD8+T细胞、CD4+T细胞/CD8+T细胞等淋巴细胞亚群比例多出现明显异常,结果表明肺癌患者体内免疫系统功能处于失衡状态,因此可采用免疫治疗方案对其进行干预治疗[13]。
有研究指出,PD-1可通过PD-1非依赖性和PD-1依赖性机制加速体内肿瘤特异性T细胞凋亡,并可通过PD-1依赖性信号通路有效抑制免疫细胞增殖,导致肿瘤细胞出现免疫逃逸反应[14]。在T细胞的活化过程中当PD-1与PD-L1特异性结合后可抑制T细胞活化,进而有效降低,甚至消除T细胞的杀伤作用,负向调节人体内的免疫应答反应[15]。PD-1单抗是目前全球范围内研究最多、最广也最深入的一类抗体,也是目前临床中应用较多的抗肿瘤免疫治疗药物。
本研究结果显示,采用PD-1单抗治疗后非小细胞肺癌患者均具有较好的临床疗效。相较于CD14+CD16-HLA-DR-/low患者,CD14+CD16-HLA-DR+患者采用PD-1单抗治疗的临床疗效更佳,且患者的生存期更长,PD-1单抗可有效竞争性结合免疫细胞中PD-1而阻断肿瘤细胞中PD-L1与其结合,有效避免免疫细胞被肿瘤细胞识别和抑制,采用PD-1单抗治疗后可有效恢复受抑制的T细胞恢,复肿瘤识别功能,并实现重新激活和重塑受抑制的免疫系统而达到抗肿瘤的作用。但CD14+CD16-HLA-DR+及CD14+CD16-HLA-DR-/low患者治疗临床疗效存在明显差异,其可能与CD14+CD16-HLA-DR+患者治疗后肿瘤组织中浸润的T细胞增殖水平较高有关,同时,可进一步增加病灶区周围T细胞的数量,此外,CD14+CD16-HLA-DR+还可有效对抗肿瘤对T细胞的抑制作用,分泌大量干扰素提高免疫杀伤能力。在肿瘤组织内PD-L1多处于异常高表达状态,当其与免疫细胞中PD-1结合后可有效调控肿瘤浸润CD8+T细胞功能,因此临床中可以采用靶向调节PD-1和PD-L1类化合物进行治疗而起到抗肿瘤的作用。在肿瘤患者体内还存在多种免疫抑制性细胞,如髓系抑制性细胞、调节性T细胞等,其中髓系抑制性细胞促进肿瘤生长和转移能力可进一步细分为重塑肿瘤病灶区微环境、负向调控免疫系统保护肿瘤细胞被免疫细胞杀伤,为肿瘤病灶的远处和淋巴转移提供合适的微环境,促进肿瘤细胞产生肿瘤干细胞、加速肿瘤的上皮间充质转化,而CD14+CD16-HLA-DR+及CD14+CD16-HLA-DR-/low属于重要的髓系抑制性细胞。在采用PD-1单抗治疗后,相较于CD14+CD16-HLA-DR-/low,CD14+CD16-HLA-DR+患者体内的免疫抑制因子、转化生长因子、一氧化氮合酶、白细胞介素等水平处于低表达状态,因此其诱导Treg细胞表达和抑制T细胞功能均减弱,进而可能增强PD-1单抗治疗的临床疗效[16]。但受限于临床样本数较少,研究时间较短并未开展大范围长时间的临床追踪,本研究并未平行对比多种PD-1单抗治疗的临床疗效,还有待于后续进一步深入分析探讨。
综上所述,采用PD-1单抗对非小细胞肺癌患者治疗后,可显著提高患者临床疗效,且CD14+CD16-HLA-DR+患者治疗的临床疗效以及患者的预后生存期明显提高。
