预防性mRNA 疫苗的研究进展
2021-04-23刘晶晶综述李玉华审校
刘晶晶 综述,李玉华 审校
中国食品药品检定研究院虫媒病毒疫苗室,北京102629
随着疫苗在全球范围内的广泛应用,已彻底消灭了天花,脊髓灰质炎、麻疹和风疹也有望在将来被消除,多种感染性疾病得到有效控制。但这些疫苗仍存在一些问题亟待解决,如灭活疫苗的病毒灭活不彻底和减毒活疫苗的回复突变,可能引起人为的病毒感染;病毒培养的细胞基质未有效去除,可能引起毒性和炎症反应;产业化规模受病毒、细胞基质等因素的限制。而近些年发展的亚单位疫苗,需添加佐剂才能增强免疫应答水平,且很难诱导CD8+T 细胞的免疫应答[1]。传统疫苗和亚单位疫苗的局限性促进了新型疫苗的开发。
mRNA 疫苗作为新型疫苗的研究方向之一,在短短30 年里,其疫苗平台已基本建立起来。与其他类型疫苗相比,mRNA 疫苗具有独特的优势:mRNA本身不具备感染性,不能整合入宿主细胞的基因组中,且在其完成蛋白的翻译后会自发降解,不存在感染或基因突变的风险;其次,mRNA 不需要进入细胞核,仅需完成一次跨膜,使抗原的表达更加迅速[2];再次,mRNA 通过设计、合成的方法即可完成体外的大规模生产,产业化周期短,有利于传染病的防控。本文对mRNA 的构建、递送系统和目前的临床研究等作一综述。
1 mRNA 构建
目前,mRNA 的构建策略有两个方向:非复制型mRNA(nonamplifying mRNA)和自我复制型mRNA(self-amplifying mRNA,SAM)[3],见图1。RNA 在外界环境中极易降解,从而影响翻译和表达效率,非复制型mRNA 为了稳定其结构、提高表达效率,以真核细胞mRNA 的结构为参照,对mRNA 进行了序列修饰。SAM 则是将编码序列嵌合至带有RNA 依赖的 RNA 聚合酶(RNA-dependent RNA polymerase,RdRP)的载体上,通过RdRP 对自身mRNA 的复制来提高表达效率。
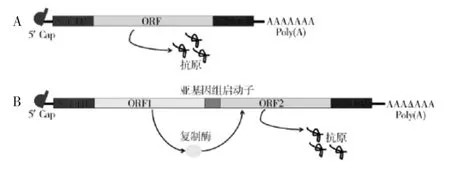
图1 非复制型mRNA(A)和自我复制型mRNA(B)Fig.1 Nonamplifying(A)and self-amplifying(B)mRNAs
1.1 非复制型mRNA
非复制型 mRNA 的元件包括 5′帽子、3′Poly(A)尾、非翻译区(untranslated region,UTR)以及编码序列。
1.1.1 5′帽子 5′帽子结构是在体外转录过程中通过加帽酶添加至核苷酸的5′端的。最常规的帽子结构为 7-甲基鸟苷三磷酸(m7G)帽子(Cap0),其能够防止mRNA 的早期降解,同时在mRNA 的成熟、运输、起始翻译过程中也是至关重要的。但在加帽过程中常发生序列方向的反转,致使1 / 3 的mRNA 5′端未形成帽子结构而无法进行转录[4]。为了避免帽子序列的方向反转,在Cap0 鸟苷的3′-O 位上甲基化,使其只有1 个3′-OH 可添加核苷酸,形成防反帽子类似物(anti-reverse cap analog,ARCA),添加ARCA 的mRNA 在蛋白表达的时程和水平上均得到了大幅提高[5]。但由于转录过程中GTP 的存在,与ARCA 共同竞争5′端核苷酸位点,使小部分mRNA形成无帽结构,从而无法进行下一步翻译。2′-O 甲基化转录本的第1 个核苷形成的帽子(Cap1)同样可提高蛋白表达效率,且Cap1 能够阻止固有免疫对外源RNA 的清除作用[6]。在甲基化帽子结构和转录本第一核苷形成Cap1 的过程中会产生一定量的Cap0,Cap0 在帽子结构中所占比例直接影响蛋白的表达效率。
1.1.2 3′Poly(A)尾 Poly(A)尾通过与多聚腺苷酸结合蛋白[poly(A)-binding protein,PABP]结合,降低脱腺苷化速率,稳定3′端mRNA 结构,同时使PABP 与起始转录因子和5′帽子形成复合物起到终止翻译的作用[7]。增加Poly(A)尾的长度可增强多聚核糖体的形成效率,从而提高蛋白表达效率。Poly(A)序列一般直接设计在mRNA 的质粒模板上,随mRNA 一同进行转录添加到目的基因尾部。研究表明,Poly(A)的适合长度为 100 ~ 150 个核苷酸[8-9]。
1.1.3 5′和 3′UTR UTR 是影响 mRNA 转录、翻译过程的重要反应元件,在调节mRNA 转运与翻译效率、细胞器定位和稳定mRNA 结构等方面发挥作用。目前广泛应用的UTR 多为α-和β-球蛋白基因序列,这两类序列能够大幅提高RNA 的转录效率和稳定性[10]。除球蛋白序列外,仓鼠卵巢延长因子1-α、人热休克蛋白70、内部核糖体进入位点(internal ribosomal entry site,IRES)等序列也被应用于 UTR以提高转录效率[11-12]。
1.1.4 编码序列修饰 外源RNA 进入细胞可能激活模式识别受体(pattern-recognition receptor,PRR)信号通路,使mRNA 疫苗遭到固有免疫清除而影响免疫效果。对mRNA 的核苷酸进行硫代尿嘧啶、甲基胞嘧啶、假尿嘧啶等化学修饰可降低固有免疫反应[13-14]。另外,对碱基进行编辑优化,提高序列中C、G 的比例,可起到提高 mRNA 稳定性的作用[15]。但也有研究表明,碱基和核苷酸的改变可能导致mRNA二级结构改变,影响蛋白正确折叠和T 细胞表位暴露,反而降低了免疫效果[16-17]。
1.2 SAM SAM 是一种基于RNA 病毒基因组设计的复制子,目前研究最多的SAM 是以甲病毒属基因组作为载体进行改造的。甲病毒属基因组为正链RNA,由两部分组成:一部分编码非结构蛋白nsP1 ~nsP4,在翻译过程中形成复制复合体;另一部分编码病毒的结构蛋白,包括核衣壳蛋白和糖蛋白。SAM是将甲病毒的结构蛋白基因替换成特异性的抗原基因,使RNA 失去了组装成感染性病毒的能力。复制复合体参与合成全长负链RNA,并以其为模板合成重组的基因组RNA 和特异性抗原基因,抗原基因被高水平转录后翻译成目的抗原。与非复制型mRNA疫苗相比,抗原表达量和持续时程均明显提高[18]。但病毒载体的病原相关分子模式(pathogen-associated molecular patterns,PAMP)的保守性可能使其反应原性难于控制,同时载体蛋白产生的免疫原性可能导致预存抗体的形成。
2 递送系统
RNA 是亲水性、带负电荷的大分子,其自主跨膜能力有限,因此,如何高效地将mRNA 递送至细胞质中进行抗原表达,是限制RNA 疫苗应用的关键问题之一。WOLFF 等[19]首次将编码报告基因的mRNA 注射进小鼠体内并观察到了蛋白表达。但由于RNAase 的存在能使外源RNA 迅速降解,而影响抗原表达效率。为解决这个瓶颈问题,经多年研究发现,可使用一种递送系统协助mRNA 进入细胞,并能保护mRNA 不被降解。理想的递送系统能够携带mRNA 通过细胞质膜而不被RNase 降解,进入细胞后能够允许mRNA 释放到细胞质进行翻译,同时,该递送系统具有其相应的安全性。目前,已有多种策略用于mRNA 的递送,包括多肽、脂质体、聚合物、纳米乳剂等。
2.1 鱼精蛋白 鱼精蛋白是一种由30 个左右氨基酸残基组成的阳离子多肽,含1 个核定位信号(nuclearlocalization signal,NLS),与 mRNA 结合有利于增强mRNA 转染细胞的效率,另外,还可保护其免受RNase 降解,同时刺激机体产生免疫应答,起到佐剂的作用[20]。临床试验已证明了其安全性,并能在一定程度上提高T 细胞免疫水平[21]。但也有报道由于鱼精蛋白与mRNA 结合过于紧密,而使蛋白的表达效率降低[22]。
2.2 脂质纳米颗粒(lipid nanoparticles,LNPs) 脂质体已被FDA 批准用于多种化学药物的递送。随着对mRNA 疫苗研究的深入,脂质体也成为mRNA 递送系统的研究热点之一,其中,LNPs 是最受关注的一类脂质体递送工具。通常LNPs 由阳离子脂质、胆固醇、磷脂和PEG 4 种成分构成,与mRNA 自发装配成100 nm 左右的颗粒。阳离子脂质在pH 为酸性的条件下,通过电荷相互作用将带有负电荷的mRNA包裹进LNPs 核心,进入细胞后,在生理pH 条件下使LNPs 的表面呈电中性或弱阳性,避免了非特异性脂蛋白的结合,同时利于mRNA 释放入细胞质;胆固醇起到稳定LNPs 结构的作用;磷脂则形成保护性的双层膜结构,其带负电荷的磷酸基团与阳离子脂质作用有利于mRNA 在细胞质中的逃逸;PEG延伸到LNPs 外侧,能够减少与胞内蛋白的相互作用,同时延长颗粒在体内的半衰期[23]。有文献报道,合成的LNPs 的组成成分、所带电荷、颗粒直径及颗粒排布等直接影响疫苗的药代动力学特性和免疫效果[24]。
2.3 高分子聚合物 聚乙烯亚胺(polyethylenimine,PEI)是用于基因递送常见的聚合物。PEI 的分子量通常有几十个KDa,是递送同样大分子的SAM 最适宜的载体之一。但PEI 的高分子量也带来了高的细胞毒性[25],为了解决这一问题,研究者对PEI 进行了化学修饰,在低分子量的PEI 支链上添加了β-环糊精,可通过鼻滴的方式帮助mRNA 穿过上皮细胞屏障到达淋巴组织[26]。
2.4 纳米乳剂 Novartis 公司研制了一种用于递送SAM 的纳米乳剂,该乳剂是在其公司专利人用疫苗佐剂MF59 的基础上添加DOTAP 等油相成分,以包裹水相中的mRNA 来达到递送的目的。在小鼠、兔和非人灵长类动物试验中,两次肌注后均获得了高水平的中和抗体[27]。但由于其包含水、油两种不相溶的成分,稳定性较差,包裹RNA 后很难形成小而均一的结构。
在脂质载体中,阳离子脂质在细胞递送、内涵体逃逸中起关键作用,同时该成分也存在着明显的细胞毒性问题。阳离子脂质可作为去垢剂破坏细胞膜的完整性,当其浓度达到一定程度时,可诱发细胞裂解和细胞坏死,浓度低时也有可能影响基因表达而加快细胞凋亡。在动物肝脏富集时,通过触发炎性因子从而破坏肝脏功能,浓度过高还可能引起小鼠死亡。近些年,已从几方面对阳离子脂质进行了优化,在保证递送效率的同时降低细胞毒性。如对分子结构进行改造、修饰,将阳离子替换成可电离的离子,筛选低毒性阳离子脂质等。
3 mRNA 疫苗的应用
3.1 流感疫苗 流感疫苗是首个尝试将mRNA 用于疾病预防的疫苗[28]。由于流感病毒的血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)极易发生变异,尚无广谱性疫苗可对抗突变的病原体,因此,建立一个相对简单、快速产业化的疫苗平台有利于应对病毒突变,控制疾病流行。
在非复制型 mRNA 方面,PETSCH 等[28]将 A /Puerto Rico / 8 / 34(H1N1)株流感病毒的 HA 全长序列与鱼精蛋白形成的复合物经皮下免疫小鼠,获得了稳定、长效的免疫保护作用,采用另一株流感病毒的HA 序列设计的mRNA 疫苗免疫白釉和猪,同样获得了与已上市灭活疫苗类似的免疫保护效果。LUTZ 等[29]利用 Curevac AG 公司建立的 RNActive平台,构建了 A / Netherlands / 602 / 2009(H1N1)HA的mRNA-LNPs,经肌肉免疫非人灵长类动物,HAI滴度在1 年内均保持很高的水平(≥ 1 ∶60);构建的A / HongKong / 4801 / 2014(H3N2)HA 的 mRNALNPs 诱导的T 细胞和B 细胞免疫应答水平甚至优于已上市的MF59 佐剂疫苗。Modena TX 公司的mRNA-LNPs 率先完成了H10N8 和H7N9 流感疫苗的Ⅰ期临床试验(NCT03076385,NCT03345043)[30],经肌肉免疫两针,间隔3 周,H10N8 的免疫剂量为100 μg 时,HAI 滴度 ≥ 1 ∶40 的阳转率为 100%,MN滴度 ≥ 1 ∶20 的阳转率为87.0%;H7N9 的免疫剂量为 25 μg 时,HAI 滴度 ≥ 1 ∶40 的阳转率为 96.3%,MN 滴度 ≥ 1 ∶20 的阳转率为100%,两疫苗均无严重不良反应,获得了良好的免疫耐受和体液免疫效果,但未诱导出细胞免疫。
在 SAM 方面,HEKELE 等[31]利用 SAM 疫苗平台,将 A /California /07 /2009(H1N1)和 A /Shanghai /2 / 2013(H7N9)HA 的重组 RNA 分别包裹进 LNPs中,递送到动物体内,经肌肉注射0.1 μg 即可诱导抗体产生。MAGINI 等[32]合成了 3 种 SAM-LNPs,其中针对病毒核蛋白(nucleoprotein,NP)的 NP-SAMLNPs 表现出了良好的效果,能诱导出特异性CD4+T和CD8+T 细胞,并对小鼠具有一定的交叉保护作用。该团队利用另一递送系统合成了HA-SAM-CNE,也诱导出了细胞免疫和体液免疫,对同型病毒具有保护作用[33]。VOGEL 等[34]采用 PEI 递送系统对合成的HA-mRNA-PEI 和HA-SAM-PEI 进行了免疫效果的比较,并配伍了 A /California /07 /2009(H1N1)、A / Hong Kong / 1 / 68(H3N2)和 B / Massachusetts /2 / 2012 的三价 HA SAM 疫苗,该多价疫苗能保护小鼠对H1N1 和N3N2 型病毒的攻击。目前尚无SAM 疫苗进入临床研究阶段。
3.2 狂犬病疫苗 狂犬病病毒侵染哺乳动物神经后的致死率极高,虽已有多种获批疫苗应用于狂犬病的预防,但价格和供给限制等因素仍使亚洲、南美洲国家面临病毒感染的威胁。mRNA 疫苗生产成本和安全性等优势使其在未来获得更大范围的推广成为可能。另外,WHO 评价狂犬病疫苗临床保护效果的标准已确定,便于mRNA 疫苗与获批疫苗进行有效性的比较[35]。
CureVac AG 公司研制的狂犬病疫苗CV7201已完成Ⅰ期临床试验(NCT02241135)[36]。该疫苗是应用与流感疫苗相同的mRNA 疫苗设计平台,将编码糖蛋白(RABV-G)的mRNA 与鱼精蛋白混合形成复合物。临床前研究显示,该疫苗对小鼠和猪表现出了良好的免疫原性和保护效果,皮下免疫效果与已上市的Rabipur 疫苗类似[37]。临床试验采取了皮下和肌肉两种免疫方式,共免疫3 次。在安全性评价方面,大部分受试者出现了局部或全身不良反应,其中有3 例严重不良反应,该临床试验认为其安全性在可接受范围内。在有效性评价方面,仅皮下无针注射方式免疫时阳转率可达76%,第42 天,特异性CD4+T 细胞增加,免疫效果受免疫方式影响严重。LUTZ 等[29]同时尝试利用 RNActive 疫苗平台构建了 RABV-G mRNA-LNPs 疫苗,单次免疫 0.5 和 5 μg,小鼠可100%阳转,且CD4+、CD8+T 细胞免疫也达较高水平;单次免疫10 μg,非人灵长类动物也达到类似的免疫效果,该候选疫苗已进入Ⅰ期临床入组阶段(NCT 03713086)。
3.3 寨卡疫苗 2015 — 2016 年,寨卡病毒在美洲地区开始大范围传播,导致了大量胎儿的先天性畸形等病症,但无疫苗可供使用。Modena TX 公司的非复制型mRNA-LNPs 疫苗已完成Ⅰ期临床试验(NCT03014089),结果尚未发布;另一针对黄病毒属病毒血清阳性和阴性人群的Ⅰ期临床正在入组(NCT04064905)。该疫苗的临床前研究显示,对mRNA进行修饰后,免疫 AG129 和 C57BL / 6 小鼠,可诱导出强效的中和抗体(EC50可达 1 / 100 000),且无病毒血症出现。E-DII-FL 突变的mRNA-LNPs 还能降低感染登革病毒后出现的免疫增强反应[38]。PARDI等[39]对寨卡病毒的prM-E 蛋白序列进行了优化和假尿嘧啶修饰,合成的mRNA-LNPs 单次免疫小鼠和非人灵长类动物均诱导出了高效的中和抗体和持久的保护力水平。ERASMUS 等[40]将一种新型的纳米结构脂质载体应用于寨卡病毒SAM 的递送上,单次免疫10 ng 即可使小鼠100%阳转,单次免疫3 ng即可达100%的保护。ZHONG 等[41]直接将寨卡病毒SAM 通过皮下电穿孔的方式免疫小鼠,1 μg 即可使 BALB / c 和 IFNAR1- / -C57BL / 6 小鼠产生有效的体液和细胞免疫,但对野生C57BL / 6 小鼠表现出较低的阳转率和抗体滴度。
3.4 新型冠状病毒疫苗 随着2019 年底多例不明原因的肺炎病例被报道,新型冠状病毒SARS-nCoV-2 迅速在世界范围内开始传播,截止至2021 年4 月,已有超过1 亿人口被确诊,造成至少200 万人死亡[42],给全球经济、社会发展带来了巨大的打击。多个国家采用多种技术平台以前所未有的速度开始了该疫苗的研发。
Moderna TX 公司利用已有的mRNA 技术平台研制出第一个进入Ⅰ期临床试验的新冠疫苗(NCT04283461),该疫苗的mRNA 编码新冠病毒全长S蛋白序列,递送系统为LNPs,SM-102 作为其阳离子脂质成分。Ⅰ期临床共入组105 名受试者,主要考察其安全性和反应原性,以及通过检测IgG 抗体考察其免疫原性。德国Biontech SE 公司的mRNA-LNPs疫苗紧随其后分别在德国和美国进入Ⅰ/Ⅱ期临床试验(NCT04368728)。该临床试验预计入组7 600名受试者,分3 个阶段进行不同规模的临床试验,通过血清中和抗体、S 蛋白特异性结合抗体和RBD特异性结合抗体水平考察其安全性、耐受性、免疫原性及效价等。中国在应对新冠病毒疫情时采用的疫苗研发5 种技术策略也包括了新冠病毒mRNA疫苗,该疫苗目前处于研发之中。
3.5 其他疫苗 还有多种mRNA 疫苗在临床前及临床研究阶段也取得了较好的结果。Modena TX 公司的人巨细胞病毒疫苗编码五聚体复合物不同亚基(gH、gL、UL128、UL130、UL131A)和糖蛋白 B 的 mRNA分别与LNPs 复合,形成含有6 种mRNA-LNPs 复合物的人巨细胞病毒疫苗,该疫苗免疫小鼠和非人灵长类动物均表现出长效的中和抗体水平,且对小鼠可诱导出多种抗原的T 细胞免疫应答[43],目前该疫苗也已完成Ⅰ期临床试验(NCT03382405),进入Ⅱ期临床入组阶段(NCT04232280)。另外,该公司的另一mRNA 疫苗—人偏肺病毒与3 型副流感病毒联合疫苗也刚刚完成了Ⅰ期临床试验(NCT03392389),该疫苗接种健康成人后,中和抗体的几何均值分别在 6 和 3 左右,有望成为其候选疫苗。ROTH 等[44]以Ⅰ型登革病毒非结构蛋白的多肽序列作为目的抗原序列设计的mRNA-LNPs 免疫HLAⅠ类转基因小鼠,结果发现,NS3、NS4B、NS5 蛋白的多肽能够诱导出CD8+T 细胞应答,且对Ⅰ型登革病毒攻击具有保护作用。MEYER 等[45]研发的埃博拉病毒糖蛋白mRNA-LNPs 免疫豚鼠后,能产生特异性IgG 抗体和中和抗体,其保护率达100%。
4 总结与展望
随着新发突发传染病的不断出现,研发能够快速产业化的疫苗成为新的发展方向。mRNA 疫苗具有高转染效率、强免疫刺激能力和低感染风险等特点,近年来,已在癌症和HIV 治疗等领域取得了突破性进展,在预防性疫苗研发方面虽刚刚起步,但发展迅速。表达目的抗原的两种mRNA 系统,即非复制型mRNA 和SAM 技术平台的建立具有十分重要的意义。非复制型mRNA 是在目的抗原序列两端增加 5′帽子、UTR 和 Poly(A)序列,稳定其结构,增加转染效率;SAM 则是在甲病毒属的非结构序列上插入目的抗原序列,实现嵌合mRNA 在细胞内的自我复制。为了提高mRNA 的转染效率和稳定性,多种递送系统的研究得到了发展,使增加抗原表达效率、延长抗原表达时间、减少自身炎症反应成为可能。目前,递送系统仍是mRNA 疫苗研究的关键技术之一。在短时间内已有包括流感、狂犬病、寨卡、新冠、人巨细胞、人偏肺与3 型副流感联合疫苗等多种预防性病毒性疫苗进入临床研究阶段,这些候选疫苗均是以非复制型mRNA 佐以LNPs 或鱼精蛋白的策略构建,均表现出良好的免疫效果。虽然对mRNA疫苗的研究时间尚短,在mRNA 的修饰和设计、对SAM 载体的改进、对递送系统的选择和开发等方面仍有深入研究的广阔空间,但目前的临床和临床前数据已展现出积极的研究前景,有望在传染病防控,尤其是新发突发传染病防控中发挥重要作用。
