两种方法提取高原地区人血液DNA 效果的比较
2021-04-23张诗璇宋佳颖梁贞多吉卓玛央拉巴桑卓玛
张诗璇 ,宋佳颖 ,梁贞 ,多吉卓玛 ,央拉 ,巴桑卓玛 ,3
1.西藏大学高原医学研究中心,西藏拉萨850000;2.复旦大学生命科学学院,上海200000;3.中国藏学研究所(珠峰研究院),西藏拉萨850000
进行基因组学的研究,需获取高纯度的基因大分子[1-3],而高原地区由于压力等因素,使得提取试剂受到一定的影响,从而导致提取DNA 的浓度、纯度大幅下降,且DNA 溶液中各种物质的污染较为严重,原因主要是提取方法、试剂剂量以及溶液配制等方面。通常提取DNA 的方法应经济有效,可适用于-20 ℃以下冷冻的血液样本,同时保证DNA 质量[4]。研究表明,溶液沉淀法具有较高的核酸提取量,且DNA 纯度较好[5]。其提取原理[6]主要在于 DNA 的析出,受高原低气压影响,在温度恒定的条件下,气体分子的自由程在低压环境内会增加,分子自由度增加[7],从而导致碰撞概率下降。同样,在DNA 提取液体中均不存在较强的成键离子,因此可排除液体间反作用离子阻力的影响,可近似地将液体离子看作气体分子,同理可得液体中离子的碰撞概率会下降。当碰撞概率下降时,DNA 分子相对不易进行键合作用溶解,这会使DNA 提取纯度及浓度大大下降,杂质含量极大增加,从而影响高原地区分子生物学的自主发展。本研究采用市售人类基因组全血DNA 沉淀法提取试剂盒与本文改良方法分别各提取1 000 例人群全血样本DNA,比较两种方法高原地区DNA提取效果,现报道如下。
1 材料与方法
1.1 主要试剂及仪器 血液基因组DNA 提取试剂盒(沉淀型)DP318 为市售产品;分光光度计(Thermo-NANODROP 2000)购自美国Thermo 公司;无水乙醇和异丙醇均为分析纯。
1.2 DNA 纯度判断标准 1.6 < A260/A280< 2.0,超过此范围表明溶液中存在RNA 污染,而低于此范围表明溶液中存在蛋白质、酚类等污染;A260/ A230>1.6,以排除溶液中存在污染物,如碳水化合物、盐类、多肽等。
1.3 试剂盒方法(以 1 000 μL 血液为例) 向 1 000 μL 抗凝血液(-40 ℃冻存1 年以上)中加入2 000 μL 细胞裂解液CL,颠倒混匀 5 次,13 400 × g 离心 1 min;弃上清,沉淀中加入500 μL 缓冲液 FG 与 5 μL Proteinase K 的混合液,立即涡旋混匀至溶液无团块,65 ℃水浴10 min,其间颠倒混匀数次;加入500 μL 异丙醇,颠倒充分混匀至出现丝状或簇状基因组DNA,13 400 × g 离心 5 min;弃上清,沉淀中加入 150 μL 70%乙醇,涡旋振荡 5 s,13 400 × g 离心 2 min;弃上清,重复加入 150 μL 70%乙醇,涡旋振荡 5 s,13 400 × g 离心 2 min;弃上清,空气干燥DNA 沉淀直至所有液体挥发干净(至少5 min),加入 200 μL 缓冲液 TB,低速涡旋 5 s,65 ℃加热10 min 至1 h 溶解DNA,期间轻弹数次助溶。检测浓度、吸光度、断裂程度。
1.4 改良方法(以 1 000 μL 血液为例)
1.4.1 细胞裂解 试剂盒方法中进行2 次裂解,本文改进方法为提高细胞裂解效率,共进行3 次裂解,共计加入CLA 溶液 2 100 ~ 3 000 μL,平均每次加入 700 ~ 1 000 μL,每次加入CLA 后均进行振荡操作,振荡至图1 碎片大小,不可过度振荡,每次中速振荡约20 s 即可,原方法中并未提及振荡时间段。转速依次为 20 096、15 072、15 072 × g。离心后去上清液的沉淀见图1。
1.4.2 混合液溶解DNA 与蛋白质的溶解去除 1 000 μL 样本中可加入 FG 溶液 700 ~ 1 000 μL 和蛋白酶 K 溶液 12.5 μL,立即振荡。加入混合液后放入恒温水浴锅(60 ~65 ℃)水浴40 ~ 60 min,取出。
1.4.3 DNA 析出 从水浴锅中取出后,加入1 000 μL 4 ℃冷藏的异丙醇,缓慢上下颠倒混匀约20 次直至沉淀析出(图2A),12 560 × g 离心 16 ~ 20 min。由于本方法 DNA 析出后较难聚合,建议离心时间增加,以避免去上清液时不慎将DNA 到出。
1.4.4 DNA 洗涤 离心后小心去除上清液[由于DNA 呈透明高密度流体状(图2B),较难从溶液中辨别出来,建议在灯光下去除上清液)],加入70%冰乙醇溶液1 000 μL(考虑到高原地区乙醇易挥发的特性,为避免误差,建议配置71% ~73%的乙醇溶液),轻微上下颠倒混匀 15 ~ 20 次,12 560 × g离心3 min;去上清,沉淀为白色透明的结晶状物体(图2C)。同上步骤进行第2 次乙醇洗涤,以去除盐离子等污染物(图2D),倒置在洁净的滤纸或其他纸张上15 min(图2E),使乙醇流出后再正立放置于通风处开盖10 min;加入DNA溶解液(BL 溶液或超纯水)。
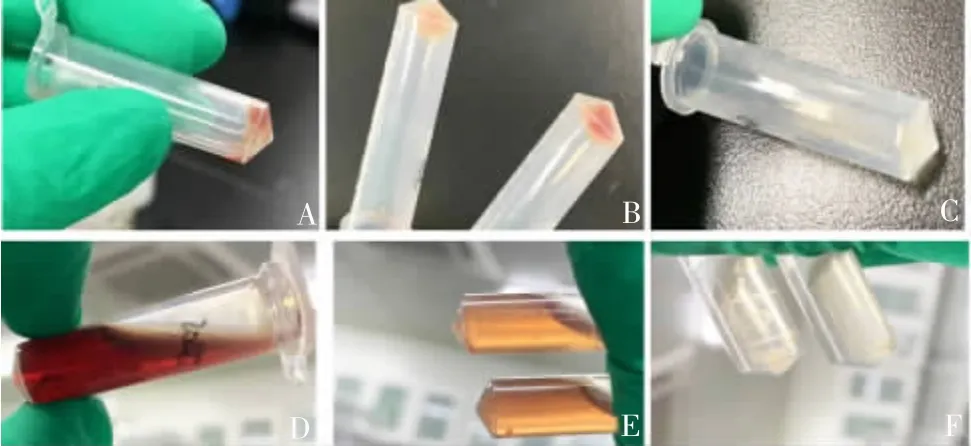
图1 细胞裂解过程

图2 DNA 析出与洗涤过程
1.4.5 注意事项 提取DNA 过程中为避免DNA 断裂应尽量防止剧烈振荡,如DNA 掉落应使用移液枪枪头轻轻吸起,不可反复抽吸以使DNA 断裂概率增加。同时本方法提取DNA 的浓度较高,因此溶解时可加大TB 用量。
1.5 统计学分析 通过R 语言(RStudio-R.3.5.2)对两种方法提取的 DNA 的浓度、吸光度(A260/ A280、A260/ A230)分布情况进行正态性检验,并进行Shapiro-Wilk、Wilcoxon-test 及T-test分析。以P < 0.05 为差异有统计学意义。
2 结 果
正态性检验结果显示,所有组别均不属于正态分布,呈现离散型变量分布特征,见表1 和图3。Shapiro-Wilk、Wilcoxontest 及T-test 分析结果显示,两种方法提取的DNA 浓度、A260/A280、A260/ A230差异均有统计学意义(P < 0.01),见表1、图4和图5。表明市售沉淀法试剂盒提取标准不完全适用于高原地区DNA 的提取。
根据数据的均值[XcA= 26.5 / XcB= 199.5,X(A)A260/A280=1.2 / X(B)A260/A280= 1.8,X(A)A260/A230= 1.4 / X(B)A260/A230= 1.6]发现,本文改良方法的均值水平均远高于试剂盒的均值水平,且与标准DNA 指标相近。同时从吸光度的标准差角度分析,本文改良方法的实验结果相对于试剂盒更稳健,异常值较少,实验结果可靠[如 S(A)A260/A280= 0.12 / S(B)A260/A280= 0.05]。因此,从均值和标准差的角度进一步证明本文改良方法更适用于高原地区DNA 的提取。
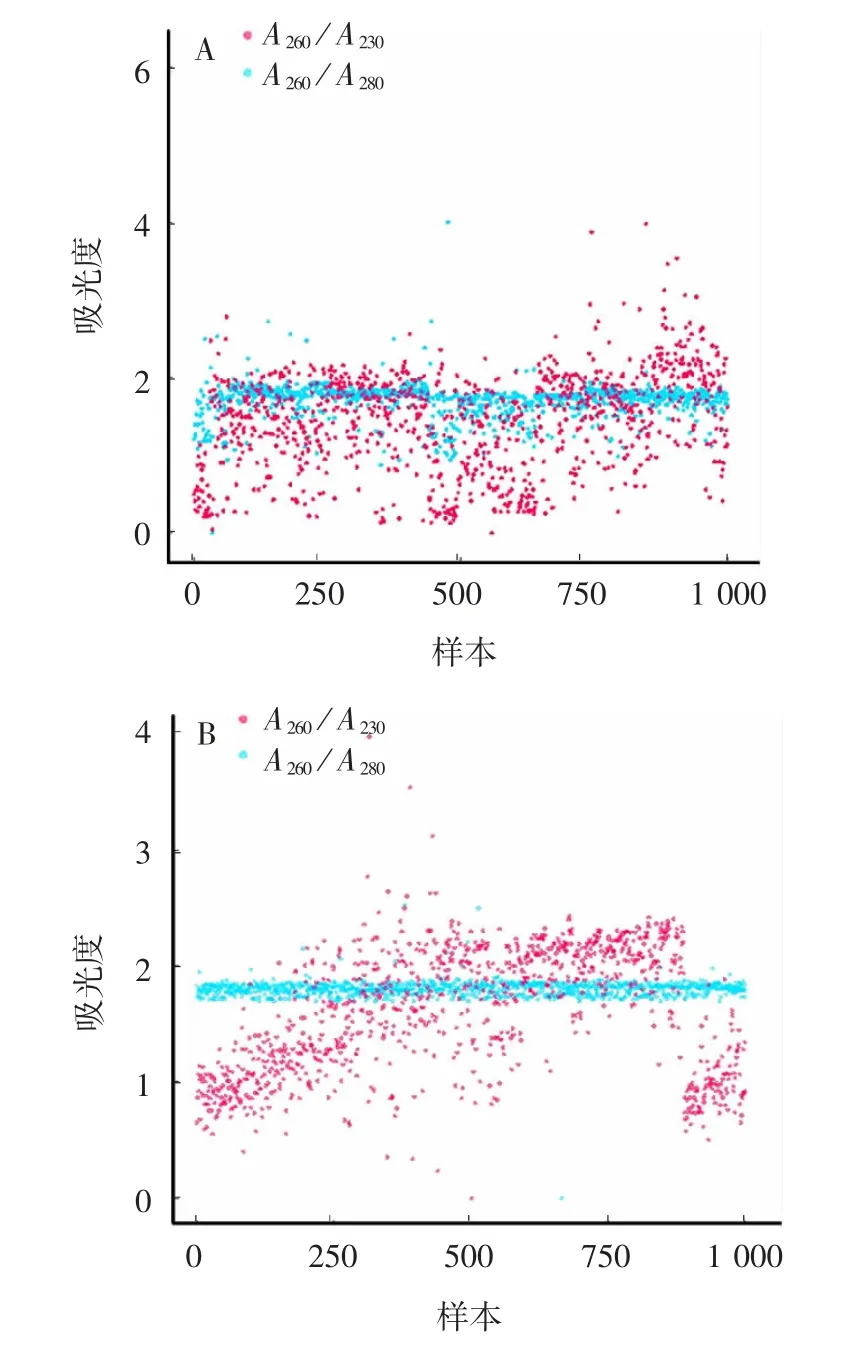
图3 两种方法提取的DNA 吸光度分布情况
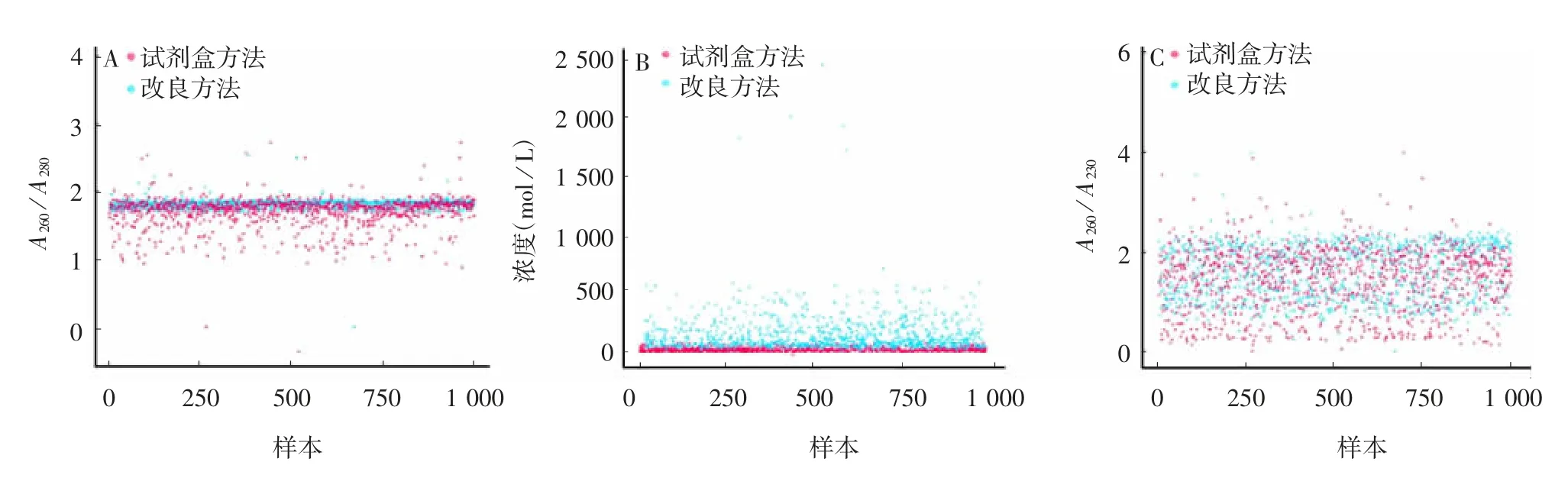
图4 分析结果的散点图

图5 分析结果的箱线图
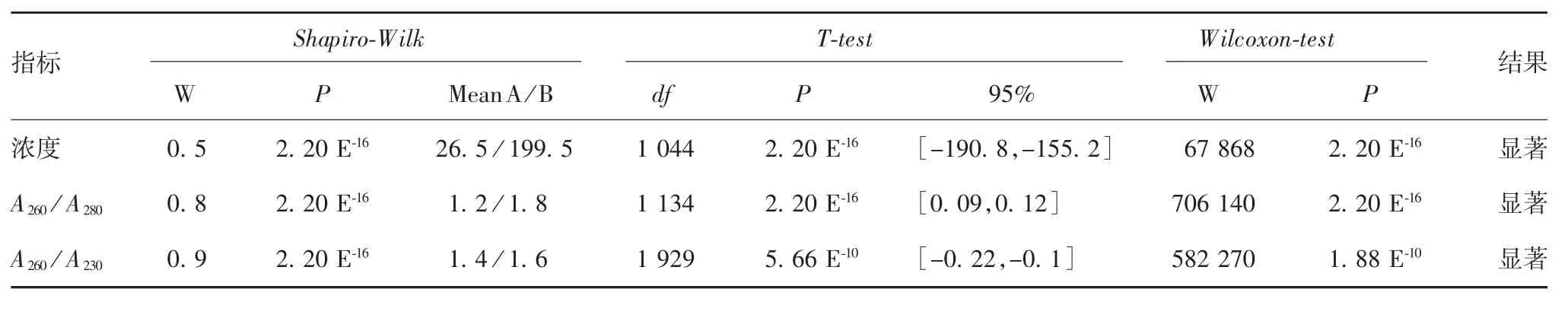
表1 两种方法提取的DNA 浓度、吸光度比值的3 种检验结果
3 讨 论
据联合国环境规划署(United Nations Environment Programme,UNEP)报告,世界上约 12%人口受高原环境的影响[8]。在高原地区,高原病是困扰人们的难题,分子机制的研究逐渐成为疾病治愈的重要途径,而DNA 的提取质量是疾病大分子机制研究的重要一环。本文改良方法与普通试剂盒比较后发现,二者差异有统计学意义(P <0.01),市售试剂盒的提取方法及标准不完全适用于高原地区DNA 的提取,而本文改良的方法有效增加了DNA 的提取纯度及浓度。本实验为我国西藏地区分子生物学的发展提供了生物学技术支持。
