新型冠状病毒灭活疫苗(Vero 细胞)中β-丙内酯残留气相色谱检测方法的建立、优化及验证
2021-04-23杨安纳王吟杨东升周艳萍涂晶卢佳李茜施金荣王泽鋆申硕
杨安纳,王吟,杨东升,周艳萍,涂晶,卢佳,李茜,施金荣,王泽鋆,申硕
武汉生物制品研究所有限责任公司,湖北武汉430207
新型冠状病毒肺炎(corona virus disease 2019,COVID-19)是由严重急性呼吸综合征冠状病毒2 型(severe acute respiratory syndrome coronavirus 2,SARSCoV-2)引起的新型呼吸道传染病。截至2021 年1月中旬,全球累计新冠确诊病例超过9 319 万,死亡病例达201 万以上,现仍以每天新增68 万感染病例的速度增长,尚无特效药,接种安全有效的疫苗建立群体免疫是遏制该病毒传播的最佳手段。目前,全球已有多种新冠疫苗进入临床研究,包括重组载体、DNA、脂质纳米颗粒mRNA、灭活病毒、减毒活病毒和蛋白质亚基疫苗等[1]。据WHO 统计,截至2020年12 月29 日,全球共有190 多个候选疫苗正在研发,其中50 多个已进入临床试验阶段,15 个已进入Ⅲ期临床试验[2]。
灭活剂 β-丙内酯(β-propiolactone,BPL)直接与病毒核酸分子中的鸟嘌呤或腺嘌呤作用[3],引起单链断裂或双螺旋链交联而达到灭活病毒的作用。与甲醛比较,BPL 对病毒具有更强的灭活作用,同时不破坏病原体蛋白的免疫原性;还可降低生物制品中残留宿主细胞DNA 的含量,并具有极易水解成无毒无害物质的特性,目前在国外应用于多种疫苗的灭活[4-6]。武汉生物制品研究所有限责任公司在新型冠状病毒灭活疫苗(Vero 细胞)研发中,以BPL 作为灭活剂,对烈性传染病病原体进行两步灭活,灭活效果更彻底,确保生产及接种使用的安全性。但BPL可引起碱基烷基化或酰基化,导致DNA 损伤,如去嘌呤突变,并发生A 至T 转位。在实验动物中,即使单次给药,BPL 也显示出高度致瘤性、遗传毒性和致癌性[7]。因此以其作为灭活剂进行疫苗生产时需对其残留进行工艺验证,确保符合国家疫苗质量监管部门的要求。目前BPL 残留的检测方法有高效液相色谱法和气相色谱法[8-10]。本研究针对新型冠状病毒灭活疫苗(Vero 细胞)中BPL 残留量建立气相色谱检测方法,并进行专属性、检测限、定量限、线性范围、重复性和耐用性验证,为病毒灭活验证工艺及质量控制提供实验依据。
1 材料与方法
1.1 疫苗浓缩液及原液 新型冠状病毒灭活疫苗(Vero 细胞)浓缩液(批号:202009Z001)及该疫苗原液(批号:202005Y009、202005Y010、202005Y011)由武汉生物制品研究所有限责任公司制备。
1.2 主要试剂及仪器 BPL 对照品(含量:1.146 g/mL)购自德国SERVA 公司;乙腈(色谱级,纯度为99.9%)购自国药集团化学试剂有限公司;Agilent DB-624 毛细管柱(30 m × 0.250 mm × 1.40 μm)和气相色谱仪(型号:Agilent 7890A)均购自美国Agilent 公司。
1.3 方法的建立 气相色谱条件:进样口温度为180 ℃,分流比为2 ∶1,载气为氮气,检测器温度为250 ℃,运行时间为 10 min[11]。
1.4 方法的优化
1.4.1 柱温条件的选择 分别采用升温程序[11](初始温度:80 ℃,保持 1 min,以 20 ℃ / min 的速率升温至200 ℃,保持5 min,运行12 min)和等温程序(柱温:120 ℃,运行 10 min)进行检测,考察 BPL 峰的出峰时间和分离度。
1.4.2 流速的选择 分别采用 1 和 3 mL / min 流速进行检测,依据BPL 峰的分离度和拖尾因子选择方法的流速。
1.4.3 进样量的选择 分别进样1 和0.2 μL,进行检测,依据BPL 峰的分离度和拖尾因子选择方法的进样量。
1.5 方法的验证
1.5.1 专属性 取0.101 2 g BPL 对照品,置100 mL容量瓶中,用乙腈稀释至刻度,配制成1 mg / mL 的BPL 对照品溶液;再进行 3 倍稀释,配制成 337 μg /mL的 BPL 对照品溶液。用 1 mg / mL 的 BPL 对照品溶液与疫苗原液按1 ∶1 的比例混合(混合样品)。将1 mg / mL 的BPL 对照品溶液及混合样品按最佳条件进行检测,确定BPL 峰的保留时间和分离度,两者BPL 峰的保留时间应一致,分离度应 >1.5。同时以乙腈作为空白对照。
1.5.2 重复性 取 337 μg / mL 的 BPL 对照品溶液连续进样6 次,按最佳条件进行检测,计算峰面积和保留时间。峰面积和保留时间的相对标准偏差(relative standard deviation,RSD)应 ≤ 4.0%。
1.5.3 耐用性 取 337 μg / mL 的 BPL 对照品溶液,于不同检测器温度(245、250、255 ℃)、不同进样口温度(175、180、185 ℃)条件下,按最佳条件进行检测,计算峰面积和保留时间。峰面积和保留时间的 RSD 应 ≤ 4.0%。
1.5.4 线性范围 用乙腈配制浓度为500、250、125、62.5、31.25、15.625、3.125 μg / mL 的 BPL 对照品溶液,按最佳条件进行检测,计算BPL 峰面积。以峰面积为横坐标,BPL 浓度为纵坐标进行线性回归分析,获得线性回归方程,相关系数(r)应 ≥0.999。
1.5.5 定量限及检测限 取 1 mg / mL 的 BPL 对照品溶液,用乙腈稀释100 倍,再进行4 倍稀释,按最佳条件进行检测,将信噪比10 ∶1 的样品浓度确定为此方法的定量限;再稀释3 倍,将信噪比3 ∶1 的样品浓度确定为此方法的检测限。
1.6 方法的应用
1.6.1 疫苗灭活过程中BPL 含量的检测 取已灭活水解的新型冠状病毒灭活疫苗(Vero 细胞)浓缩液,加入体积比为 1 ∶4 000 的 BPL,分别于 2 ~ 8 ℃放置 0、12、24、36、48 h 取样,按最佳条件进行检测,根据峰面积计算BPL 含量,并绘制含量与时间的变化曲线。
1.6.2 疫苗水解过程中BPL 含量的检测 取经BPL 灭活的的新型冠状病毒灭活疫苗(Vero 细胞)浓缩液,放置37 ℃进行水解,每隔30 min 取样,按最佳条件进行检测,根据峰面积计算BPL 含量,并绘制含量与时间的变化曲线。
1.6.3 疫苗原液中BPL 残留量的检测 取连续3批新型冠状病毒疫苗(Vero 细胞)原液,与乙腈按1 ∶1的比例混合后,采用最佳条件进行检测,计算疫苗原液中BPL 的残留量。
2 结 果
2.1 方法的优化 升温程序和等温程序BPL 峰出峰时间分别为5.163 和2.318 min,分离度分别为16.2 和 8.0。1 和 3 mL / min 流速检测的 BPL 峰拖尾因子分别为1.74 和1.34,分离度分别为8.6 和8.2。1 和0.2 μL 进样检测的BPL 峰拖尾因子分别为1.74和0.79,分离度分别为8.6 和5.8。因此确定该检测方法的最佳检测程序为等温程序,流速为3 mL/min,进样量为 0.2 μL。
2.2 方法的验证
2.2.1 专属性 337 μg /mL 的 BPL 对照品溶液的乙腈峰及BPL 峰保留时间分别为1.185 和2.318 min,分离度为7.96。混合样品的乙腈峰和BPL 峰的保留时间分别为1.197 和2.328 min,分离度为2.14,且BPL 峰保留时间与BPL 对照品溶液一致。见图1。表明该方法能特异性检测新冠原液中的BPL 残留。

图1 BPL 的气相色谱检测图谱Fig.1 Gas chromatogram of BPL
2.2.2 重复性 BPL 对照品溶液连续进样6 次后,峰面积和保留时间的RSD 分别为1.3%和0.063%,均≤4.0%,见表1。表明该方法具有良好的重复性。
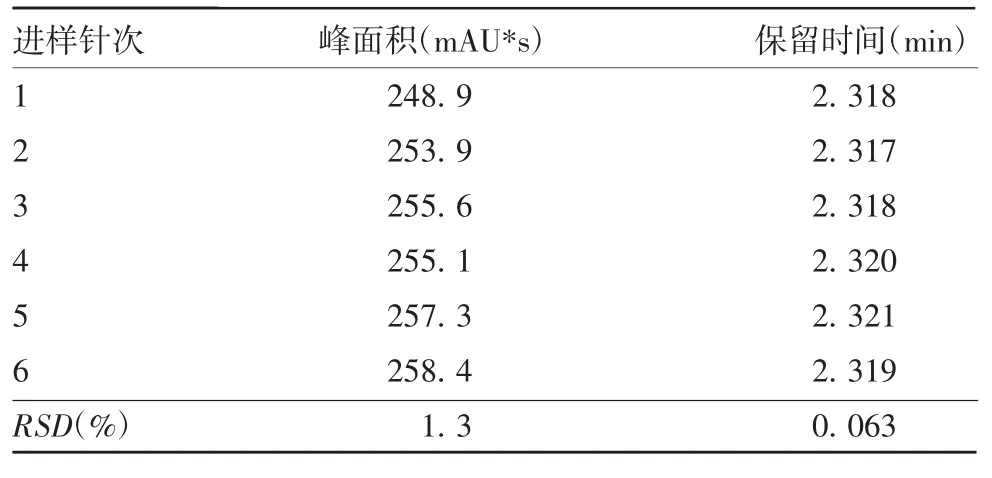
表1 重复性验证结果Tab.1 Verification for reproducibility
2.2.3 耐用性 BPL 对照品溶液在不同检测器温度及进样口温度条件下检测,峰面积和保留时间的RSD 分别为0.4%和0.036%,均 ≤ 4.0%,见表2。表明检测器温度及进样口温度对试验结果无明显影响。

表2 耐用性验证结果Tab.2 Verification for durability
2.2.4 线性范围 BPL 对照品溶液标准曲线见图2。BPL 对照品溶液在 3.125 ~ 500 μg / mL 浓度范围内,峰面积与浓度呈良好的线性关系,回归方程为y = 1.399 1 x - 0.558 6,r 为 0.999 9。
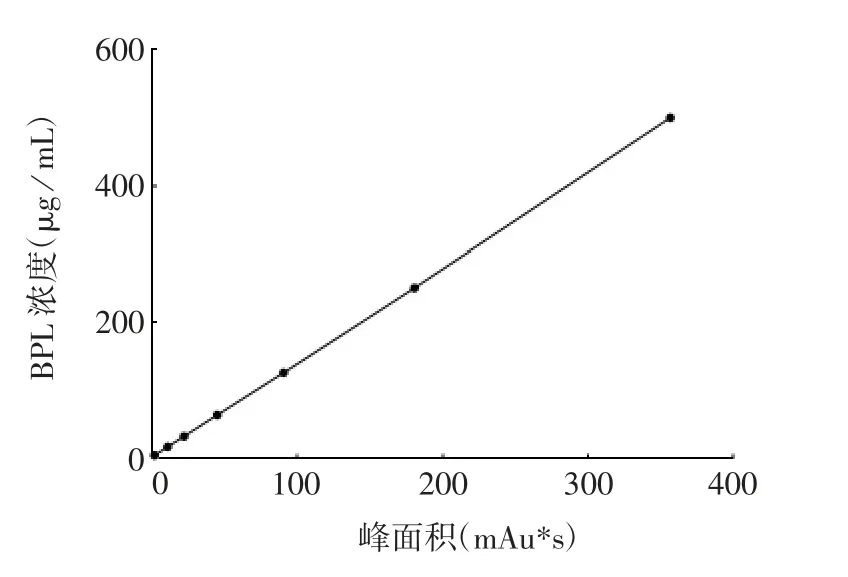
图2 气相色谱法检测BPL 含量的标准曲线Fig.2 Standard curve for determination of BPL content by gas chromatography
2.2.5 定量限及检测限 信噪比为10 ∶1 时,获得方法的定量限为2.530 μg/mL,峰面积为1.795 mAU*s;信噪比为 3 ∶1 时,获得方法的检测限为 0.843 μg /mL,峰面积为0.496 mAU*s。
2.3 方法的应用
2.3.1 疫苗灭活过程中BPL 的含量 于2 ~8 ℃放置0 h 时BPL 含量明显低于实际加入量,证明BPL极易水解的特性,BPL 的含量随着时间逐渐降低,水解速度逐渐趋于平缓,水解48 h 后,含量高于定量限,见图3。表明BPL 加入量可保障病毒在48 h 内的持续灭活。

图3 灭活过程中BPL 含量的变化趋势Fig.3 Change trend of BPL content during inactivation
2.3.2 疫苗水解过程中BPL 的含量 BPL 在37 ℃水浴环境中逐渐水解,30 min 后其含量低于定量限,120 min 后远低于检测限,见图4。
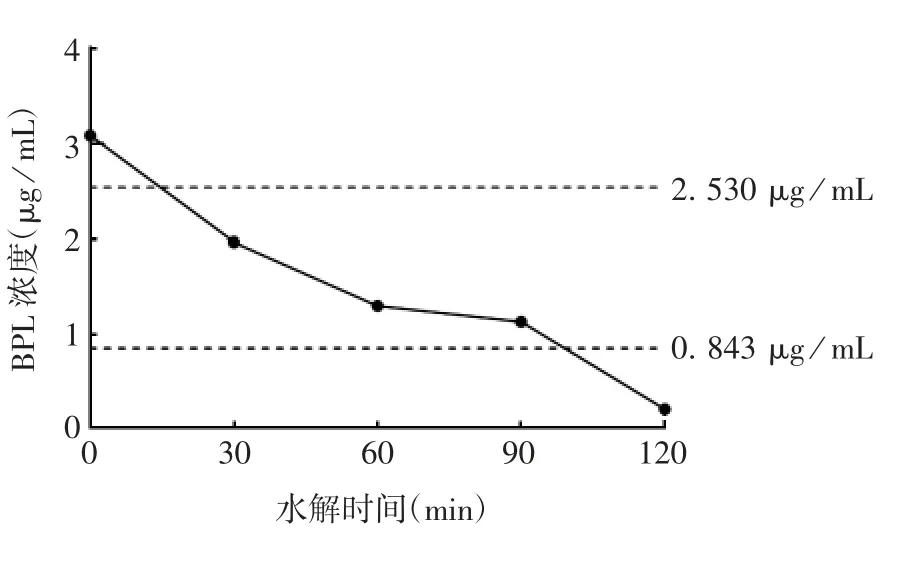
图4 水解过程中BPL 含量的变化趋势Fig.4 Change trend of BPL content during hydrolysis
2.3.3 疫苗原液中BPL 的残留量 3 批新型冠状病毒疫苗(Vero 细胞)原液中均未检测到BPL 峰,表明原液中BPL 含量远低于该方法的检测限0.843 μg/mL,原液中几乎无BPL 残留。
3 讨 论
20 世纪50 年代,BPL 是生产丙烯酸的一种重要的商业化学品,也用于外科器械、血浆、组织移植、牛奶、水、培养基和酶的消毒。由于其具有良好的杀孢作用,被用于杀灭细菌、病原真菌和病毒[12-14]。《中国药典》三部(2015 版)[15]的冻干人用狂犬病疫苗(Vero 细胞)制备要求中规定,对狂犬病病毒浓缩液的灭活按1 ∶4 000 比例加入BPL。武汉生物制品研究所有限责任公司在新型冠状病毒灭活疫苗(Vero细胞)前期研发中设立了4 个不同的BPL 工作浓度,即 1 ∶1 000、1 ∶2 000、1 ∶4 000 及 1 ∶8 000,其中 1 ∶1 000 及 1 ∶2 000 在疫苗灭活过程中会引起抗原含量损失,1 ∶4 000 及 1 ∶8 000 对抗原影响较小,考虑到新型冠状病毒属于生物安全3 级以上病原微生物,且《中国药典》三部(2015 版)[15]人用疫苗总论规定,灭活工艺参数应至少为彻底灭活参数的2 倍,因此,本公司最终设定新型冠状病毒灭活疫苗(Vero 细胞)的灭活剂浓度为 1 ∶4 000,2 ~8 ℃条件下灭活时间不少于48 h,确保生产和接种的安全性。
新型冠状病毒其活毒操作均需在生物安全3级及3 级以上实验室中进行,本研究实验环境无法直接检测病毒浓缩液实际灭活过程中BPL 的含量变化,因此采用模拟灭活的方法间接检测疫苗灭活及水解过程中BPL 的含量变化,结果显示,按1 ∶4 000加入BPL,其含量在整个灭活过程中均高于定量限,于37 ℃水解2 h 后,BPL 含量低于方法的检测限。浓缩液经BPL 两次灭活、两步层析纯化后所得原液中无法检测到BPL 峰,表明原液中几乎无BPL 残留,符合安全生产需求及疫苗灭活剂残留标准的质量要求。
综上所述,本研究建立的气相色谱法操作简单、检测时间短、效率高、专属性强、重复性好,可满足疫苗中BPL 残留的检测需求。
