LncRNA MEG3对人脑胶质瘤细胞增殖、侵袭及凋亡的影响
2021-04-09郗玉巧王少华杨金亮杨铁牛张永亮胡启飞
李 佳,郗玉巧,王少华,杨金亮,杨铁牛,张永亮,胡启飞
目前全世界范围内,高发病率、复发率及致死率的恶性脑胶质瘤是成人中最常见的中枢神经系统肿瘤。其治疗手段是显微外科手术联合放化疗,但总体预后仍较差,绝大多数患者在术后2年内死亡,5年生存率不足5%。因此,肿瘤发生发展相关分子作用机制的研究和阐明,成为当前治疗胶质瘤的主要研究方向。而能抑制肿瘤细胞增殖、侵袭能力及加速其凋亡的抑癌基因无疑是这方面研究的重点。长链非编码RNA(long non-coding, LncRNA)是一类不具备编码蛋白功能的RNA分子,近年来文献报道许多LncRNA在恶性肿瘤发生发展中参与调控其增殖、侵袭、凋亡等生物行为 。母系表达基因3(maternally expressed gene 3, MEG3)作为LncRNA 的成员之一,已有文献报道其具有抑癌功能,在多种恶性肿瘤中出现缺失或表达水平下降,而肿瘤细胞中的LncRNA MEG3高表达,可以抑制肿瘤细胞的增殖能力。但目前LncRNA MEG3对脑胶质瘤生物学功能影响报道较少。该研究旨在探讨其对脑胶质瘤细胞增殖、侵袭及凋亡的影响。
1 材料与方法
1.1 主要材料
安徽医科大学第二附属医院神经外科收集了人正常脑组织细胞;人脑胶质瘤细胞株U251购自上海科学院细胞库;培养基DMEM、胎牛血清、胰酶消化液均购自美国Hyclone公司;RNA提取试剂盒、逆转录试剂盒、脂质体Lipofectamine 2000及qRT-PCR试剂盒均购自美国 Invitrogen公司;RIPA裂解液、BCA蛋白定量试剂盒均购自上海碧云天生物技术有限公司;抗体购自北京中杉金桥公司,包括一抗:兔抗人MDM2、 p53,羊抗人GADPH多克隆蛋白抗体;二抗:辣根过氧化物酶标记的兔抗羊IgG、羊抗兔 IgG;MTT及细胞凋亡试剂盒均购自上海碧云天生物技术有限公司;pCI真核表达载体购自上海艾博思生物科技有限公司。1.2 方法
1.2.1
RNA提取与RT-PCR检测细胞中LncRNA MEG3表达变化 将组织和细胞匀浆后,根据试剂盒操作步骤,采用 TRIzol法提取细胞总RNA,并使用反转录试剂盒合成cDNA。以cDNA模板进行PCR 反应扩增,LncRNA MEG3引物序列:F:5′-ATCATCCGTCCACCTCCTTGTCTTC-3′,R:5′-GTATGAGCATAGCAAAGGTCAGGGC-3′;内参GADPH引物序列:F:5′-AGCAAGAGCACAAGAGGAAG-3′,R:5′-GGTTGAGCACAGGGTACTTT-3′。应用荧光定量PCR仪7900型软件进行定量检测,利用2公式所得到的数值来衡量LncRNA MEG3 mRNA的表达强度。1.2.2
质粒载体构建与细胞转染 将PCR扩增的LncRNA MEG3 cDNA序列亚克隆到pCI真核表达载体中,进而构建成pCI-MEG3过表达质粒。U251细胞培养:在DMEM 培养液(含10U/L青霉素、10%灭活的胎牛血清、100 mg/L链霉素)中常规培养,且培养箱为37 ℃恒温,5% CO的饱和湿度。用0.25%胰酶每2 d消化传代一次。U251细胞处于对数生长期时消化处理并离心(5 min、1 000 r/min),加入适量DMEM 培养基(仅含胎牛血清、无抗生素)并计数,在培养瓶中按 5×10/ml密度接种。接种24 h左右待细胞长至培养板80%以上时进行转染。将U251细胞随机分3组,前两组用脂质体 Lipofectamine 2 000分别转染pCI-MEG3组和pCI组,Control组加入 PBS。经过转染48 h后,利用qRT-PCR检测3组细胞中 LncRNA MEG3 mRNA的表达量,方法参照上述1.2.1。1.2.3
Western blot检测U251细胞中LncRNA MEG3相关蛋白表达变化 用胰酶消化转染 48 h后的3组U251细胞,预冷的PBS轻轻晃动清洗 3次,PBS弃净,RIPA裂解细胞,提取3组细胞总蛋白,并进行蛋白定量(BCA法)。然后根据SDS-PAGE上样电泳将3组蛋白转膜(PVDF膜)处理,并用封闭液(含5%脱脂牛奶的 TBST 溶液)室温封闭2~3 h,一抗孵育12 h,二抗孵育2 h。按照Super Signal West Pico Chemiluminescent Substrate Kit曝光显影,使用Syngene Bio Imaging 软件进行图像分析。1.2.4
MTT检测细胞生长情况 将转染后的3组U251细胞接种于96孔板,接种密度为1×10/孔,进行常规培养。分别培养0、12、24、48 h后,弃去培养基,加入MTT(5 mg/ml)10 μl/孔,37 ℃ 继续孵育,4 h后终止培养,吸弃孔内培养液,每孔再加入分析纯的DMSO 150 μl,放置酶标仪振荡 5 min,用分光光度计测定492 nm下的吸光度值A。纵坐标为细胞存活率,横坐标为时间,绘制细胞生长曲线。1.2.5
细胞克隆技术检测细胞增殖情况 将转染后的3组U251细胞接种于6孔板,接种密度约为200个/孔,加入培养液1.5 ml/孔,放入培养箱继续培养。每2 d换一次液,观察细胞生长状态。7 d后吸弃培养液,每个孔内放入多聚甲醛(4 %)1 ml固定30 min后,吸弃固定液,每个孔内加入洁净的吉姆萨染料0.5 ml染色细胞大约25 min。小心弃去孔中的染料,将6孔板竖直缓慢在自来水中反复漂洗数次,静置晾干,置于显微镜下拍照并进行图像分析。1.2.6
Transwell技术检测细胞侵袭情况 配置基质胶与无血清培养基比例为1 ∶3的配置液,取50 μl配置溶液加至Transwell小室聚碳酸酯膜的上室面,置于37 ℃、5% CO培养箱内,慢慢风干直至呈凝胶状态。将转染后的细胞制备单细胞悬浮液,显微镜下观察并计数,取约1×10个细胞,200 μl无血清培养基加入Transwell小室上室,下室中加入500 μl 含胎牛血清培养液,置于37 ℃、5% CO培养箱内培养,48 h后,取出小室,并用PBS轻轻漂洗2次,再进行30 min的甲醇固定,适当风干后,无菌棉签轻轻擦去上室底部膜表面上的细胞,保留下室的细胞,结晶染液染色 15 min,在显微镜下计数。1.2.7
流式细胞技术检测细胞凋亡情况 3组U251细胞转染48 h后,收集各组细胞,用PBS洗涤2次后加入 binding buffer(500 μl),加入5 μl Annxine-FITC 和5 μl Propidiumlodide,轻轻吹打混匀,避光室温孵育30 min,上机(BD流式细胞仪)检测细胞凋亡。
2 结果
2.1 qRT-PCR检测正常脑组织细胞(N)和U251细胞LncRNA MEG3基因的表达
qRT-PCR结果显示,在mRNA水平上胶质瘤 U251细胞系中LncRNA MEG3的表达量低于正常脑组织细胞(N),提示LncRNA MEG3在胶质瘤U251细胞系中低表达。2.2 qRT-PCR检测U251细胞LncRNA MEG3基因表达变化
细胞转染48 h后,qRT-PCR检测LncRNA MEG3转染效果显示, pCI-MEG3组LncRNA MEG3的表达水平高于Control组(t
=9.96,P
<0.01)和pCI组(t
=9.22,P
<0.01),差异有统计学意义。见图1。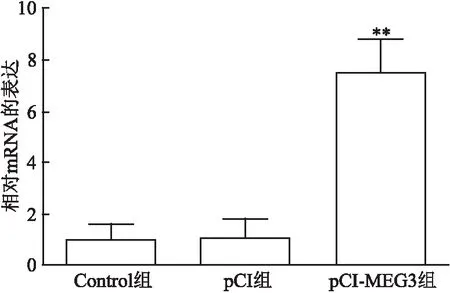
图1 转染后各组胶质瘤U251细胞LncRNA MEG3的表达情况与Control组和pCI组比较:**P<0.01
2.3 Western blot检测U251细胞 LncRNA MEG3相关蛋白表达变化
Western blot 结果显示,3组内参GADPH蛋白的表达相近, pCI-MEG3组MDM2蛋白表达低于Control组(t
=2.18,P
<0. 05)和pCI组(t
=2.29,P
<0. 05),p53蛋白表达高于Control组(t
=2.65,P
<0. 05)和pCI组(t
=2.50,P
<0. 05),差异有统计学意义。见图2。
图2 转染后各组胶质瘤U251细胞MDM2和p53蛋白的表达情况与Control组和pCI组比较:*P<0.05
2.4 MTT法检测LncRNA MEG3基因对U251细胞增殖的影响
MTT实验结果显示,与Control组和pCI组比较,pCI-MEG3组在转染12 h后细胞生长无显著差异。转染24 h后,与Control组和 pCI组比较,pCI-MEG3组细胞生长受抑制,差异有统计学意义 (F
=10.72,P
<0. 05);转染48 h后,与Control组和 pCI组比较,pCI-MEG3组细胞生长明显受抑制,差异有统计学意义 (F
=17.94,P
<0. 01)。见图3。
图3 转染后各组胶质瘤U251 细胞在不同时间点增殖生长的情况与Control组和pCI组在同一时间点比较:*P<0.05,**P<0.01
2.5 细胞克隆实验检测LncRNA MEG3基因对U251细胞增殖的影响
将细胞克隆后的6孔板在显微镜下观察。1周后在显微镜下观察3组细胞克隆增殖情况,与Control组和 pCI组比较,pCI-MEG3组细胞增殖低于Control组(t
=12.08,P
<0. 01)和 pCI组(t
=10.95,P
<0. 01),差异有统计学意义。见图4。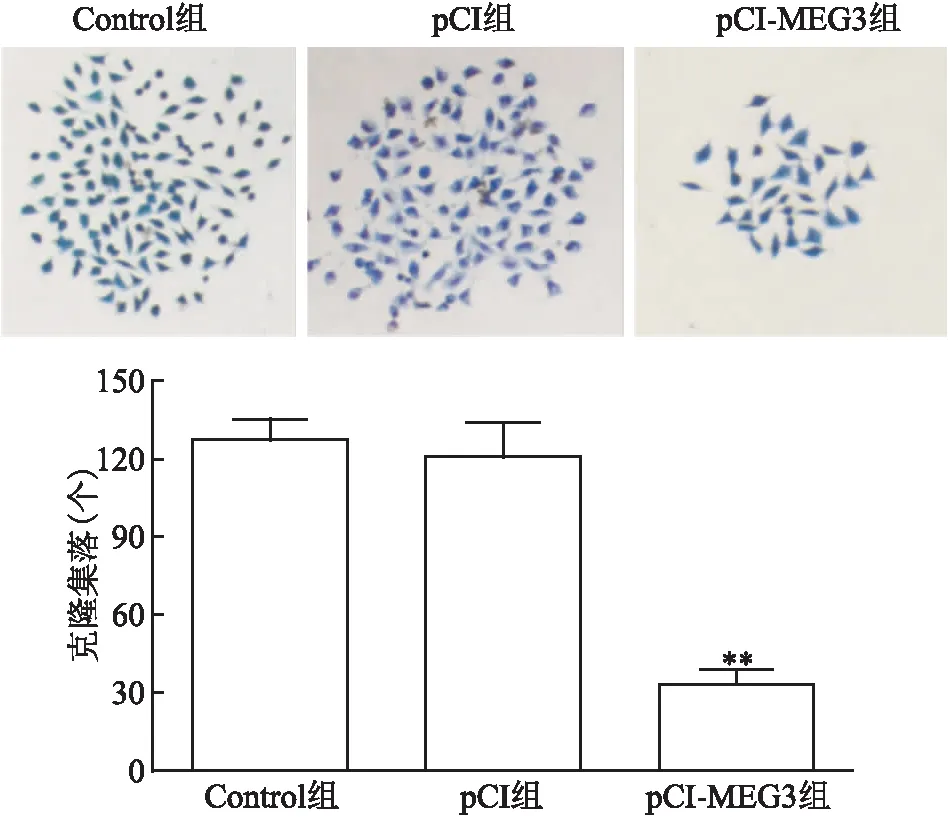
图4 转染后各组胶质瘤U251细胞克隆增殖的影响情况 ×100与Control组和pCI组比较:**P<0.01
2.6 Transwell实验检测LncRNA MEG3基因对U251细胞侵袭的影响
Transwell实验结果显示,细胞培养 48 h 后,在显微镜下计数3组细胞中下室细胞的数量。pCI-MEG3组细胞数低于Control组(t
=9.44,P
<0. 01)和pCI组(t
=9.63,P
<0. 01),差异有统计学意义。见图5。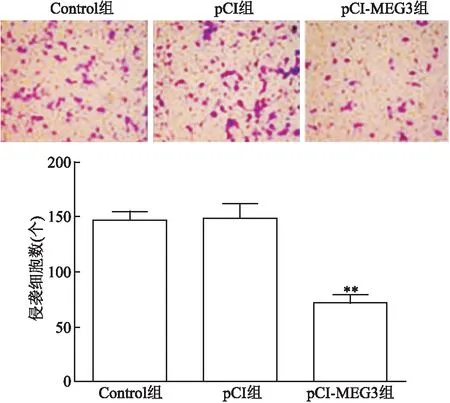
图5 转染后各组胶质瘤U251细胞侵袭能力的影响情况 ×400与Control组和pCI组比较:**P<0.01
2.7 流式细胞术检测LncRNA MEG3基因对U251细胞凋亡率的影响
流式细胞术检测结果显示,细胞培养48 h后,pCI-MEG3组细胞凋亡率高于Control组(t
=13.17,P
<0.01)和pCI组(t
=13.88,P
<0.01),差异有统计学意义。见图6。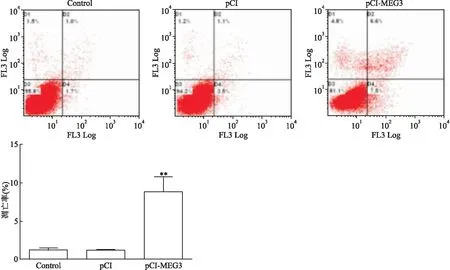
图6 转染后各组胶质瘤U251细胞凋亡的影响情况与Control组和pCI组比较:**P<0.01
3 讨论
LncRNA MEG3位于人类染色体14q32.3位点,是一个全长约为1 700个核苷酸的母源性印记基因,它也是第一个被发现具有肿瘤抑制作用的 LncRNA。LncRNA MEG3在许多正常组织中高表达,而在包括肺癌、肝癌、鼻咽癌、卵巢癌等多种恶性肿瘤组织中低表达甚至不表达。近几年有研究表明LncRNA MEG3在不同分期和组织学分级肿瘤中的表达存在差异,在肿瘤细胞的增殖、迁移、侵袭和凋亡等生物行为中扮演重要角色,在临床上和患者预后密切相关。因此,目前LncRNA MEG3常被临床研究上选择作为抗肿瘤药物的重要分子靶点,是控制基因治疗可行性的关键因素之一。而启动子或基因间差异甲基化区域的超甲基化可能是导致肿瘤细胞中LncRNA MEG3低表达或表达丢失的主要原因。同时,有学者在文献中提出肿瘤细胞中的LncRNA MEG3高表达,可以抑制肿瘤细胞的增殖能力,且LncRNA MEG3抑制细胞增殖能力和诱导细胞凋亡部分原因可能是通过抑制MDM2的表达,随后激活p53信号途径。
该研究借助LncRNA MEG3过表达重组质粒载体转染人脑胶质瘤细胞的体外实验,来增加细胞内LncRNA MEG3基因表达量,随后探讨其对人脑胶质瘤细胞增殖、侵袭及凋亡的影响。研究结果显示,在mRNA水平上胶质细胞中LncRNA MEG3的表达量明显低于正常脑组织细胞,提示LncRNA MEG3可能是脑胶质瘤的一个潜在独立的诊断标志。同时,研究结果表明LncRNA MEG3基因的异常表达与胶质瘤发生、发展关联紧密,过表达细胞中LncRNA MEG3基因后,可以抑制人脑胶质瘤细胞的增殖和侵袭能力,同时增加其凋亡率,这为脑胶质瘤临床基因治疗提供了新的思路和理论依据。
然而对于LncRNA MEG3基因仍存在许多问题需要进一步探讨和研究,如胶质瘤细胞中LncRNA MEG3基因的确切调控机制和调控路径、LncRNA MEG3基因与胶质瘤发生发展相关的其他基因之间的相互作用及与LncRNA MEG3基因相关的体内实验结论等。进一步深入研究这些问题,能够为在基因水平上寻找新的分子靶向治疗方案奠定理论基础。
