代谢组学在胶质母细胞瘤相关研究中的应用
2021-03-22龚俊杰刘秀秀张璐璐
龚俊杰,刘秀秀,王 平*,张璐璐*
1浙江工业大学药学院,浙江 杭州 310014;2南京医科大学药学院,江苏 南京 211166
随着高通量检测技术的发展和数据分析方法的建立,代谢组学应运而生,在疾病的研究中逐渐受到重视。代谢组学位于组学下游,相比于转录组学和蛋白组学能更加直观、准确地反映体内在生理或病理状态下的代谢变化,是基因表达调控和蛋白执行功能在代谢水平上的最终体现。近年来,代谢组学在人类常见的肿瘤如肺癌、肝癌和胃肠道癌等研究领域得以广泛应用,并在揭示其病理机制的研究中做出了重要的贡献[1-3]。结合本课题组前期的工作发现,作为神经血管单元(neurovascular unit,NVU)的重要组成部分神经元、星形胶质细胞以及血管内皮细胞之间存在密切的相互调控关系,例如血管内皮细胞的功能异常会损害海马神经元的结构导致动物认知功能障碍,星形胶质细胞的功能异常会加剧神经元的异常放电诱导癫痫发生等,据此我们有理由相信维持神经胶质细胞的稳态对于神经血管单元的结构和功能同样具有重要意义[4-5]。换而言之,神经胶质细胞的异常增殖形成的神经胶质瘤将严重影响脑功能甚至威胁人类的生命。基于以上两点,本文重点探讨代谢组学在治疗较为困难且预后较差的胶质母细胞瘤中的应用。
1 代谢组学概述
代谢组学(metabonomics)的概念最早在1999年被提出,它是研究生物体在生理、病理状态时或外界理化因子刺激下内源性代谢物质的整体特征及其变化规律的一门学科[6]。其核心任务是通过高通量检测平台鉴定能够反映生物表型的生物标志物和利用模式识别将生物标志物与生物学功能进行关联。代谢组学从研究特点上分为靶向代谢组学和非靶向代谢组学,在肿瘤生物标志物研究中使用较多的是非靶向代谢组学,其特点是无偏向的检测样本中所有能检测到的代谢物分子,对代谢物进行相对定量,通过生物信息学方法进行差异分析和通路分析,寻找具有显著生物学意义的生物标志物。代谢组学的研究对象主要包括体液(如血液、尿液、脑脊液等)、细胞、组织等生物系统中所有小分子量(<1.0~1.5 kDa)内源性代谢物的完整集合,例如碳水化合物、脂质、氨基酸、小分子肽以及维生素等[7]。值得强调的是,科学的样本收集是确保待检样本的代谢特征能准确表征生物性状或表型的前提,因此能否快速实现取材部位的代谢淬灭和能否做到精准取材以及样本制备的方法学是否可靠是确保代谢组学研究意义的关键所在,最终的目的是代谢组学的结果能更符合肿瘤本身的代谢特征[8-9]。
核磁共振波谱(nuclear magnetic resonance,NMR)和高效液相色谱/气相色谱⁃质谱联用(high performance liquid chromatography/gas chromatogra⁃phy⁃mass spectrometry/ mass spectrometry,HPLC/GC⁃MS/MS)是代谢组学常采用的两种检测技术。核磁共振波谱技术包括氢谱(1H⁃NMR)、碳谱(13C⁃NMR)以及二维谱(2D⁃NMR)等检测类型,主要提供代谢物的碳骨架和氢原子环境等化学结构相关信息,该技术具有样本制备量少、可重复性好、样本物态(液体、固体、半固体)选择灵活等优势[7]。将核磁共振的波谱学特征与核磁共振的影像学特征相结合发展出磁共振波谱成像(magnetic resonance spectro⁃scopic imaging,MRSI)技术,该技术在代谢组学相关研究中被广泛应用,尤适合在体研究脑部疾病(如脑部肿瘤、阿尔茨海默症等)的代谢规律[10-11]。高分辨魔角旋转核磁共振波谱(high resolution magic an⁃gle rotation⁃NMR,HRMAS⁃NMR)是NMR 在代谢组学领域广泛应用的代表性技术,已成为一种以非破坏方式直接分析生物样本的重要手段,尤适合分析半固体状的生物组织样本(如组织、细胞等),可以有效避免分子运动受限以及磁化率不均匀引起的谱线增宽,提高代谢物检测分辨率[12]。
质谱主要提供代谢物相对分子质量等信息,具有检测范围宽泛、灵敏度高、专属性强等优点。在代谢组学的研究中,质谱通常与液相色谱、气相色谱联用,充分发挥色谱对复杂生物代谢物样本的前期分离作用,有利于后续更有针对性的质谱检测。相比于常规色谱,超高效液相(ultra performance liq⁃uid chromatography,UPLC)使用超高压输液泵和小孔径固定相颗粒,提高用于检测的代谢组学样本成分的分离度,从而达到更好的分辨率[13]。高效毛细管电泳(high performance capillary electrophoresis,HPCE)则适合高极性和带电代谢物的分离,并且能与质谱实现联用[14]。另外,质谱串联(tandem mass spectrometry)适合进行代谢通量分析,旨在揭示复杂生化网络中的代谢反应速率,是代谢组学研究领域一种新的实验方法[15]。质谱成像(imaging mass spectrometry,IMS)被用于研究复杂生物样本中代谢物的空间分布,该技术已广泛应用于组织中脂质、糖类等物质的成像,有助于更好地呈现细胞内重要物质的分布情况[16-17]。
此外,代谢产物的鉴定和定量能够让我们了解生物体代谢情况,但不能反映它们之间相互流通和转化等信息。稳定同位素(如13C)标记技术能够在体内监测和追踪细胞内的代谢反应,有助于揭示某种代谢产物的来源或去向,使人们更好地了解病理以及生理状态下的代谢规律的动态变化[18]。
代谢组学研究趋向于整合化、定量化、标准化方向发展,特别是规范的代谢组学数据分析备受关注。代谢组学仪器平台能够对肿瘤样本内成百上千个代谢物进行高通量检测,产生庞大且多维度的代谢谱数据,必须应用多元统计学等学科方法对数据进行降维或聚类分析,以便能宏观上把握复杂的数据,从而更有效地挖掘信息。代谢组学数据处理的主要流程包括数据归一化、模型构建、模型评价、差异代谢物筛选和代谢通路富集分析。其中模型构建是对多元变量统计分析的关键步骤,主要方法包括无监督的主成分分析法(principal component analysis,PCA)和有监督的偏最小二乘法判别分析法(partial least squares discriminant analysis,PLS⁃DA),目的是对代谢组学的高维数据进行降维处理。前者适用于分类信息未知的样品,反映不同组别间自然的聚类趋势,在代谢组学中主要用于质控评价或分组。后者是代谢组学使用较多的方法,强调自变量对因变量的解释和预测作用,去除对回归无益噪声的影响,使分类模型包含最少的变量数,为避免模型因过拟合而造成的预测作用不佳,还要对模型进行反复验证以使模型具有更高的可靠性。
综上,代谢组学拥有一套完整的方法体系,其工作流程如图1所示。相比于其他组学(基因组学、转录组学、蛋白组学),代谢组学位于组学终端,代谢产物的变化往往更能代表肿瘤细胞内发生的各种生理生化反应的整体信息和最终结果,被认为是反映生物表型最有效的分子,能为肿瘤的机制研究、药物靶标发现、生物标志物研究和临床诊疗等提供更多有价值的信息。
2 胶质母细胞瘤与代谢异常机制
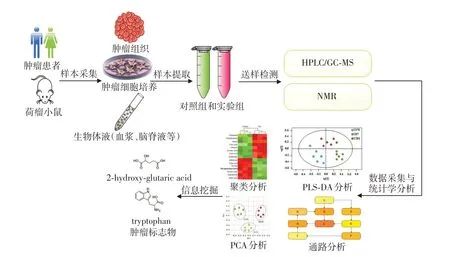
图1 代谢组学工作流程图Figure 1 Working flowchart of metabolomics
神经胶质瘤是最常见的脑部恶性肿瘤,约占脑部恶性肿瘤的80%,其中胶质母细胞瘤(glioblasto⁃ma,GBM)属于神经胶质瘤中的级别最高的分型(Ⅳ级),恶性程度相对较高,治疗后的5 年生存率仅为2%[19]。目前,GBM 的治疗多采用手术切除癌灶再辅助放化疗的策略[20]。替莫唑胺(temozolomide,TMZ)是目前胶质瘤治疗的一线药物,临床试验表明接受放疗联合TMZ治疗的患者的中位生存期明显长于仅接受放疗的患者[21]。另外,合用TMZ能延长神经胶质瘤患者手术后的生存期[22]。亚硝基脲类烷化剂如卡莫司汀(carmustine)、洛莫司汀(lomustine)等,常单用或与其他化疗药物如甲基苄肼(procarba⁃zine)和长春新碱(vincristine)等组成联合化疗方案应用于恶性胶质瘤的治疗[23]。另外,靶向血管内皮生长因子(vascular endothelial growth factor,VEGF)的重组人单克隆IgG1 抗体贝伐珠单抗(bevacizum⁃ab)是目前唯一获美国FDA批准的GBM分子靶向药,它通过抑制肿瘤血管新生而发挥抗肿瘤效应[24]。
代谢失调是细胞癌变的重要标志之一,该特征在GBM中也得到充分体现,推测其原因可能是肿瘤细胞为更好维持其在体内的生存、增殖和侵袭所做出的适应性调整,包括对细胞内糖类、谷氨酰胺、脂质、核苷酸等重要物质进行的代谢重编程(metabol⁃ic reprogramming)[25]。因此,解析其异常的代谢机制是阻止肿瘤发生发展,提高治疗收益以及改善预后的关键所在。Marin⁃Valencia等[26]研究表明,通过18F⁃脱氧葡萄糖正电子发射断层成像(18F deoxyglu⁃cose⁃positron emission tomography,18FDG⁃PET),证实在GBM中葡萄糖代谢十分活跃,同位素标记显示从葡萄糖衍生的谷氨酸合成谷氨酰胺的生化反应异常活跃是GBM的重要代谢特征,由于谷氨酰胺酶(glutaminase,GLS)水平下调,肿瘤细胞内大量谷氨酰胺不能被代谢而逐渐积累,在缺乏外界供应条件下胞内谷氨酰胺的量也完全满足GBM 细胞生长和增殖的需要,但在缺乏葡萄糖供应的环境中GBM细胞的增殖明显受到抑制,这种现象间接表明了GBM细胞内的谷氨酰胺是过度积累的且细胞对其依赖度不高,而GBM细胞对葡萄糖代谢的依赖则高于谷氨酰胺。Shibao 等[27]对小鼠GBM 干细胞的代谢特征研究后发现,它们会消耗更多的葡萄糖和氧气,产生大量乳酸并保持较高水平的ATP通量,且本身较大依赖氧化磷酸化产能的细胞会响应代谢压力而切换为糖酵解产能模式,证明GBM干细胞的代谢具有异质性和可塑性。三羧酸循环(tricarboxylic acid cycle,TCA)处于物质代谢的中心枢纽,为细胞提供大量能量和产生某些代谢所需的中间产物,是糖类、脂质和某些氨基酸分解代谢最后阶段的共通途径。一般认为,葡萄糖经氧化代谢产生的乙酰辅酶A是进入TCA循环的主要碳源。然而,Maher等[28]的研究得出了相异的结论,他们对人脑部肿瘤的原位代谢状况进行了研究,认为来源于葡萄糖氧化的乙酰辅酶A 不足50%,TCA 循环的初始碳源发生了改变。Mashimo等[29]利用13C标记乙酸盐和葡萄糖,发现在GBM 组织与正常组织中乙酸盐氧化和葡萄糖氧化存在明显差异,正常组织的碳源主要依赖于葡萄糖氧化代谢,而在GBM中乙酸盐氧化代谢和葡萄糖氧化代谢对碳源的贡献相当。因此,在GBM中乙酸盐氧化也是重要的碳源途径。并且,该项研究还发现GBM中存在脂质合成反应异常活跃的现象,具体表现为GBM 中乙酰辅酶A 合成酶2(acetyl coen⁃zyme A synthetase 2,ACSS2)的活性上调,其具有催化乙酸和辅酶A 生成乙酰辅酶A 的功能,下调AC⁃SS2 的表达会抑制GBM 神经球的生长和活力。在此基础上推测,大量的乙酰辅酶A 可能作为原料被源源不断地提供给脂质合成反应,对于满足GBM细胞快速增殖所需的高物质能量需求具有重要意义。最近,Gularyan等[30]利用飞行时间⁃二次离子质谱技术(time of flight⁃secondary ion mass spectrome⁃try,TOF⁃SIMS),实现正常脑组织和肿瘤组织表面特异性分子的可视化成像,从而清晰地观察到GBM组织存在高水平胆固醇积累这一分子特征,进一步证实了GBM发生了脂质代谢紊乱。另外,Wang等[31-32]发现嘧啶和嘌呤的合成在神经胶质瘤干性细胞中异常活跃,表明核苷酸的合成加速,可能与肿瘤高度的增殖性有关。值得注意的是,基因组测序表明,约有77%的继发性GBM患者携带异柠檬酸脱氢酶1(isocitrate dehydrogenase 1,IDH1)突变基因,但在原发性GBM患者中并不常见,仅约为9%[33]。IDH1突变导致GBM 代谢机制异常,IDH1 失去原有正常的催化异柠檬酸生成α⁃酮戊二酸(α⁃Ketoglutarate,α⁃KG)的功能,获得生成2⁃羟基戊二酸(2⁃hydroxyglu⁃taric acid,2⁃HG)这一新的酶活性。2⁃HG 是一种促癌代谢物,2⁃HG 可竞争性抑制α⁃KG 依赖组蛋白去甲基化酶(histone demethylase,HDM)和脯氨酰羟化酶(prolyl hydroxylase,PHD)活性,HDM 与组蛋白甲基化的表观遗传修饰有关,参与调控某些癌症相关基因的激活与抑制,最终影响癌细胞的生长状态[34],后者是低氧诱导因子⁃1α(hypoxia⁃inducible factor⁃1α,HIF⁃1α)降解的调节器,PDH 羟基化HIF⁃1α后招募泛素将其降解,抑制PDH的活性则上调HIF⁃1α诱导的靶基因(GLUT1、VEGF和PDK1)的表达水平,这些靶基因所编码的蛋白均与肿瘤的增殖有关[35]。
综上,GBM的发生发展与细胞代谢异常改变关系密切,其中伴随许多复杂的生物学过程和涉及多种物质代谢的分子机制,解析和明确GBM代谢重编程相关分子机制,对于指导代谢组学方法在GBM诊断、治疗及预后的研究上具有重要意义。
3 代谢组学与胶质母细胞瘤诊断
恶性肿瘤的早期多无症状或无明显发病特征,一般患者处于病变晚期时才易被确诊,因而延误了最佳的治疗时机。鉴于此,肿瘤早期的精准诊断对于肿瘤后期的有效治疗和预后至关重要。关于GBM的诊断,除了常规的问诊、触诊外,还需结合其他诊断学资料,包括测定肿瘤标记物的血清学检查,判断肿瘤形态和性质的影像学检查,以及目前鉴定肿瘤分期和分型相对可靠的病理学检查。然而这些检查手段在GBM 的诊断上都具有一定局限性[36-38]。近年来,代谢组学相关技术在GBM诊断上得到广泛的应用,并具有常规检测手段无法比拟的优势。肿瘤是机体在致癌因子的作用下,细胞内基因发生改变而使细胞获得了无限增殖和异常分化能力所形成的异常新生物。因而,肿瘤细胞内往往发生了代谢重编程,与正常细胞之间存在明显的代谢谱差异,通过比较和分析这种差异,进一步鉴定与肿瘤密切相关的代谢通路或生物标志物,以此区分肿瘤的分型和基因型,准确诊断是肿瘤精准治疗的前提。
Dang 等[39]通过代谢组分析,发现在IDH1(R132H)突变的胶质瘤细胞系和人脑恶性胶质瘤样本中,2⁃HG浓度均显著高于其相对应的野生型和正常人脑样本,这种差异达到数十倍甚至上百倍。显然,2⁃HG 的水平可作为诊断和鉴别携带IDH1 基因突变GBM患者的重要指标。此外,Prabhu等[40]提出一条促进GBM增殖的新代谢途径,即半胱氨酸分解途径。他们发现,高级别GBM与低级别神经胶质瘤比较,半胱氨酸双加氧酶1(cysteine dioxygenase 1,CDO1)表达上调,超高效液相⁃串联质谱(ultra per⁃formance liquid chromatography⁃mass spectrometry/mass spectrometry,UHPLC⁃MS/MS)定量结果表明,CDO1催化产物半胱氨酸亚磺酸(cysteinesulfinic ac⁃id,CSA)水平在GBM 中显著升高,相比于低级别胶质瘤其积累量增加23倍以上。并且发现,暴露于缺乏葡萄糖和丙酮酸的环境下的GBM 细胞系耗氧量降低,究其原因可能是GBM 中CDO1 活性上调,通过加速半胱氨酸的分解使得CSA的合成增加,后者抑制丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)的活性,导致糖酵解产物丙酮酸无法成为TCA循环的底物而被进一步氧化代谢,从而抑制细胞氧化磷酸化产生ATP 的能量代谢过程。因此,CSA 的积累能使丙酮酸进入TCA循环途径受阻,推测肿瘤细胞以代偿性增加有氧糖酵解的方式获取能量,即瓦伯格效应(Warburg effect)。此外,另一代谢产物还原性谷胱甘肽(glutathione,GSH)的水平在高级别胶质瘤中亦表现为升高,GSH可能有助于肿瘤抵抗内源性氧自由基(oxygen free radical,ROS)的胁迫,以此实现细胞内环境的净化,减少氧化损伤引起的凋亡效应对肿瘤细胞的影响,从而促进肿瘤细胞的存活。综上,检测CSA水平一定程度上能够为判别低级别胶质瘤和高级别的GBM 提供参考。另外,Gao等[41]利用毛细管电泳⁃质谱技术(capillary electro⁃phoresis⁃mass spectrum,CE⁃MS)对分级不同的神经胶质瘤样本进行代谢组学研究,发现组织中的亚牛磺酸(hypotaurine,HT)水平与神经胶质瘤的分级呈正相关,癌组织中的HT 含量显著高于癌旁对照组织,HT 具有促进GBM 细胞系增殖和转移的作用。研究表明,HT 与α⁃KG、2⁃HG 三者共享PHD 的结合位点,并且HT 的结合自由能高于促癌代谢物2⁃HG。提示HT 可能是继发现2⁃HG 后又一重要的PHD的竞争性抑制剂,可能机制为HT与α⁃KG竞争性占据同一活性位点而抑制PHD酶活性,增加HIF⁃1α的表达,促进肿瘤血管新生。因此,HT的含量可作为神经胶质瘤诊断的指标之一,并且高水平的HT提示肿瘤具有较高的分级。最近,Yu等[42]基于色谱⁃质谱的代谢组学和脂质组学分析不同级别神经胶质瘤组织以发掘神经胶质瘤分级相关的差异代谢产物,发现恶性程度越高的胶质瘤短链酰基肉碱(short⁃chain acylcarnitines)含量越高,而溶血磷脂酰乙醇胺(lysophosphatidylethanolamines,LPEs)减少。此外,通过分析相关基因和途径,发现与脂肪酸氧化有关的短/支链乙酰基辅酶脱氢酶(Acyl⁃CoA dehydrogenase short/branched chain,ACADSB)的基因表达下调,提示在高级别胶质瘤中脂质代谢发生了明显改变。
4 代谢组学与胶质母细胞瘤治疗
GBM 的治疗目前主要采取手术切除肿瘤组织辅以放射治疗和药物治疗的综合防治策略[20,43]。最近,研究人员从GBM 患者身上获取肿瘤样本,利用单细胞RNA 测序(single cell RNA sequencing,scRNA⁃seq)技术,鉴别出GBM细胞有4种不同的亚型,每种亚型都有自身独特的基因激活程序[44]。Cuperlovic⁃Culf 等[45]对9种GBM细胞系的代谢物进行核磁共振波谱分析,同样也发现不同的GBM细胞系的代谢谱存在差异性,依据代谢谱差异能将9 种GBM细胞系大致分为4类细胞亚群。可见,GBM肿瘤细胞系存在异质性,每种亚型的遗传学特征各异,由此决定了各细胞亚型代谢上的差异性,标准的治疗方案可能难以满足不同病患个性化治疗的需求,肿瘤异质性是GBM治疗面临的潜在困难。此外,GBM 化疗药物替莫唑胺等属于烷化剂,该类药物的药理机制是通过破坏细胞内DNA 的结构和功能,抑制细胞增殖和分裂等而引起细胞死亡。然而,GBM 细胞存在具有DNA 损伤修复功能的O6⁃甲基鸟嘌呤⁃DNA 甲基转移酶(O6⁃methylguanine DNA methyltranferase,MGMT)和DNA合成过程中的核苷酸碱基错配修复系统(mismatch repair system,MMRs),诱导肿瘤细胞在药物治疗过程中产生抗药性,治疗难以达到预期的目标[46]。另外,血脑屏障(blood⁃brain barrier,BBB)是脑瘤治疗药物在脑内扩散的主要障碍,药物难以在病灶区达到合适的血药浓度,影响其疗效的发挥,增加血脑屏障的通透性也是脑瘤治疗必须克服的问题[47]。综上,GBM 的治疗依然面临着肿瘤异质性、肿瘤细胞耐药、脑内给药困难等诸多难题。代谢组学的引入将为GBM 治疗用药相关的疗效评价、耐药性监测、靶标鉴定等科学问题的解决提供一套有力的研究方法。
肿瘤在治疗后病灶缩小和避免肿瘤发生耐药(drug resistance)是肿瘤治疗的理想目标,代谢组学通过检测肿瘤治疗后代谢谱的变化,发现某些小分子代谢物的含量变化在药物疗效评价上具有代表性,能够反映药物对敏感肿瘤的有效性和耐药肿瘤的无效性等信息。St⁃Coeur 等[48]发现,在替莫唑胺耐药的GBM 细胞系中,葡萄糖、柠檬酸和异柠檬酸等代谢物水平升高,而在替莫唑胺敏感的GBM细胞系中,丙氨酸、胆碱、肌酸以及磷酸胆碱等代谢物水平上调。这些结果揭示了特定的GBM 模型具有其对应的代谢特征,此项研究为敏感和耐药的肿瘤表型鉴别提供相关分子标记物参考。Survivin 一种是细胞凋亡抑制蛋白,在恶性脑胶质瘤中发现Sur⁃vivin 蛋白上调,免疫组织化学结果提示在GBM 中的定位为强阳性,并且与GBM 产生耐药性和预后不良有关[49]。Hvinden 等[50]研究了Survivin 蛋白抑制剂YM155 对原发性GBM 干细胞代谢组的影响。结果表明,GBM 干细胞在给予YM155 治疗后,柠檬酸水平在耐药的肿瘤细胞系中明显上调,而乳酸水平则在敏感和耐药的肿瘤细胞中均表现为一致性的下降。因此,通过监测肿瘤细胞内乳酸和柠檬酸含量变化反映GBM 细胞对化疗药物的应答性和耐药性具有一定的指征意义。最近,Chandra 等[51]基于代谢组学研究了贝伐珠单抗诱导的GBM 肿瘤耐药微环境的形成机制,发现GBM 中发生了以糖酵解上调和氧化磷酸化抑制为特征的代谢改变,揭示了GBM 在贝伐珠单抗治疗下营造的肿瘤缺血缺氧微环境中的适应机制,靶向上述生化途径有利于预防肿瘤在接受抗血管生成治疗时耐药性的产生。
肿瘤代谢标志物的鉴定是代谢组学研究的核心任务,同时也是肿瘤诊治的基础。Palanichamy等[52]基于液质联用的代谢组学方法,检测了GBM组织和正常人星形胶质细胞的代谢产物,鉴定出色氨酸、蛋氨酸、犬尿氨酸、5⁃甲基硫代腺苷等4种在GBM细胞中上调的代谢产物,这些差异代谢产物激活了一系列如PI3K、Akt、ERK、p38⁃MAPK 等致癌蛋白激酶,促进异常的肿瘤增殖信号的传递和相关增殖通路的启动。他们发现,相比于正常的星形胶质细胞,GBM 细胞的增殖过程对蛋氨酸更具有依赖性。并且,在GBM 肿瘤细胞中色氨酸⁃犬尿氨酸代谢途径异常活跃,加之缺乏犬尿氨酸相关代谢酶类,犬尿氨酸在肿瘤细胞内显示出进一步积累。目前已证实,犬尿氨酸是肿瘤发生免疫逃逸的关键介质[53]。因此,犬尿氨酸可能是反映GBM治疗效果不甚理想的指征性代谢物。另外,Kesarwani等[54]通过代谢组学研究也得到了类似的结论,GBM中出现色氨酸代谢异常,参与色氨酸代谢的限速酶IDO1和TDO2表达增加,色氨酸⁃犬尿氨酸途径在GBM 中被过度激活,抑制IDO1 酶活性可以显著增强GBM 对放疗的敏感性。综上,代谢组学鉴定的某些代谢产物能够反映肿瘤的状态和患者获得的治疗收益,以此综合评估肿瘤的进展情况,及时调整治疗方案,有利于实现多靶点、多途径、多层次的肿瘤干预。
5 代谢组学与胶质母细胞瘤预后
GBM是神经胶质瘤中恶性程度最高的肿瘤,呈浸润性生长,具有侵袭性,肿瘤组织与周围正常脑组织无明显边界,手术难以全部切除,并且放化疗治疗效果有限,患者的预后通常不甚理想。目前认为,GBM 不同亚型的遗传变异会诱导多种代谢表型,这种代谢异质性解释了不同患者对于目前通用疗法的敏感性存在差异的原因,同时这也为评价患者的治疗获益和肿瘤预后状况提供了参考[55]。此外,GBM 中存在神经胶质瘤干细胞(glioma stem cell,GSC)已得到证实,并与肿瘤的复发息息相关[56]。代谢组学通过识别和鉴定肿瘤预后相关的分子标记物,有助于评估和预测肿瘤的后续发展。
Mörén 等[57]将诊断后存活时间长(≥3 年)的GBM患者和诊断后不久死亡(≤4个月)的GBM患者的肿瘤组织样本代谢谱进行比较,发现3⁃磷酸甘油酯、肌醇、核糖醇和果糖等代谢物的水平与存活时间呈正相关性。Shen 等[58]对数百名GBM 患者的血浆样本进行代谢组学分析以获取预后相关信息,他们在训练集样本中鉴定出与2年无病生存显著相关的10种血浆代谢物,其中精氨酸、蛋氨酸、犬尿氨酸在测试集样本中得到了进一步验证,发现前二者水平升高与2 年总生存率增高相关,而犬尿氨酸的水平则与生存期呈负相关性。Chinnaiyan等[59]基于高通量的液质联用技术对人神经胶质瘤标本进行全局的代谢组学分析,从包含大量纯化标准品的代谢组学文库中比对到308 种代谢物,这些代谢物大部分涉及脂质、氨基酸、糖类等代谢过程,随机森林分类器(random forest,RF)依据代谢谱将神经胶质瘤进行等级区分,发现高级别GBM具有代谢合成加速的特征,具体表现为糖酵解途径代谢物3⁃磷酸甘油酸酯(3⁃phosphoglycerate,3⁃PG)和磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP)显著增加;脂质合成及利用有关的肉碱(carnitine)显著增加;核苷酸合成有关的5⁃磷酸核糖(5⁃ribose phosphate,R5P)、丝氨酸(serine)、甘氨酸(glycine)显著增加。可见,高级别GBM 新陈代谢旺盛,肿瘤处于快速增殖状态。比较发现,此类患者的中位生存期大约为15个月,相比于低级别神经胶质瘤预后较差。最近,Rusu等[60]发现3⁃磷酸甘油酸脱氢酶(3⁃phosphoglyceric acid dehydroenase,GPD1)在休眠的脑肿瘤干细胞(brain tumor stem cell,BTSC)中特异性表达,与化疗后神经胶质瘤的复发有关,代谢组学和脂质组学分析证实,BTSC 中甘油磷脂代谢途径较神经干细胞(neu⁃ral stem cell,NSC)发生了显著的改变。GPD1 是甘油磷脂代谢过程中的重要酶类,参与催化糖酵解产物磷酸二羟丙酮脱氢生成3⁃磷酸甘油,GPD1 过表达或其催化产物的增加预示着GBM 患者不理想的预后状况。另外,该研究还证实了牛磺酸和亚牛磺酸代谢途径在BTSC 中高度富集,途径相关的代谢物也可作为预后评价的参考指标。综上,代谢组学鉴定的某些代谢标志物对于患者的预后状况有很好的评估和预测作用,这对于临床医生判断患者的生存期和后期的随访以了解肿瘤进展情况有重要的指导意义。
6 代谢组学与胶质母细胞瘤药物研发
目前应用于临床的GBM化疗药物品种有限,主要包括以替莫唑胺和洛莫司汀为代表的细胞毒类药物和以贝伐珠单抗为代表的分子靶向药物。细胞毒类药物具有化疗药物常见的胃肠道不良反应以及较为严重的骨髓抑制毒性。贝伐珠单抗因易产生耐药性使得它的疗效十分有限,并且对适用的患者人群具有一定的基因选择性,难以很好发挥分子靶向药物的优势[61]。因此,研发安全有效的新药成为GBM治疗领域的迫切任务。近年来,结合代谢组学方法的药物重定位(drug reposition)即老药新用成为药物研发的重要思路[62]。代谢组学通过监测肿瘤在药物作用后引起的代谢变化,推测药物可能干预的生化反应途径,结合药物已有的药理学和毒理学等基础研究资料,能更加快速地筛选出若干候选药物,并进行深入研究,可以节省药物研发的成本和提高药物研发的成功率。
5⁃脂氧合酶(5⁃lipoxygenase,5⁃LO)抑制剂齐留通(Zileuton)能阻断过敏性介质白三烯(leukotri⁃enes,LT)的合成,用于防治哮喘等过敏性疾病[63]。然而,Morin 等[64]发现治疗GBM 可能是齐留通新的适应证。他们采用核磁共振波谱检测经齐留通处理后的3种GBM细胞系代谢谱的变化,发现在5⁃LO高表达的GBM 细胞系中乳酸和腺苷的含量明显减少,表明齐留通可能通过干扰肿瘤细胞的能量代谢而起到抑制肿瘤细胞增殖的作用。其他研究也提示抑制5⁃LO的活性能够诱导GBM细胞凋亡[65]。因此,齐留通在GBM 的治疗上具有潜在的研发价值,同时也进一步表明代谢组学又是药物研发过程中揭示药物如何影响生化代谢途径的重要手段之一。
7 展 望
代谢组学在GBM 的研究领域具有广阔的应用前景,围绕GBM 的早期诊断、治疗优化、预后评估、药物研发等内容,代谢组学以其独特的研究思路和方法在相关研究中取得了大量成果,但仍然存在很多亟待解决的问题。其一,代谢组学最大的技术瓶颈在于代谢物的鉴定,目前质谱数据分析多依赖于代谢物标准品库的建立,代谢物的图谱很难做到通用性,随着分析平台、检测条件、样本前处理方式的不同均会有一定的差异性。因此,在实际代谢物鉴定工作中,自建适合自身分析条件和要求的标准品库对于代谢组的物质鉴定尤为重要。其二,代谢组学得到的大量代谢分子标志物,但与其相关的生化代谢通路和生理调控机制错综复杂,难以理清其中关系,加之缺乏交叉、多对象、多层次的验证,导致很多成果因缺乏可靠性而不能进行从实验室向临床的转化,研究的价值和意义难以实现最大化。其三,代谢是一个生物体内微妙的动态过程,受到很多生理生化因素的影响,目前代谢组学的研究尚未能实现在体的原位检测,许多来源于离体的GBM细胞系样本、动物GBM 移植样本以及取自患者的GBM 样本均不能很好模拟GBM 在脑内真实的生理生化环境,导致代谢组学获得的信息对GBM 的诊断、治疗、预后等工作发挥的指导作用十分有限。因此,代谢组学未来可能朝着整合化的方向发展,实现代谢组学与其他组学或学科的有机衔接,多组学联合分析和学科间多重交叉验证将为代谢组学的研究证据提供更有力的支撑。另外,为弥补体外研究的不足,自动化和智能化的在体检测也是代谢组学在肿瘤应用上的发展方向。相信随着代谢组学技术的日益成熟和人们对肿瘤的理解不断深入,代谢组学必将在脑部肿瘤疾病发生、发展和预后过程中发挥重要作用,并为创新临床诊疗方案和寻找治疗靶标提供理论依据。
