一种简易、多用途的小鼠固定装置
2021-03-22秦豪男刘星婧丁其瑞魏易凡任永信
秦豪男,刘星婧,丁其瑞,马 成,魏易凡,任永信*
1南京医科大学第一附属医院骨科,江苏 南京 210029;2东南大学附属中大医院内分泌科,江苏 南京 210009
实验动物既是生命科学研究的对象和模型,又是生命科学研究的材料和支撑,无论是在基础理论研究、临床试验,还是在新药和生物制品的生产与检定中都处于不可替代的位置[1]。常用的实验动物有小鼠、大鼠、兔子、犬等,这其中以小鼠应用最为广泛。小鼠通常性情温驯,但被抓取时会反抗,实验者被小鼠抓伤、咬伤情况时有发生,为保证实验者安全,常需要固定装置予以辅助。尾静脉注射、断尾采血、肌肉及膝关节腔内注射是小鼠实验中常用的操作技术[2-4],对小鼠进行有效的固定是操作成功的前提之一。目前,市场上小鼠固定装置多用金属或有机玻璃制成,个人加工制作不易,购买成本较高,且体积较大,重量较重,携带不便。以往文献报道的自制小鼠固定装置或制作较为复杂、易于损坏[5],或无法满足同时固定多只小鼠的需求[6-9]。因此,本课题组自制了一种简易、多用途的小鼠固定装置并应用于实验,发现该固定装置制作简单、实用性强,在操作中对小鼠实现了较好的固定。现将制作及使用方法介绍如下。
1 材料和方法
1.1 材料
60 只8 周龄的SPF 级健康雄性C57BL/6J 小鼠,体重21~23 g,购于常州卡斯文实验动物有限公司[SCXK(苏)2016⁃0010],饲养于南京医科大学实验动物中心[SYXK(苏)2016⁃0015]。将60 只小鼠随机分为对照组及研究组,每组30 只,对照组采用传统固定器固定,研究组则采用自制固定装置固定,先后对小鼠进行尾静脉注射、断尾采血及膝关节腔内注射实验。实验获本校伦理委员会批准(1903009),并按实验动物使用的3R 原则给予人道的关怀。
废弃50 mL 离心管(赛默飞世尔科技公司,美国),4 mL离心管(无锡耐思),15 mL离心管(康宁公司,美国),28 孔多用试管架(深圳南实地科技有限公司),手术刀柄及刀片、酒精灯、1 mL 一次性无菌注射器(江苏苏云),10 μL微量注射器(上海高鸽),0.9%氯化钠注射液(批号19092842,天津中国大冢制药有限公司),浓度1%的甲苯胺蓝染液(广州劳斯生物科技有限公司),外科显微镜、康尼D7100 单反相机。
1.2 方法
1.2.1 固定装置的制作
①取洗净的废弃50 mL 离心管,在其底端和管盖正中分别开一直径约5 mm 的小孔,打磨平滑;底端小孔以作小鼠呼吸之用,管盖小孔以作小鼠尾部操作中鼠尾通道之用(图1A)。50 mL离心管质地较硬,切割前可先用酒精灯行局部加热以降低硬度便于切割。②根据小鼠体重大小,在管壁合适刻度间切割出两个关于离心管中心轴线相对称的直径约为14 mm的圆孔(或正六边形),以能恰好通过4 mL离心管为准(图1B)。本研究采用的是在20~25 mL刻度线之间切割,可同时满足下肢和尾部相关操作的固定要求。③配合4 mL离心管、15 mL离心管、28孔多用试管架(倒置),实验者可根据实验需求组装成“一拖二”、“一拖五”等多种组合的小鼠固定装置(图1C~F)。
1.2.2 固定装置的使用方法
1.2.2.1 小鼠尾静脉注射给药、断尾采血

图1 小鼠固定装置实物及其实际应用Figure 1 The fixation device and its practical application
将固定装置管盖旋开平置于实验台上,从笼盒中取出小鼠,按标准方式左手抓取,然后右手持固定装置(图2A),左手持小鼠身体送入固定装置并用右手顺势封住管口并捏住鼠尾(图2B~C),左手再持离心管盖,将鼠尾由通道中穿出,并旋紧管盖(图2D~E)。随后将固定装置安装至倒置的试管架上(图2F),即可进行小鼠尾静脉注射给药或断尾采血等操作。部分实验如葡萄糖刺激胰岛素分泌实验(glucose⁃stimulated insulin secretion,GSIS)[10]、葡萄糖耐受试验(glucose tolerance test,GTT)和胰岛素耐受试验(insulin resistance test,ITT)[11]等,需要短时间内对较多小鼠按时间点行多次断尾采血,则可采用“一拖五”自制小鼠固定装置(图1D、F),采样前提前固定小鼠,届时只需依次采血即可。
1.2.2.2 小鼠膝关节腔内注射
以膝关节腔内注射为例:右手封住离心管双侧圆孔,左手持已麻醉好的小鼠送入离心管并推至底端(注意将小鼠鼻腔对准管底小孔),旋紧管盖(图3A~C);持镊子轻轻将小鼠下肢从侧壁圆孔中牵出,用拇指和食指固定,并充分屈曲膝关节,定位膝关节腔位置,即可进行膝关节腔内注射(图3D~F)。如需双侧注射,则将已注射下肢回纳,同样方法注射另一下肢。此外,对于单人徒手行小鼠肌肉注射有困难的实验人员,可借助本固定装置辅助固定,方法同上,但由于肌肉注射无需麻醉,右手封住双侧圆孔处应垫硬纸板以保护手指防止咬伤抓伤。
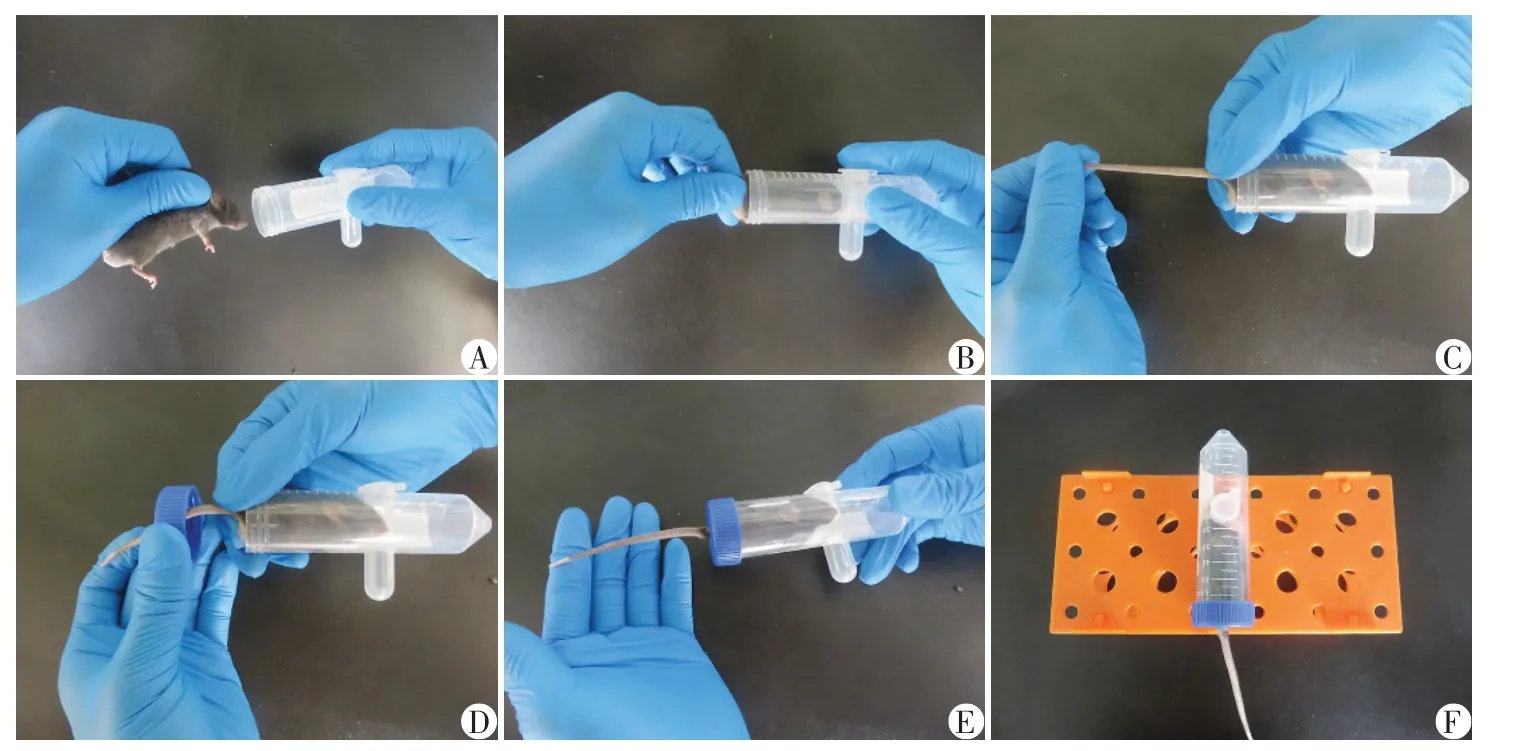
图2 小鼠固定装置使用流程Figure 2 Instruction for use of the fixation device
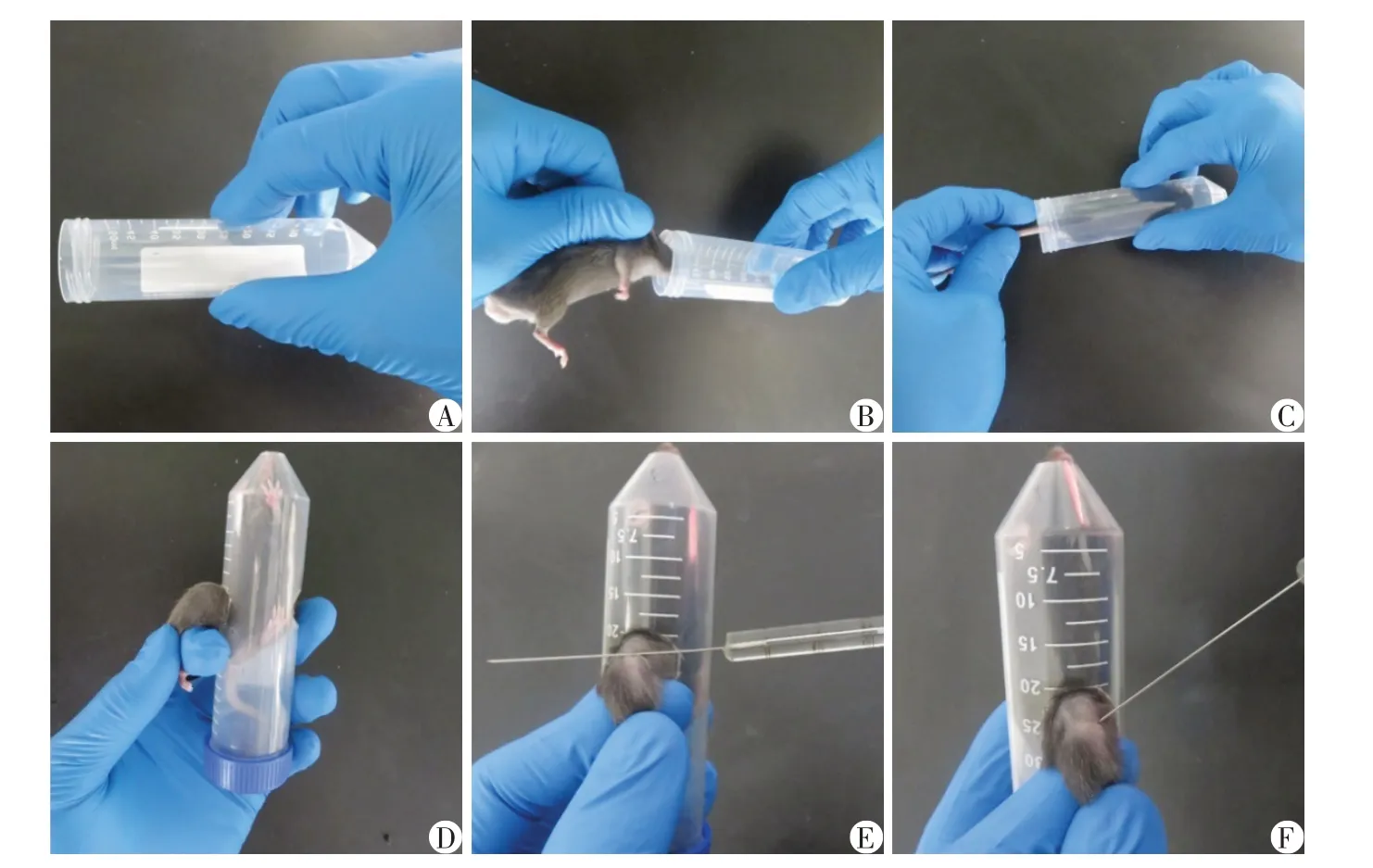
图3 膝关节腔内注射固定方法Figure 3 Procedure of intra⁃articular injection
1.2.3 观察指标
1.2.3.1 操作时间
从将小鼠取出鼠笼开始计时,至注射或采血完成将小鼠放回笼内为止,计时每只小鼠操作时间(尾静脉注射组:注射生理盐水0.3 mL/只;断尾采血组:采血量为0.3 mL/只;膝关节腔内注射组:注射甲苯胺蓝染液10 μL/关节腔,计时注射双侧膝关节总时间,预先麻醉过程及注射后按压时间不计入操作时间内)。
1.2.3.2 成功率
尾静脉注射及断尾采血组:以一次性完整完成上述操作为成功标准;膝关节腔内注射组:以关节囊内软骨组织明显蓝染、且甲苯胺蓝染液无溢出及异位染色为成功标准,成功率以关节计数。成功率=成功注射或采血小鼠数量/该组实验小鼠总数量×100%。
1.2.3.3 膝关节腔内注射的稳定性及可重复性
采用甲苯胺蓝染液进行膝关节腔内注射,对比传统单纯手法固定与该自制固定装置固定,染料在关节腔内的分布情况,验证自制固定装置关节腔内微量注射的稳定性与可重复性[12]。麻醉小鼠后备皮消毒,采用相应固定方法予以固定,用拇指和食指固定并充分屈曲膝关节,定位膝关节腔位置,应用微量注射器以髌韧带内缘中点为进针点,顺关节间隙方向约1.5 mm 深度注射甲苯胺蓝染液入关节腔,拔针后稍用力加压针眼处2 min。取膝关节正中纵向皮肤切口,长约2 cm,暴露关节囊观察染液充盈情况。处死小鼠后,切开关节囊,切断前后交叉韧带,充分暴露关节面,观察软骨组织染色情况。
1.3 统计学方法
应用SPSS21.0统计软件进行分析。计量资料以均值±标准差()表示,采用独立样本t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 自制小鼠固定装置相关参数
本自制小鼠固定装置主要取材于50 mL 离心管,其质量为12 g,长约11.6 cm,直径约3.4 cm;全套“一拖五”小鼠固定装置(图1D)总质量为164 g,大小为20.5 cm×10.0 cm×9.4 cm;制作采用废弃离心管,成本为0;全套制作时间约15 min。
2.2 操作时间、成功率、实验人员受伤及小鼠意外死亡情况
在整个实验过程中,小鼠平静、无激惹,未发生小鼠意外伤残、窒息死亡等情况;实验人员没有发生被咬伤抓伤等情况。具体各组尾静脉注射、断尾采血及膝关节腔内注射操作时间及成功率见表1。
2.3 甲苯胺蓝染液膝关节腔内注射
小鼠正常膝关节囊及膝关节解剖如图4A~B所示,关节囊薄而柔润,关节腔内分泌有透明蛋清样滑液。成功注射甲苯胺蓝染液可见关节囊内充盈蓝染,切开关节囊后软骨组织明显蓝染(图4C、D)。相对于传统单纯手法固定组,自制固定装置固定组的关节囊内软骨组织蓝染更加充分,甲苯胺蓝染液溢出、异位染色等情况发生率更低,膝关节腔内注射成功率更高(表1)。
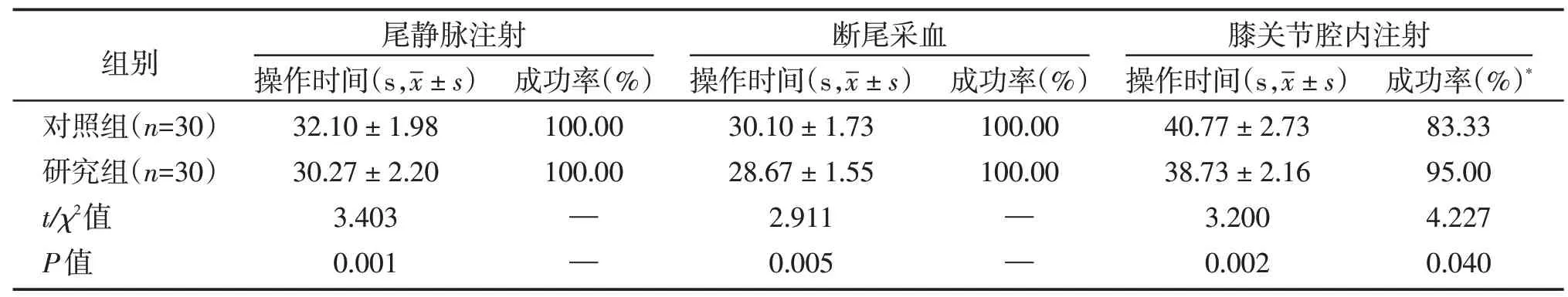
表1 对照组与研究组完成注射或采血的操作时间及成功率Table 1 Operation time and success rate of injection or blood collection in control and study groups
3 讨论
良好的固定是进行动物实验的基础,也是众多科研工作的前提。在大多无需麻醉的实验中,小鼠活动性较强,会对操作产生一定的干扰,常需要固定装置予以辅助固定。但市售的传统固定装置存在以下几个缺点:①购买价格较高,增加实验成本;②多为金属或有机玻璃制成,制作过程复杂,个人制作不易;③市售“一拖五”固定器架体积重量较大,占据空间,携带不便。基于以上的一些原因,不少实验者在实验过程中摸索出了一些实用的固定方法,但依旧存在着制作过程较为复杂、装置易于损坏,或无法满足同时固定多只小鼠的需求等不足。为此,有必要设计一种制作简单、固定牢靠、方便易携、用途多样,且可同时固定多只小鼠的固定装置。在实践过程中,利用实验室中废弃的离心管,配合闲置的试管架,进行了如上设计。为了检验自制小鼠固定装置的安全性和实用性,本课题组进行了相关实验研究。
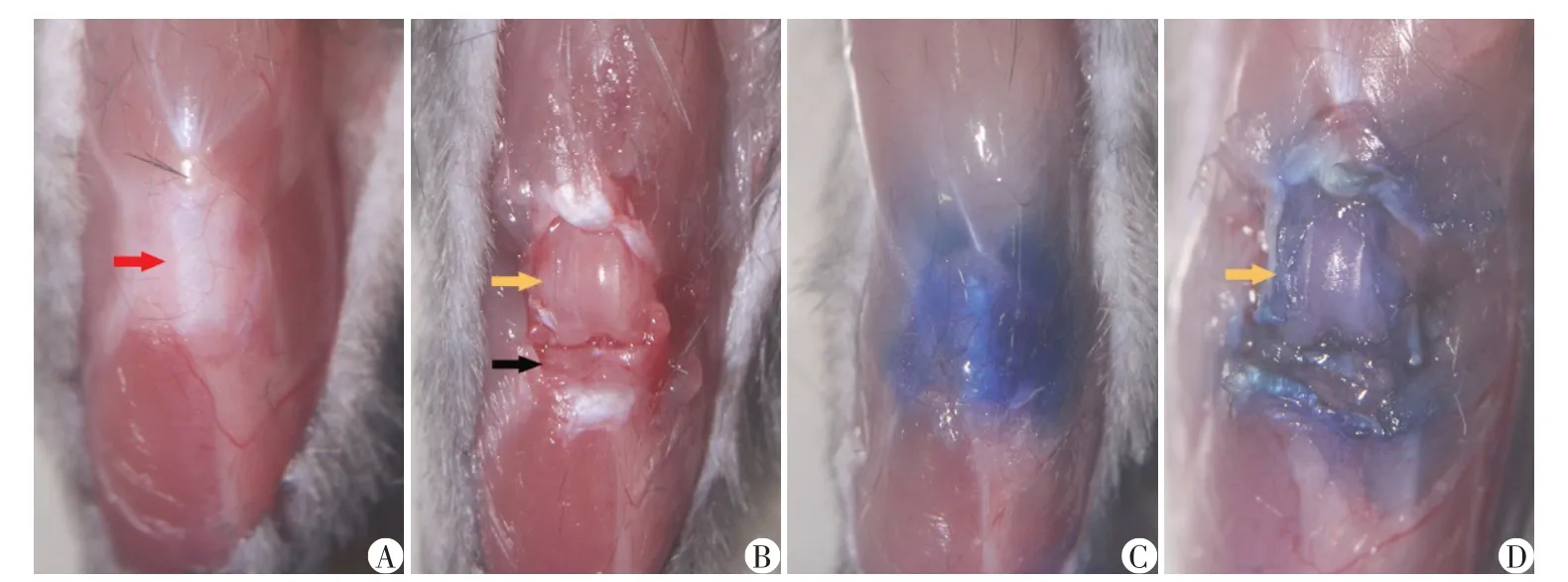
图4 小鼠膝关节腔内注射Figure 4 Intra⁃articular injection of mouse knee
在小鼠尾静脉注射及断尾采血实验中,发现对照组和研究组的注射及采血成功率均达到100%,相对于对照组,研究组的注射及采血操作时间相对较少。对于小鼠尾静脉注射,李轶倞等[13]采用笼盖压制法在一定程度上解决了小鼠的固定问题,但由于小鼠在鼠笼里活动范围广,实验过程中小鼠容易因外界环境以及人为操作发生激惹而影响操作,实验人员需要较高的熟练度才能顺利快速完成注射;同时,笼盖压制法固定效果有限,小鼠尾部受压较严重,且小鼠身体相较尾部体位更低,无法应用于小鼠断尾采血实验。而本固定装置对小鼠固定牢靠,可根据实验需要随意调整固定器位置,满足了小鼠尾静脉注射及断尾采血操作的固定要求,尤其在采血小鼠数量较多、采血时间点有要求的情况下,配合实验助手及备用固定器(图1B),采用“一拖五”组合(图1D),可以更好地提高实验效率,保障实验数据的准确性。
相对于小鼠尾静脉注射,小鼠膝关节腔内注射精确度要求更高、难度更大,通常需要预先麻醉小鼠。传统固定器因体积较大、筒壁较厚,导致手持不便、小鼠下肢暴露不充分,不适合作为小鼠膝关节腔内注射的固定器;而传统单纯手法固定无法实现小鼠的充分固定,小鼠常因麻醉效果欠佳及疼痛刺激而产生抵抗活动,不仅会影响操作的流畅性、增加注射失败率,还存在实验人员被抓伤咬伤的风险。目前市面上及以往文献报道中,还未出现针对于小鼠膝关节腔内注射的固定器。为了研究该自制固定装置关节腔内微量注射的稳定性与可重复性,分别采用传统单纯手法固定与自制固定装置固定的方法,进行小鼠膝关节腔内注射甲苯胺蓝染液实验。实验发现,相对于传统单纯手法固定,自制固定装置组固定牢靠、小鼠膝关节暴露充分,操作时间更少,一人即可顺利完成小鼠膝关节腔内注射;同时,自制固定装置组关节囊内软骨组织蓝染更加充分,甲苯胺蓝染液溢出、异位染色等情况发生率低,相对于传统单纯手法固定成功率更高。此外,对于徒手进行肌肉注射有难度的实验人员,也可以利用本固定装置,顺利完成肌肉注射。
在全部实验中,小鼠平静、无激惹,未发生小鼠意外伤残、窒息死亡等情况;同时,实验人员也没有发生被咬伤抓伤等情况,证明了该自制固定装置对于小鼠及实验人员都具有较高的安全性。整体而言,该自制固定装置与传统固定器及其他自制固定器对比,具有以下优点:①取材于废弃的50 mL离心管,材料易得,环保,且制作简单、不易损坏、方便清洗消毒;②结构小巧,携带方便,可随时组装拆卸,按“一拖五”模式组装可同时固定多只小鼠,提高工作效率;③一物多用,在满足传统固定器的小鼠尾静脉注射、断尾采血的固定要求基础上,进一步满足了小鼠肌肉及膝关节腔内注射的固定要求;④装置透明且无毒无害,利于随时观察小鼠状态,保障小鼠安全;⑤操作方便,固定牢靠,很好地保证了实验人员的安全。需要指出的是自制小鼠固定器的使用也与实验人员的技术熟练程度有关,随着熟练程度的增加,操作时间会随之减少。由于本课题组实验技术人员均能熟练地应用这种固定方法,因此在用时上较短。新的操作人员可能需要一定时间的练习才可在较短时间内完成一系列注射操作。此外,实验人员可以根据自己的操作习惯寻找适宜自己的固定步骤,如利用小鼠的钻孔习性,操作者可右手提起待操作小鼠尾巴,使其头部对准离心管开口处,顺势将小鼠装进离心管内而代替抓取步骤等。这里将最常使用的传统固定器与本实验自制小鼠固定器固定法从安全性、观察性、消毒性、适用范围、费用、便携性、大批量操作方面进行了比较,供实验人员参考。
综上所述,该自制小鼠固定装置及使用方法切实可行,具有实际应用价值,不仅可以代替市售的传统固定器满足小鼠尾静脉注射、断尾采血等操作固定要求,同时也为小鼠肌肉及膝关节腔内注射提供了一种安全、有效的固定方法。
