前列腺素F2α类降眼压药物引发心血管副作用的临床病例及其遗传相关性
2021-03-17李晓红平美萱王希振王可张达人何芬刘果刘旭阳
李晓红 平美萱 王希振 王可 张达人 何芬 刘果 刘旭阳
青光眼是以眼内压(intraocular pressure, IOP)升高、视野缺损、视神经萎缩为特征的一种致盲眼病。该病主要危险因素为IOP升高,因此降低IOP是目前治疗青光眼最有效的方法。前列腺素(prostaglandin, PG)F2α类药物是目前最有效的局部降IOP药物,主要有拉坦前列腺素、曲伏前列腺素和贝美前列腺素。曲伏前列腺素和拉坦前列腺素是PGF2α的酯前体,而贝美前列腺素是乙酰胺替代的PGF2α衍生物,有文献将其归为前列酰胺,但此种分类尚有争议[1-4]。目前,在PGF2α类药物治疗青光眼的临床实践中,不同患者对于不同PGF2α类药物的反应在多方面表现出差异,包括副反应和降IOP效果,出现了“同药不同效”的情况[5-9]。
除了眼部副作用以外,PGF2α类药物的全身副作用较少,但也有逐渐增多的病例报道。Rajan等报道了5例青光眼患者在使用拉坦前列腺素后出现了胸闷、胸部发紧的副作用[10];Mitra报道了拉坦前列腺素引发心绞痛的病例[11];Lee报道了1例34岁女性患者在滴用曲伏前列腺素后出现腹部痉挛性疼痛[12];George报道了3例使用PGF2α类药物的患者均出现了胃肠道不良反应[13];余曼报道的1例女性患者在使用曲伏前列素和拉坦前列腺素之后均出现恶心、腹痛和腹泻,换用贝美前列腺素后症状消失[8];我们前期也报道了使用PGF2α类药物出现胃肠道副作用的青光眼病例[14]。目前,PGF2α类药物全身副作用的分子机理及其遗传相关性尚不清楚,相关的研究也很少,这给PGF2α类药物治疗青光眼的临床应用带来了挑战。本研究报道3例滴用PGF2α类药物后出现心血管副作用的临床病例。我们从药物作用机理出发,分析候选基因,初步探索患者基因序列与药物副作用之间的关系,为PGF2α类药物的精准临床应用提供参考。
资料与方法
一、临床检查
该研究获得暨南大学深圳眼科医院伦理委员会的批准,遵从赫尔辛基宣言,在取得患者知情同意的情况下进行。所有临床检查尊重并保证患者的知情权和自主权。
二、全血基因组DNA抽提
抽取患者静脉血,用Qiamp Blood DNA mini Kit(Qiagen,德国)抽提基因组DNA。
三、引物设计与合成
进入NCBI网站,搜索候选基因序列,用软件Primer Premier 6.0(Premier, 加拿大)设计引物,交由华大基因公司合成。引物合成后,用三羟甲基氨基甲烷-EDTA[Tris (hydroxymethyl) aminomethane-EDTA,TE]缓冲液稀释至10 pmol/μl,用于聚合酶链反应(polymerase chain reaction,PCR)扩增。
四、PCR扩增
40 μl扩增体系;20 μl 2×Taq Master Mix(E005-02A,novoprotein, 中国),16 μl无菌水,2 μl基因组DNA(30~40 ng),1 μl正向引物,1 μl反向引物。
PCR反应条件:94 ℃预变性5 min;然后94 ℃变性30 s,51~62 ℃(引物退火温度,部分见表1)退火30 s,72 ℃延伸(1 min/1 kb),30循环;最后72 ℃终止延伸10 min,并将反应产物保存于4 ℃。

表1 FP和STC1基因的部分扩增引物
五、测序及序列比对
PCR扩增产物直接送由华大基因进行常规测序,用软件Lasergene 11.0 (DNASTAR, 美国) 将患者序列和NCBI基因序列进行比对,寻找患者序列的变异。
结 果
一、病例1;61岁女性。因“双眼视力逐渐下降5年”于2018年5月21日入院(深圳眼科医院)。患者5年前因双眼青光眼接受激光虹膜周边切除术,术后长期使用前列腺素类药物控制IOP,门诊规律复查。后来,患者觉得视力下降加重,停用降IOP药物后测量24 h IOP,右眼14.7~23.0 mmHg(1 mmHg=0.133 kPa), 左眼13.3~23.0 mmHg。入院时,患者否认眼部外伤史,否认高血压、糖尿病、冠心病、乙肝等全身病史。(1)眼部检查:双眼裸眼视力(uncorrected visual acuity, UCVA)0.7,矫正无助;中央前房轴深2 CT,周边前房1/4 CT,晶体浑浊,眼底见双眼视盘界清,色淡红,杯盘比右眼约0.7、左眼约0.6。(2)眼科辅助检查:非接触式IOP计(noncontact tonometer, NCT)测IOP:右眼15.1 mmHg,左眼14.8 mmHg。中央角膜厚度(central corneal thickness, CCT):右眼526 μm,左眼522 μm。超声生物显微镜(ultrasound biomicroscopy, UBM):右眼前房轴深1.67 mm,左眼前房轴深1.74 mm,双眼周边虹膜明显膨隆,12,3,6,9点位房角明显狭窄;提示双眼浅前房,房角重度狭窄。Humphrey视野:右眼视野大致正常,左眼视野生理盲点扩大。全身生命体征:体温36.3 ℃,脉搏70次/分,呼吸频率20次/分,血压122/83 mmHg。住院时心电图经我院内科医生会诊:大致正常,可以进行超声乳化晶状体摘除与人工晶状体植入联合房角分离术。术后门诊予以滴用拉坦前列腺素(瑞达喜、韩国生产),出现胸痛、头晕,停药后缓解。
基因测序结果;为了分析该病例滴用拉坦前列腺素后出现胸痛、头晕症状的原因,探究其遗传相关性,我们对已经被报导与PGF2α类药物降IOP作用机制相关的蛋白质基因以及原发性开角型青光眼(primary open angle glaucoma, POAG)相关基因进行PCR扩增和测序,寻找变异位点。我们没有在病例1中发现POAG相关基因TIGR/myocilin和cytochrome P450 1B1 (CYP1B1)在外显子和启动子区的序列变异。
PGF2α类药物的降IOP作用由PGF2α受体(prostaglandin F receptor,FP)介导。FP基因启动子和1号内含子上的单核苷酸多态性(single nucleotide polymorphisms, SNP)位点rs3753380和rs3766355被认为与拉坦前列腺素的降IOP效果相关[15]。我们发现,该病例FP编码序列没有变异。与使用PGF2α类药物无全身系统性副作用的POAG患者(阴性对照)不同,该病例SNP位点rs3753380处为低频率碱基T纯合(图1A, 1B),rs3766355处为低频率碱基C纯合(图2A, 2B)。除此之外,FP 3’-非翻译区(untranslated region, UTR)的SNP 位点rs12731181被报道位于微小RNA(microRNA, miRNA) miR-590-3p的结合位点处,其变异会改变miR-590-3p与FP mRNA 3’-UTR的结合能力,从而改变FP的表达水平[16]。我们发现,该病例rs12731181处为高频率碱基A纯合(图3B),能和相应抑制性miRNA miR-590-3p结合,从而维持其相对稳定的低水平。
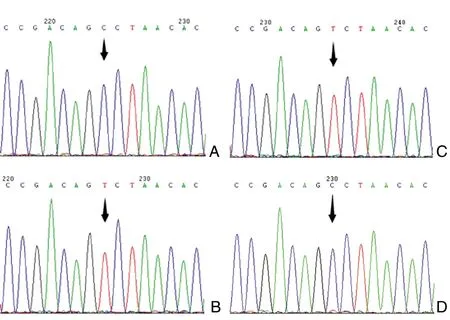
图1 FP基因rs3753380的基因型(箭头指示)A:对照(使用PGF2α类药物无全身系统性副作用的POAG患者);B:病例1;C:病例2;D:病例3
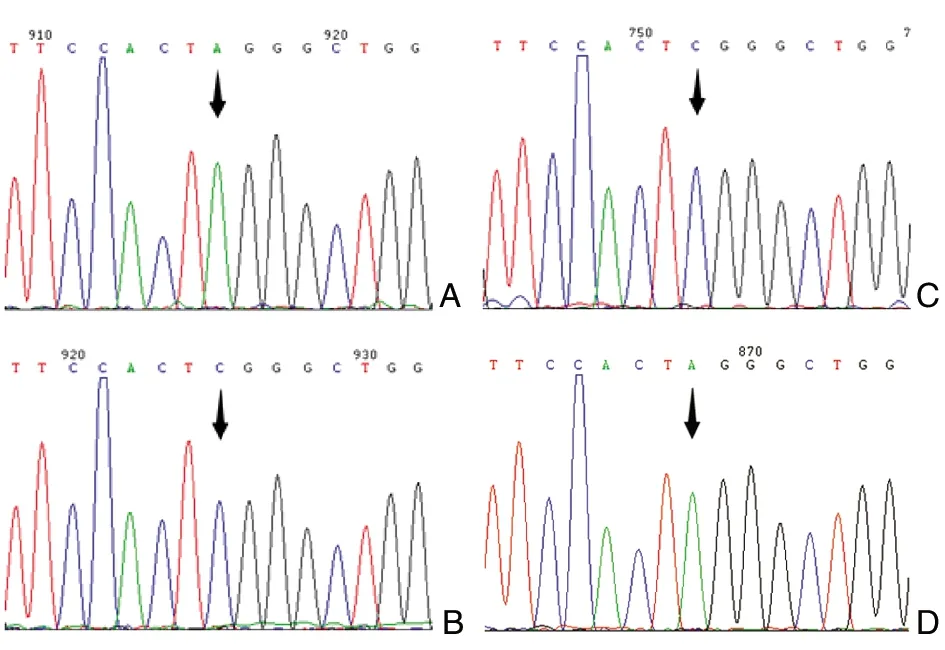
图2 FP基因rs3766355的基因型(箭头指示)A:对照(使用PGF2α类药物无全身系统性副作用的POAG患者);B:病例1;C:病例2;D:病例3
据报道,拉坦前列腺素的降IOP机制是斯钙素1(stanniocalcin 1,STC1)依赖的,拉坦前列腺素会诱导STC1的表达[17],而STC1会通过调节孤束核神经元钙平衡而抑制动脉压和心率,导致低血压和心动过缓[18]。因此,我们也对STC1进行了PCR扩增和序列分析。我们发现,该病例STC1基因的编码序列无突变。基因243位(5’- UTR)杂合缺失A(杂合c.243 delA, 图4B),使该位点单碱基A的串联重复次数由12变为11,但此变异在阴性对照(使用PGF2α类药物无全身系统性副作用的POAG患者)上亦存在(图4A)。
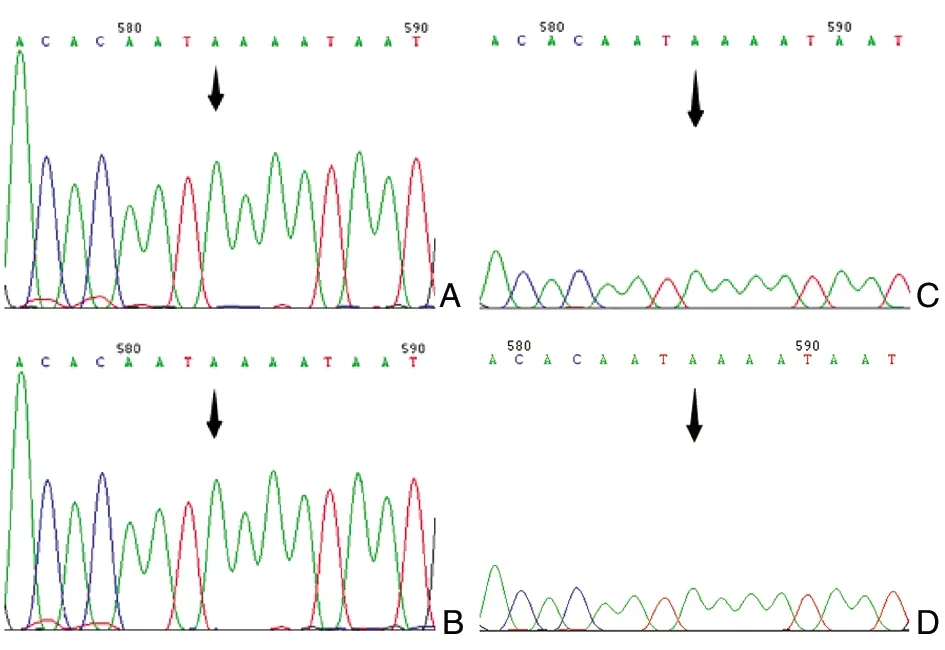
图3 FP基因rs12731181的基因型(箭头指示)A:对照(使用PGF2α类药物无全身系统性副作用的POAG患者);B:病例1;C:病例2;D:病例3
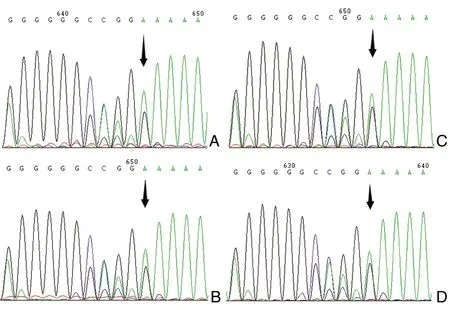
图4 STC1基因单链缺失A(箭头指示)A:对照(使用PGF2α类药物无全身系统性副作用的POAG患者);B:病例1;C:病例2;D:病例3。测序峰图为反向测序序列的反向互补
二、病例2;42岁,女性。因“双眼抗青光眼术后3年,IOP控制不佳1年,加重1周”于2016年11月28日入院。患者3年前因双眼青光眼在外院行复合小梁切除术,1年前常规复诊发现IOP控制不佳,入院前1周IOP明显升高。入院时患者否认眼部外伤史,否认高血压、糖尿病、冠心病、乙肝等全身病史。眼部检查;右眼UCVA0.8,矫正视力(best corrected visual acuity, BCVA)1.0;左眼UCVA 0.8,BCVA 1.0。双眼结膜上方滤过泡低平,血管长入。眼底见双眼视盘界清,色淡红,杯盘比右眼约0.7、左眼约0.4。眼科辅助检查;Goldmann压平IOP;双眼28 mmHg;CCT;右眼526 μm,左眼522 μm。UBM;右眼前房轴深3.3 mm,左眼前房轴深3.38 mm,双眼 12,3,6,9点位房角开放。Humphrey视野;双眼残余中心及颞侧视岛。相干光层析成像术(optical coherence tomography, OCT);双眼视网膜神经纤维层(retinal nerve fiber layer, RNFL)广泛变薄。全身生命体征;体温36.2 ℃,脉搏54次/分,呼吸频率20次/分,血压120/70 mmHg。出院后门诊复查时自诉使用拉坦前列腺素时出现心慌、心跳加速,自行停药后缓解。后改用阿法根、苏为坦后再未出现上述症状。
基因测序结果;我们没有在病例2中发现POAG相关基因TIGR/myocilin和CYP1B1在外显子和启动子区的序列变异。该病例FP基因的编码序列也没有变异。与使用PGF2α类药物无全身系统性副作用的POAG患者(阴性对照)不同,该病例SNP位点rs3753380处为低频率碱基T纯合(图1A, 1C),rs3766355处为低频率碱基C纯合(图2A, 2C)。3’- UTR的SNP 位点rs12731181处为高频率碱基A(图3C),能和相应抑制性miRNA miR-590-3p结合,从而维持其相对稳定的低水平。
该病例STC1基因的编码序列无突变。基因5’- UTR存在杂合c.243 delA(图4C),使该位点单碱基A的串联重复次数由12变为11;基因63位(5’-UTR) SNP位点rs1438452处为T / C杂合(图5A),T>C变异扩展了该位点微卫星DNA CGG重复次数;147位(5’-UTR) SNP位点 rs1438453处为A/C杂合(图5B), A>C变异同样扩展了CAA重复次数,导致了CAA重复形成的微卫星DNA的不稳定。
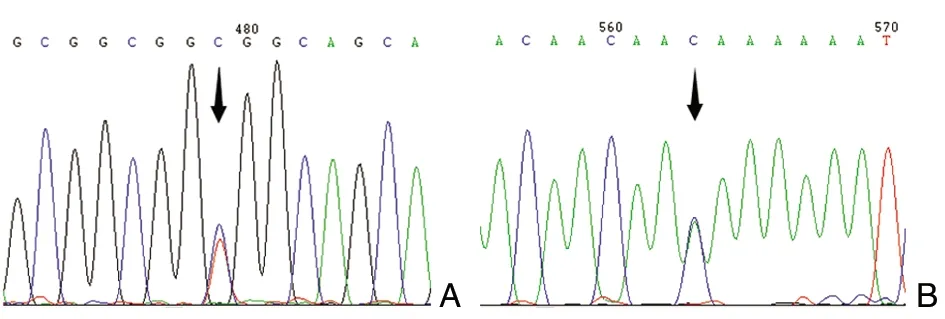
图5 病例2 STC1基因5’- UTR基因型(箭头指示)A:rs1438452 为T/C杂合;B:rs1438453为A/C杂合
三、病例3;57岁,女性。因“发现双眼IOP升高6年,偶有眼胀”于2014年11月25日就诊于我院门诊,未使用降IOP药物,规律复查。患者否认眼部外伤史,否认高血压、糖尿病、冠心病、乙肝等全身病史。眼部检查;右眼UCVA 1.0,BCVA1.0;左眼UCVA 0.4,BCVA 0.8。双眼杯盘比约0.7。眼科辅助检查;NCT;右眼20.4 mmHg,左眼20.0 mmHg。CCT;右眼566 μm,左眼544 μm。OCT;右眼RNFL可疑偏薄。Humphrey视野;右眼局部视敏度下降。患者于2016年1月19日复查发现右眼杯盘比约0.8,较前进展。眼科辅助检查;日多次Goldmann压平IOP:右眼最高24 mmHg,左眼最高20 mmHg。OCT;右眼视盘下方RNFL变薄。Humphrey视野;右眼鼻上方弧形暗点。嘱患者使用阿法根(酒石酸溴莫尼定)右眼一日2次,后于2016年2月23日予以瑞达喜(拉坦前列腺素)右眼每晚1次,均未诉不适。再于2016年3月25日复诊:将瑞达喜换为卢美根(贝美前列腺素)右眼每晚1次。2016年5月20日再次复诊时诉;使用卢美根后有明显的心慌、头晕症状,未至综合医院心内科就诊。嘱患者停用卢美根继续使用瑞达喜,后又使用过苏为坦均未出现心慌、头晕等症状。
基因测序结果;该病例POAG相关基因TIGR/myocilin和CYP1B1亦没有发现序列变异。FP基因编码序列没有突变,SNP位点rs3753380,rs3766355和rs12731181处为各自的高频率碱基C, A, A的纯合型(图1D, 2D和3D)。该病例的STC1基因,除了5’- UTR存在杂合c.243 delA(图4D)以外,其余序列无变异。
讨 论
本研究我们报道了3例特殊的女性POAG 病例,她们在使用PGF2α类药物后出现了类似的心血管系统副作用。病例1和2均是在使用拉坦前列腺素后出现了心血管副作用,其中病例1出现了胸痛、头晕,病例2出现了心慌、心跳加速。病例3则是用贝美前列腺素治疗后出现了明显的心慌和头晕症状。病例1出现胸痛的原因可能是因为心肌缺血。有研究认为前列腺素类药物会导致低血压和心动过缓[19],因此病例1、3出现头晕的症状可能是因为PGF2α类药物引起血压降低,大脑供血不足导致。病例2、3都出现了心慌的症状。一般,心率过快、过慢以及有过早搏动时都会产生心慌的感觉。由于病例2明确说明自己心动过速,与PGF2α类药物会导致心动过缓的说法似乎矛盾,但PGF2α类药物引起的血压降低会刺激主动脉弓和颈动脉窦上的压力感受器,从而引起反射性心率增高,当此反射起主要作用时患者表现为心动过速。
研究证明,拉坦前列腺素和曲伏前列腺素进入睫状体后是通过选择性激活FP,引起基质金属蛋白酶释放[20,21],降解睫状肌胞外介质, 增加房水经葡萄膜巩膜通道外流而降低IOP。贝美前列腺素降IOP的作用机理目前尚有争议。有研究认为贝美前列腺素同属PGF2α类似物,通过激活FP而发挥作用[22-24];另有研究认为贝美前列腺素是一种前列酰胺类似物,通过激活一种前列酰胺受体或新的FP剪接体而发挥作用[3,25,26]。由于存在贝美前列腺素可以治疗拉坦前列腺素不敏感病人[7,9]、使用拉坦前列腺素有胃肠道副作用的病人使用贝美前列腺素却没有[8]、以及FP受体敲除小鼠对贝美前列腺素丧失敏感性[22]等现象,贝美前列腺素也会激活FP或新的FP剪接体,但由于其结构具有与拉坦前列腺素和曲伏前列腺素之间的差异性,贝美前列腺素对FP或新的FP剪接体的选择专一性可能不同于拉坦前列腺素和曲伏前列腺素[14,27]。此外,由于各前列腺素受体之间的同源性高,PGF2α类药物对各种前列腺素受体的选择性并不高。有研究表明,拉坦前列腺素除了对FP具有相对很高的亲和力外,对前列腺素E受体1型(prostaglandin E receptor 1, EP1)也表现出亲和力。同样,贝美前列腺素游离酸除了对FP表现出较高的亲和力以外,还可与EP1 和EP3结合[2,28]。课题组前期研究发现,个别病例表现出的对拉坦前列腺素和贝美前列腺素的不同临床反应,以及极少数病例中出现的胃肠道副作用,可能与其前列腺素类受体的基因型有关[14,27]。
文献报道指出,FP上两个SNP位点(启动子区rs3753380和内含子1上rs3766355)的基因型会直接影响受体的表达水平。如果rs3753380为T,rs3766355为C,FP的表达水平将会降低[15]。我们发现病例1和2的FP基因编码序列均没有突变,但rs3753380处均为T,rs3766355处均为C,提示两者的FP表达水平均相对较低。不仅如此,病例1和2的FP基因3’-UTR区rs12731181均为A,该基因型转录产物mRNA能和相应抑制性miRNA miR-590-3p结合,进一步阻碍了FP的表达。我们推测,由于患者FP水平低,拉坦前列腺素可能更多地由EP1来介导。EP1的过度激活会导致低血压而引发一些类似心脏供血不足的症状[19,29],如头晕。低血压也可刺激压力感受器引起反射性心率增高,出现心动过速。心动过速和冠脉收缩引起的心肌缺血则可能进一步引发胸痛。与病例1和2不同,我们没有发现病例3 FP基因序列的变异及SNP rs3753380和rs3766355处低频率碱基的出现,提示贝美前列腺素心血管系统副作用的机制还在FP之外,需要更深入的研究。
STC1介导了拉坦前列腺素的降IOP机制,拉坦前列腺素会诱导其表达[17]。除了降IOP, STC1还会通过调节孤束核神经元的钙平衡而抑制动脉压和心率,导致低血压和心动过缓[18]。我们发现,3个病例STC1基因的编码序列均无突变,但均存在杂合c.243 delA,使5’- UTR区该位点单碱基A的重复次数由12减少为11。由于此变异在阴性对照(使用PGF2α类药物无全身系统性副作用的POAG患者)上亦存在,所以该变异应该不是一个与PGF2α类药物心血管副作用直接相关的独立因素,但不排除该因素合并FP变异会增加PGF2α类药物心血管副作用发生的可能。除此之外,病例2 STC1基因的5’-UTR SNP位点rs1438452(63位)为杂合T/C,C扩展了该位点所在CAG/CGG微卫星DNA区域CGG的重复次数,同时147位(5’-UTR) SNP位点 rs1438453 为A/C杂合,C同样扩展了该位点所在微卫星DNA CAA的重复次数。我们推测,5’- UTR区CAA/CAG/CGG重复次数的扩展很可能通过改变STC1翻译过程中核糖体的扫描而影响STC1的表达,从而影响STC1基因对PGF2α类药物的反应,抑制动脉压和心率,最终导致低血压和心动过缓。
综上所述,PGF2α类药物临床应用可能发生的全身系统副作用与其降IOP机制相关,机制相关蛋白的基因变异可增加患者产生系统副作用的概率。PGF2α类药物受体FP及其下游蛋白STC1基因的变异可能导致患者在使用PGF2α类药物时产生较为严重的心血管系统副作用。但由于受病例数的限制,本论文的研究结果还需进一步验证。为了减少药物副作用的发生,临床医生需要更多关注临床用药,关注患者基因背景,以实现临床精准用药,提高治疗效果。
