原发性开角型青光眼家系致病基因检测及其启动子区域甲基化的关系
2021-03-17李思媛郑娟翟玉喜顾明亮高建鲁
李思媛 郑娟 翟玉喜 顾明亮 高建鲁
青光眼是一种以视神经损伤和相应视功能损害为特征的视神经疾病,是仅次于白内障的致盲性疾病。全球约有6050万原发性开角型青光眼(primary open-angle glaucoma,POAG)患者,到2020年该病患者的数量将达7960万[1]。POAG的发病机制目前普遍认为是基因与环境等多种因素相互作用导致的疾病[2]。迄今,通过对符合孟德尔遗传的青光眼家系进行连锁分析,定义了20多个青光眼遗传位点,并鉴定了可能的青光眼致病基因[3]。对于大多数青光眼家系,其受累个体往往在成年后发病,具有延迟发病和不完全外显的特点。通过数十年模式生物的研究,已经证明表观遗传机制对基因组功能的调控具有重要作用[4],包括组蛋白转录后修饰、胞嘧啶(C)甲基化和non-coding RNA的调节等[5]。甲基化的特点是DNA 序列不发生改变的情况下调控基因的表达,调节 DNA 重组、保证染色体完整性和某些基因组区域的转录活性[6]。本研究通过分析一个POAG家系,确定其致病基因,并分析基因和表型的关系,初步探测基因甲基化修饰对迟发性的意义。
资料与方法
一、一般资料
获得一个呈孟德尔显性遗传模式的POAG家系的血样本及临床资料(标准为邯郸眼科研究标准,所有样本由聊城市人民医院提供,研究通过伦理委员会的审查,所有受试者均签署知情同意书)。该家系符合“孟德尔遗传青光眼家系较适合连锁分析”的要求,共81例,生存78例,其中患者10例(图1)。
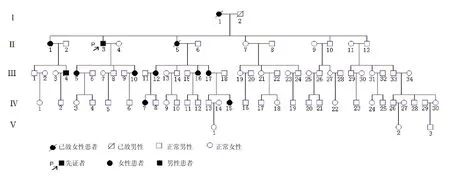
图1 POAG家系成员组成及受累情况
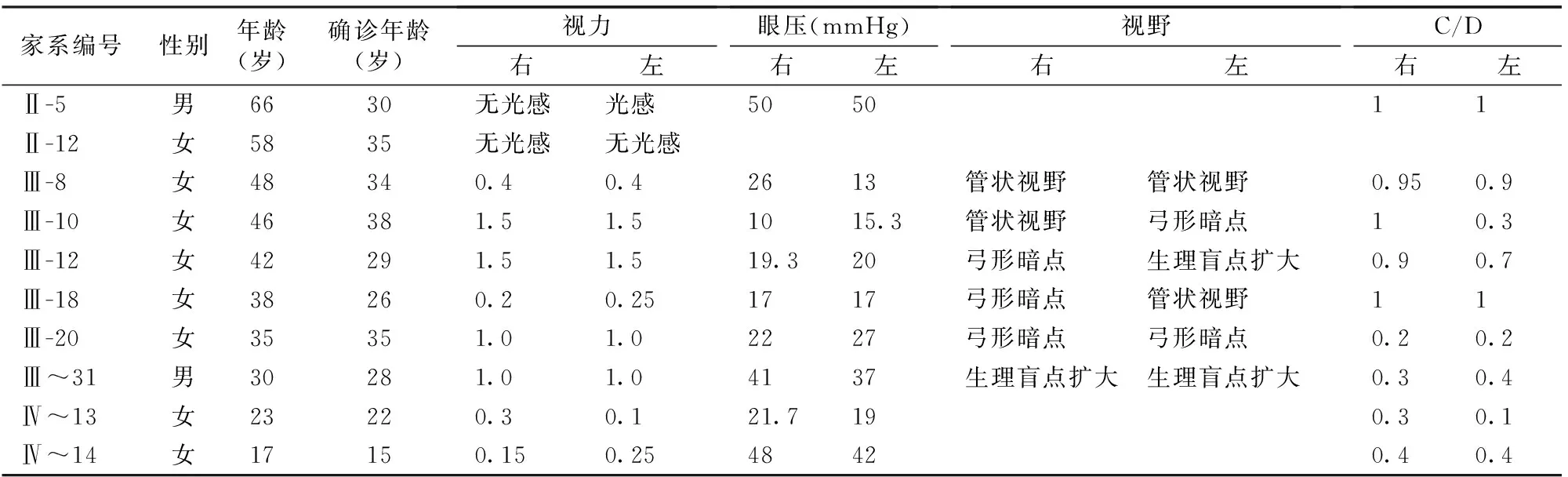
表1 家系部分患者的临床资料
二、POAG诊断标准
1.有青光眼性视盘损害和(或)视网膜神经纤维层缺损;
2.青光眼性视野缺损;
3.前房角开放,具有以上3项并排除继发性开角型青光眼。仅眼压大于21 mmHg(1 mmHg=0.133 kPa)或青光眼激发试验(如饮水试验和暗室俯卧试验)阳性应诊断为可疑。
三、方法
1.临床资料收集:详细询问该家系家族史(已故者信息询问其家庭成员获得),并进行详细的眼科专科检查,包括视力、眼压、裂隙灯显微镜检查、房角镜检查、眼前节照相、眼底检查及Humprey视野检查、海德堡视网膜断层扫描仪(Heidelberg retinal tomography II,HRT-II)。
2.DNA的提取:抽取家系成员静脉血5 ml,EDTA抗凝,-4 ℃保存,采用氯仿法提取外周血细胞DNA,-80 ℃保存。
3.致病基因检测:对该家系所有成员进行致病基因检测。应用芯片捕获测序技术,捕获POAG相关基因所有的外显子及剪切位点,通过高通量测序检测这些基因的突变情况,对于高通量测序中出现的可疑致病位点,再行Sanger测序验证。
4.检测家系外周血中MYOC甲基化水平:使用MethPrimer http://www.uro-gene.org/methprimer预测致病基因启动子CPG岛,设计甲基化引物,重硫酸盐处理全基因组DNA,一代测序检测DNA甲基化程度,并行聚类分析。
结 果
一、家系基本情况
该家系共5代,81人,其中患者12人(已故2人。5代中最年轻的一代尚未出现表型,其余均有患者出现,发病年龄在15~38岁,具有迟发性特点。
二、家系患者眼部情况及特点
先证者,家系编号II-3,女,48岁,确诊时间为34岁。间断降眼压药物治疗(卡替洛尔滴眼液、布林佐胺滴眼液,2年前加用曲伏前列素滴眼液),眼压控制欠佳,视野右眼为管状视野,C/D=1.0,左眼弓形缺损,C/D=0.3。因视野损失逐渐加重,于2017年行双眼小梁切除术。部分家系患者现在眼部情况及治疗结果(表1)。
根据家系成员青光眼确诊时间,考虑为青少年型青光眼,确诊时均行视野检查,提示有视野缺损,严重者双眼无光感;眼压在多种药物及手术和选择性激光小梁成形术的控制下,均在正常范围。随着年龄增长,家系内发病个体逐渐增加,表现出一定的迟发特征。
三、家系致病基因
在rs10911021的位置有一个与青光眼候选基因重叠的连锁峰,其LOD值为3.302,NPL值为16.67,位于染色体1q24.2~25.3(图2),该区域遗传距离约14Mb,其中的MYOC为候选致病基因。然后,我们对该基因进行Sanger测序,在其MYOC G1099A鉴定出致病突变(G367R)(图3)。
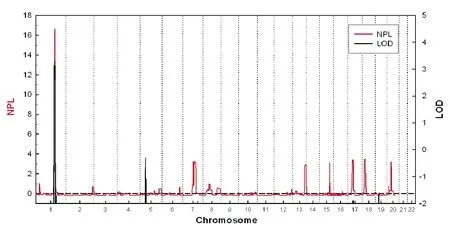
图2 POAG家系致病基因的染色体定位
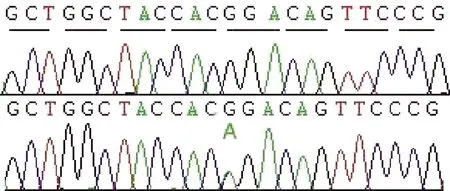
图3 POAG家系MYOC G1099A突变的测序峰图
四、致病基因的甲基化测序结果
患者、突变携带者及正常者,MYOC 上游0bp至-2000bp 启动子区内F1-R1 CG位点的检测如热图所示(图4)。3组甲基化丰度水平的改变,在疾病亚组之间无明显差异。
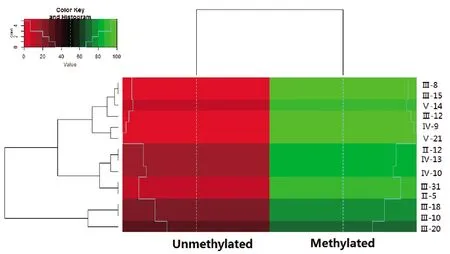
图4 疾病亚组之间Myoc甲基化聚类
讨 论
POAG遗传背景复杂,是多基因参与的高度遗传异质性疾病。迄今,通过家系的连锁研究定义了29个青光眼遗传位点,并鉴定了12个可能的青光眼致病基因[7],其中包括MYOC[8]、OPTN[9]、CYP1B1[10]、WDR36[11],ASB10和NTF4等等[12]。随着基因组技术的发展,多个临床研究中心通过基因组测序、外显子测序、GWAS 、基因芯片等方法,对大量的青光眼家系及散发人群从POAG的内在表型、线粒体、小梁网等相关基因进行检测,又进一步发现了约50个可能青光眼遗传位点[13]。但是由于POAG遗传背景的复杂性,这些基因的发现仅解释了不到10%POAG患者的发病原因[14],在绝大多数POAG患者中这些变异都是罕见的。因此,继续通过遗传家系、大样本及多中心研究进行致病基因的筛选、鉴定,敏感位点的定位和功能研究仍然是青光眼领域研究的热点。
正是这些决定基因的存在,启动一系列下游相关基因的级联信号通路,诱导POAG的发生与发展。在本研究的家系中,患者携带相同致病基因,但发病年龄存在明显差异,个体间发病年龄的时间跨度能达10余年之久,即存在疾病迟发现象。我们推测POAG迟发实质上就是生物进化出来的对环境适应性的表观响应机制。环境因素如饮食、肥胖、吸烟、日晒和年龄能引起基因组表观层面的改变,例如DNA甲基化,组蛋白甲基化,组蛋白乙酰化等。Jünemann 等研究发现青光眼患者的外周单核细胞中总的DNA甲基化水平比健康人存在明显的升高[15]。Fiona等进一步利用ELISA方法检测人青光眼小梁网细胞系和正常小梁网细胞系中总的甲基化水平,发现人青光眼小梁网细胞系DNA甲基化水平高。低氧处理正常细胞系后,会出现与青光眼细胞系相似的甲基化与基因表达结果。说明低氧环境可以诱导DNA甲基化水平改变,从而使相关基因表达发生改变,进而诱发青光眼[16,17]。
本研究中我们初步应用全基因组甲基化测序检测基因组上的差异甲基化区域,拟找到受不同环境因素刺激的个体间的表观分子差异。但结果并不理想,考虑一代测序的局限性,测序开始的50个碱基可能存在序列的错误,以及样本量偏少,可能存在偏差。因此,扩大样本量检查,重新调整检测方法,或得到可观的效果,而继续行青光眼家系的遗传研究,将有利于POAG复杂发病机制的阐明,而且对POAG预防、早期诊断和治疗具有潜在的应用价值。
