超高效液相色谱-三重四级杆质谱同时检测苦荞中10种真菌毒素
2021-03-01唐振涛于刚刘菲俞凌云薛康
唐振涛 于刚 刘菲 俞凌云 薛康

摘要 [目的]建立QuEChERS-超高效液相色谱-串联质谱法同时检测苦荞样品中10种真菌毒素。[方法]苦荞样品经水和乙腈提取后,采用QuEChERS方法净化。通过超高效液相色谱-三重四级杆质谱在多反应监测模式(MRM)下进行目标真菌毒素的分析。试验对样品前处理、仪器分析条件进行优化;考察方法的基质效应、检出限、精密度、回收率等参数。[结果]根据基质效应考察结果,50%的目标真菌毒素具有显著的信号抑制/增强效应。为了补偿基质效应的影响,选用基质配标法进行目标真菌毒素的分析。方法的线性范围为0.5~50.0 μg/L(对于黄曲霉毒素B2、G2,线性范围为0.125~12.500 μg/L),检出限和定量限分别低至0.011和0.040 μg/L,回收率为89.70%~105.83%,RSD<9%(n=6)。[结论]建立的方法简便、可靠,具有较好的灵敏度和准确性,能有效用于苦荞样品中多组分真菌毒素的检测。
关键词 苦荞;多组分真菌毒素;QuEChERS;超高效液相色谱-三重四级杆质谱
中图分类号 TS211.7 文献标识码 A
文章编号 0517-6611(2021)01-0188-06
doi:10.3969/j.issn.0517-6611.2021.01.051
Abstract [Objective]To establish an analysis method for simultaneous determination of 10 mycotoxins in buckwheat samples based on QuEChERS-ultra-high performance liquid chromatography-tandem mass spectrometry.[Method]As a typical run,mycotoxins were extracted with water and acetonitrile,followed by purification with QuEChERS procedure.The target mycotoxins were analyzed by UPLC-MS/MS in multiple reaction monitoring (MRM) mode.The sample pretreatment and instrumental analysis method were respectively optimized.Finally,matrix effect,detection limits,precision and accuracy were investigated.[Result]According to the investigation of matrix effect,50% of the target mycotoxins have encountered prominent signal suppression / enhancement.To compensate the significant matrix effect,matrix-matched calibration curves were finally employed in this study.The linear range of targets were 0.5-50.0 μg/L (0.125-12.500 μg/L for AFB2,AFG2).Detection limits (LOD) and quantification limits (LOQ) were respectively detected down to 0.011 and 0.040 μg/L.Recoveries were obtained ranging from 89.70% to 105.83% with RSD< 9%.[Conclusion]The established method exhibits several advantages of simplicity,reliability,good sensitivity and accuracy.It is feasible and effective to apply this method for determination of multi-mycotoxins in buckwheat samples.
Key words Buckwheat;Multi-mycotoxins;QuEChERS;UPLC-MS/MS
苦蕎是蓼科荞麦属植物,在我国西南、中南、华北等地均有分布。该类植物能适应环境恶劣的生长环境,主要作为粮食和饲料供人们使用。苦荞含有优于小麦、玉米等的蛋白质及氨基酸,还含有大量维生素和多种矿质元素,具有丰富的营养价值[1]。另一方面,苦荞富含黄酮类、甾体类、多糖等生物活性成分;药理学研究表明苦荞具有降血压、降血脂、降血糖、抗氧化、预防心血管疾病等作用[2-4]。随着苦荞药理作用的研究发现,“药食同源”的苦荞及其产品迎来广阔的市场前景,有关苦荞产品的开发利用也得到越来越多的关注[5]。然而,与其他谷物一样,苦荞面临着易被真菌毒素污染的难题[6]。真菌毒素污染不仅会对人体健康造成巨大危害,还将严重影响苦荞及其制品的经济效益[7]。目前有关苦荞中真菌毒素的研究还比较少,尤其是多组分真菌毒素的同时检测[6]。
食品中真菌毒素的检测方法有很多,包括高效液相色谱法、薄层色谱法、色谱质谱联用法、酶联免疫法等[8-9]。其中,液相色谱-串联质谱法是最常用的检测方法[10-12]。该方法可以实现多目标物的同时检测,灵敏度高,能提供化合物的结构信息,具有更高的可靠性。作为复杂基质中多组分真菌毒素的关键步骤,简单、高效、低成本的样品前处理方法能进一步提高分析的准确性和实用性[13]。QuEChERS法因其简便、有效、溶剂用量少被广泛用于食品中农药残留的提取净化[14]。近年来,已逐渐被用于食品中真菌毒素的前处理并取得一定进展[10,15]。由于苦荞基质复杂,而真菌毒素常以痕量存在,该研究选择结合QuEChERS法和超高效液相色谱-串联质谱,建立了简便、有效的分析方法,有利于实现苦荞样品中多组分真菌毒素的同时检测。
1 材料与方法
1.1 材料与试剂
10种真菌毒素标准品:黄曲霉毒素B1、B2、G1、G2,玉米赤霉烯酮,伏马毒素B2,T-2毒素,HT-2毒素,赭曲霉毒素A,柄曲霉素,纯度95.0%~98.9%,奥地利Biopure公司;甲醇、乙腈,HPLC级,美国Fisher Scientific公司;甲酸、乙酸铵,MS级,德国Sigma公司;无水硫酸镁、氯化钠,分析纯,成都科隆化学品有限公司;尼龙针式滤头(0.22 μm),天津津腾实验设备有限公司;净化材料(PSA、GCB、C18、Al2O3),上海安谱实验科技股份有限公司;氧化石墨烯,自制。
1.2 仪器与设备 超高效液相色谱-三重四级杆质谱(Acquity Xevo TQ-XS,美国Waters公司);C18色谱柱(50 mm×2.1 mm×2.7 μm,美国Waters公司);电子分析天平(XS205DU,梅特勒-托利多仪器有限公司);涡旋混合器(XW-80A,上海沪西分析仪器有限公司);纯水机(Milli-Q integral 3,美国MILLIPORE公司);离心机(3K30,德国Sigma公司);高速粉碎机(德国IKA公司)。
1.3 样品前处理
1.3.1 样品制备。由成都海关技术中心理化实验室随机提供15个苦荞样品。样品用高速粉碎机粉碎,过筛;混合均匀后缩分至500 g,密封保存于4 ℃以下,供检测用。
1.3.2 样品提取。取2 g(精确至0.01 g)样品粉末于50 mL离心管中,加入10 mL去离子水将其浸没。然后加入10 mL乙腈,涡旋混匀,摇床振荡30 min。提取后以10 000 r/min的速度离心,将上清液转移到干净的离心管中。快速加入2 g无水MgSO4和1 g NaCl,并涡旋3 min。再次离心,取上清液备用。
1.3.3 样品净化。准确移取2 mL提取液,加入30 mg C18,涡旋1 min后离心。将1 mL上清液在40 ℃下用氮气缓慢吹至近干,加入1 mL初始流动相,继续涡旋1 min。最后用0.22 μm滤膜过滤待测液,收集至进样瓶,备用。
1.4 仪器分析条件
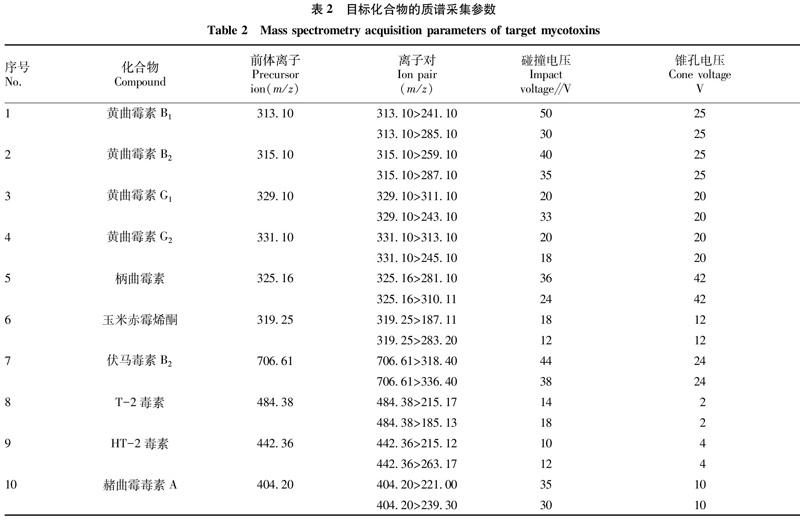
1.4.1 色谱条件。流动相:0.1%甲酸水+5 mmol/L乙酸铵(A相),0.1%甲酸甲醇+5 mmol/L乙酸铵(B相);柱温:40 ℃;进样量:2 μL;梯度洗脱程序见表1。
1.4.2 质谱条件。
质谱配备电喷雾离子源(150 ℃,正离子模式ESI+);检测方式:多反应监测模式(MRM);锥孔气流速:150 L/h;脱溶剂气温度及流速:250 ℃,800 L/h;目标化合物物的采集参数(包括离子对、碰撞电压、锥孔电压)见表2。
2 结果与分析
2.1 提取溶剂的优化
由于去离子水能促进真菌毒素从样品基质释放出来,真菌毒素的提取过程中首先加入10 mL去离子水浸泡样品。在此基础上,3种提取溶剂被用于样品基质中10种真菌毒素的提取,包括①10 mL去离子水,10 mL甲醇;②10 mL去离子水,10 mL乙腈;③10 mL去离子水,10 mL 1%甲酸乙腈。试验结果表明,甲醇有机相不能通过加入无机盐与水相分离。另一方面,第3种提取溶剂会导致伏马毒素B2的回收率异常高。而采用第2种提取溶剂时,真菌毒素的萃取效率和回收率均能得到较为满意的结果。因此,最终选择10 mL去离子水、10 mL乙腈为提取溶剂。
2.2 净化材料的优化
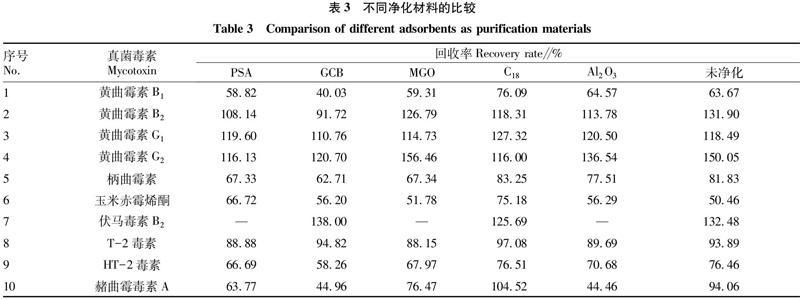
为了降低共提取化合物的干扰,试验测试了多种类型的净化材料,包括N-丙基乙二胺(PSA)、石墨化炭黑(GCB)、磁性氧化石墨烯(MGO)、C18和Al2O3。为了比较不同材料的净化能力,进行了6组平行试验,包括未净化的提取溶液。由表3可见,对于PSA材料,伏马毒素B2没有回收率,这可能是因为PSA含有氨基官能团,能与含羧基基团的化合物发生化学吸附。相似地,与未净化的提取溶液相比,含有羧基基团的赭曲霉毒素A的回收率也较低。对于吸附能力较强的GCB,柄曲霉素和HT-2毒素的回收率有所降低,而黄曲霉毒素B1和赭曲霉毒素A的回收率更低。对于MGO,伏马毒素B2同样没有回收率,这可能是由材料的氢键吸附造成。另一方面,比较MGO和未净化提取溶液的试验结果发现,两者具有相似的目标物回收率。说明MGO对苦荞样品中干扰物的净化能力比较有限。Al2O3的碱性性质造成伏马毒素B2没有回收率,而赭曲霉毒素A的回收率有所降低。相比之下,通过C18净化的目标物的回收率有所改善(75.18%~127.32%),它能降低样品基质的干扰,同时不对目标物产生不必要的吸附。因此,最终选择C18作为净化材料。
2.3 基质效应的考察
通过基质配标校准曲线的斜率与溶剂配标校准曲线的斜率百分比值定义方法的基质效应(信号增强或抑制,SSE),结果见表4。该比值代表了干扰物对目标分析物离子化效率的影响。从表4可以看出,黄曲霉毒素G1、G2,T-2毒素,赭曲霉毒素A的基质效应尚在可接受范围(80%~120%)。黃曲霉毒素B2和伏马毒素B2则具有显著的信号增强效应(SSE值>100%),而其他4种真菌毒素(黄曲霉毒素B1、柄曲霉毒、玉米赤霉烯酮、HT-2毒素)具有25%~40%的信号抑制效应(SSE值<100%)。
根据考察结果,50%的目标真菌毒素具有显著的基质效应。为了补偿基质效应的影响,选用基质配标法进行目标分析物的定量分析。基质匹配目标分析物的MRM色谱图如图1所示。
2.4 线性关系、检出限和定量限的考察
采用不含真菌毒素的苦蕎样品,按建立的样品预处理方法制备空白基质溶液。通过在空白基质液中加入相应量的真菌毒素混合标准品,配制基质匹配的系列标准溶液(0.5~50.0 μg/L,对于黄曲霉毒素B2、G2,浓度范围为0.125~12.500 μg/L)。以目标化合物的色谱峰峰面积为纵坐标、溶液浓度为横坐标,进行线性回归分析。方法的回归方程、决定系数、线性范围见表5。方法的检出限(3倍信噪比)及定量限(10倍信噪比)通过线性方程中最低浓度点计算得到。
由表5可见,决定系数(R2)均不小于0.994 0,表明校正曲线在0.125~50.000 μg/L具有较好的线性关系。10种真菌毒素的检出限(0.011~0.241 μg/L)及定量限(0.040~0.804 μg/L)表明方法具有较好的定性和定量分析能力。从另一方面来看,黄曲霉毒素B1、玉米赤霉烯酮和赭曲霉毒素A的检测能力均能满足多个国家对谷物中这3类真菌毒素的监管要求(表6)。而其他7种真菌毒素目前暂无谷物的限量规定。
2.5 回收率和重现性试验
在12份空白样品中分别加入一定量的混合标准溶液,得到2个浓度级别的6份平行加标样(2和10 μg/L,对于黄曲霉毒素B2、G2,浓度分别为0.5和2.5 μg/L)。按上述方法制备样品并进行检测,计算各真菌毒素的平均回收率和相对标准偏差(RSD)。结果表明(表7),平均回收率为89.70%~105.83%,RSD值为0.82%~8.45%,符合欧盟No 401/2006条例对真菌毒素定量分析的性能标准(回收率在70%~110%,RSD<15%)。
2.6 实际样品的检测
将建立的方法用于15个随机样品的检测分析。对于实际样品分析,采用相对离子丰度作为额外的定性分析准则。样品的检测结果见表8。
从检测结果(表8和图2)可以看出,46.7%的样品存在真菌毒素污染。虽然大部分毒素的污染浓度都低于方法的定量限,污染通常伴随多种类型的真菌毒素。对于13号样品,黄曲霉毒素B1的浓度超过了欧盟的监管限量。而其他被检测到的柄曲霉素、伏马毒素B2、T-2毒素、HT-2毒素暂没有针对谷物的限量规定。
3 讨论
该研究成功建立了苦荞基质中10种不同真菌毒素的QuEChERS-超高效液相色谱-串联质谱分析方法。该方法简单可靠、灵敏有效,适合大批量样品的高通量分析。从实际苦荞样品的分析得到以下结论:①该方法用于苦荞样品中多种真菌毒素的检测分析是切实可行的;②应探究更多种类的真菌毒素的同时检测方法;③由于真菌毒素污染通常伴随多种类型的真菌毒素,多组分真菌毒素的污染监管是很有必要的。
参考文献
[1]陈曦.苦荞功能成分研究文献综述[J].食品安全导刊,2018(33):162.
[2]林兵,胡长玲,黄芳,等.苦荞麦的化学成分和药理活性研究进展[J].现代药物与临床,2011,26(1):29-32.
[3]ZHANG Z L,ZHOU M L,TANG Y,et al.Bioactive compounds in functional buckwheat food[J].Food research international,2012,49(1):389-395.
[4]贾冬英,姚开,张海均.苦荞麦的营养与功能成分研究进展[J].粮食与
饲料工业,2012(5):25-27.
[5]张余,黄小燕,刘昌敏,等.苦荞营养保健成分及其食品开发研究进展与展望[J].粮食与油脂,2019,32(8):12-14.
[6]ARROYO-MANZANARES N,HUERTAS-PREZ J F,GARCA-CAMP AA A M,et al.Simple methodology for the determination of mycotoxins in pseudocereals,spelt and rice[J].Food control,2014,36(1):94-101.
[7]FUNG F,CLARK R F.Health effects of mycotoxins:A toxicological overview[J].Journal of toxicology:Clinical toxicology,2004,42(2):217-234.
[8]TURNER N W,SUBRAHMANYAM S,PILETSKY S A.Analytical methods for determination of mycotoxins:A review[J].Analytica chimica acta,2009,632(2):168-180.
[9]李蓉,黄莹偲,王勇,等.食品中真菌毒素检测技术的研究进展[J].中国卫生检验杂志,2015,25(18):3195-3198.
[10]FRENICH A G,ROMERO-GONZLEZ R,GMEZ-PREZ M L,et al.Multi-mycotoxin analysis in eggs using a QuEChERS-based extraction procedure and ultra-high-pressure liquid chromatography coupled to triple quadrupole mass spectrometry[J].Journal of chromatography A,2011,1218(28):4349-4356.
[11]LIU Q T,KONG W J,GUO W Y,et al.Multi-class mycotoxins analysis in Angelica sinensis by ultra fast liquid chromatography coupled with tandem mass spectrometry[J].Journal of chromatography B,2015,988:175-181.
[12]CHO H D,SUH J H,FENG S,et al.Comprehensive analysis of multi-class mycotoxins in twenty different species of functional and medicinal herbs using liquid chromatography-tandem mass spectrometry[J].Food control,2019,96:517-526.
[13]谭杰,杜苑琪,肖小华,等.食品中霉菌毒素样品前处理及分析方法研究进展[J].分析测试学报,2017,36(6):829-840.
[14]ANASTASSIADES M,LEHOTAY S J,TAJNBAHER D,et al.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residues in produce[J].Journal of AOAC International,2003,86(2):412-431.
[15]YOGENDRARAJAH P,VAN POUCKE C,DE MEULENAER B,et al.Development and validation of a QuEChERS based liquid chromatography tandem mass spectrometry method for the determination of multiple mycotoxins in spices[J].Journal of chromatography A,2013,1297:1-11.
