TSH抑制疗法对老年甲状腺癌患者甲状腺全切除术后的疗效分析及对血清Tg、TSH、CEA水平的影响
2021-02-17赵富利康艳丽马瑜瑾梁丽君
赵富利 康艳丽 马瑜瑾 梁丽君
甲状腺癌在全部恶性肿瘤中仅占1%左右,如不能进行及时治疗,瘤体进展会威胁患者气管和喉部神经,严重者甚至发生转移,导致预后较差[1]。临床根据组织学特征将甲状腺癌分为分化型和未分化型两类,其中90%以上为分化型,且分化型恶性程度相对较低,通过手术治疗可达到较好效果[2]。然而分化型甲状腺癌大部分为老年患者,常合并一种或多种基础疾病,使身体耐受力下降,加大了治疗难度。相关指南表示,激素替代疗法和促甲状腺激素(thyroid stimulating hormone,TSH)抑制疗法是甲状腺癌全切除术后标准治疗方案,区别在于血清TSH控制范围差异,优势和劣势争议较大[3]。甲状腺癌是激素依赖性肿瘤,其发生发展与TSH水平显著相关,甲状腺组织癌变后仍然存在正常激素受体系统,TSH同样能够加速癌变组织生长。血清甲状腺球蛋白(thyroglobulin,Tg)是重要前体蛋白,由甲状腺素合成得到,研究证实,在甲亢或甲状腺肿瘤等病变中其呈高表达,说明其可以作为甲状腺癌治疗和预后重要评估指标[4]。癌胚抗原(carcinoembryonic antigen,CEA)是一类酸性蛋白,具有类胚胎抗原决定簇特征,与多种肿瘤疾病发生发展显著相关[5]。本研究选择TSH抑制疗法治疗老年甲状腺癌甲状腺全切除术后患者,观察其临床疗效及对血清Tg、TSH、CEA水平的影响。
1 资料与方法
1.1 一般资料
选取2018年4月至2020年4月我院诊治的老年甲状腺癌甲状腺全切除术后患者76例,根据是否进行TSH抑制疗法分为观察组(40例)和对照组(36例),观察组男性13例,女性27例,年龄61~76岁,平均年龄(65.43±4.11)岁;病理类型:乳头状癌26例、滤泡状癌9例、髓样癌5例;肿瘤分期:Ⅰ期3例、Ⅱ期24例、Ⅲ期13例。对照组男性12例,女性24例,年龄61~76岁,平均年龄(66.14±4.15)岁;病理类型:乳头状癌25例、滤泡状癌7例、髓样癌4例;肿瘤分期:Ⅰ期2例、Ⅱ期22例、Ⅲ期12例。两组性别、年龄及病理类型等比较无统计学意义(P>0.05)。
纳入标准:(1)符合《外科学.第8版》[6]中甲状腺癌诊断标准,且经病理证实;(2)均接受甲状腺全切除术治疗;(3)无颈部淋巴结及其他部位转移;(4)预计生存时间>1年。排除标准:(1)合并低蛋白血症,或患有意识障碍;(2)患有心、肝、肾等重要脏器损伤,如先天性心脏病、糖尿病及肾衰竭等;(3)合并其他恶性肿瘤,如肺癌等;(4)近1个月服用影响本研究指标药物或近3个月服用免疫抑制剂。
1.2 方法
两组均进行甲状腺全切除术,术中取切除组织周围组织取样活检,确保肿瘤彻底清除。对照组采用TSH替代疗法,给予患者左甲状腺素钠片(德国默克,50 μg*100s,生产批号20180127),清晨顿服,初期采用50 μg/d,两周调整剂量为100 μg/d,治疗3个月。控制TSH在正常范围内(0.3~5.0 mIU/L)、控制FT3在正常范围内(2.16~6.78 pmol/L)、控制FT4在正常范围内(10.3~25.8 pmol/L)水平。观察组采用TSH抑制疗法,服用相同药物,调整剂量为75~150 μg/d,控制TSH水平低于0.3 mIU/L,治疗3个月。
1.3 观察指标
(1)临床疗效[7]。显效:临床症状、甲状腺功能各项指标恢复至正常功能,或好转高于治疗前30%;有效:临床症状、甲状腺功能各项指标有所好转,或好转高于治疗前10%~30%;无效:临床症状、甲状腺功能各项指标无明显变化,或好转高于治疗前10%及以下。总有效率=(显效/n+ 有效/n)×100%。
(2)甲状腺功能评估:治疗前后采集患者清晨空腹静脉血4 ml,通过抗凝、离心等处理取血清,应用全自动生化分析仪检测TSH、游离三碘甲状腺原氨酸(free three iodine thyroxin,FT3)、游离甲状腺素(free thyroxine,FT4),严格按照配套试剂盒说明书进行。统一由两名专科医生检测。
(3)Tg和CEA水平检测:取血清同(2),采用全自动化学发光免疫分析仪检测Tg水平,采用全自动免疫分析仪(西门子,Centaur-XP)检测CEA水平,均严格按照配套试剂盒说明书进行,且统一由两名专科医生检测。
(4)T细胞亚群检测:取血清同(2),采用流式细胞仪检测CD3+、CD4+和CD8+水平。
1.4 统计学方法
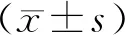
2 结果
2.1 两组临床疗效比较
观察组总有效率高于对照组(90.00%vs 72.22%)(P<0.05),见表1。

表1 两组临床疗效比较(例,%)
2.2 两组甲状腺功能比较
治疗前两组TSH、FT3、FT4水平比较无统计学意义(P>0.05);治疗后观察组TSH水平低于同组治疗前和对照组,FT3、FT4水平高于同组治疗前和对照组,对照组TSH水平低于同组治疗前,FT3、FT4水平高于同组治疗前(P<0.05),见表2。
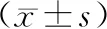
表2 两组甲状腺功能比较
2.3 两组肿瘤标志物比较
治疗前两组Tg和CEA水平比较无统计学意义(P>0.05);治疗后,观察组Tg和CEA水平低于同组治疗前和对照组,对照组Tg和CEA水平低于同组治疗前(P<0.05),见表3。
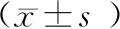
表3 两组肿瘤标志物水平比较
2.4 两组T淋巴细胞亚群比较
治疗前两组CD3+、CD4+和CD8+水平比较无统计学意义(P>0.05);治疗后观察组CD3+和CD4+水平高于同组治疗前和对照组,CD8+水平低于同组治疗前和对照组,对照组CD3+和CD4+水平高于同组治疗前,CD8+水平低于同组治疗前(P<0.05),见表4。
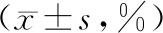
表4 两组T淋巴细胞亚群比较
3 讨论
甲状腺癌恶性程度低,进展速度慢,经手术切除可达到较好效果[8]。然而甲状腺癌变后经部分或全部切除甲状腺,破坏了机体甲状腺相关激素分泌和调节稳定性,术后甲状腺功能降低,极大程度影响了能量系统调控、蛋白质转化及内分泌稳定[9]。因此甲状腺癌手术切除后需要接受内分泌治疗,控制机体的甲状腺激素水平在安全范围内,以便于甲状腺功能正常运行。目前临床对甲状腺癌患者手术切除后内分泌治疗包括激素替代治疗和TSH抑制治疗。两种治疗方案均采用左旋甲状腺素进行补充,但两种方案优势和劣势临床争议较大,大部分学者认为补充和抑制两个步骤必不可少,少数部分学者认为补充优势大于抑制,对于两种方案临床疗效临床报道较少,但结果一致性差,可能选择疗效指标终点与其它因素影响有关[10-11]。
本研究结果表示,观察组总有效率90.00%高于对照组72.22%。提示TSH抑制疗法对老年甲状腺癌甲状腺全切除术后患者疗效较好,分析原因可能是TSH抑制疗法能够提高甲状腺激素水平,促进了蛋白质新陈代谢和激素平衡。TSH抑制疗法主要是将TSH水平控制在正常底限或底限之下,或者检测不出,便于甲状腺激素补充,阻碍甲状腺癌细胞生长[12]。本研究结果表示,观察组TSH水平低于对照组,FT3、FT4水平高于对照组。说明TSH 抑制疗可将甲状腺功能稳定在亚甲亢状态,分析原因为TSH 抑制疗法减少了甲状腺激素,与贺志刚等[13]研究结果相近。Tg是甲状腺滤泡内胶质重要组成部分,在TSH刺激作用下可被蛋白酶水解,并通过基底细胞膜弥散至毛细血管,从而进入甲状腺细胞,当甲状腺发生病变时其水平会显著增加[14]。CEA分泌受胚胎细胞相关基因控制,当某种癌细胞基因调控遭到破坏,会重启关于胎儿蛋白合成,使患者体内CEA表达增加,临床上CEA在胃肠道具有高敏感性,在甲状腺癌分类中,其在髓样癌、未分化癌、乳头状癌及滤泡状癌等中表达较高,因此可将CEA作为评估甲状腺癌病情重要检测指标[15]。本研究结果表示,观察组Tg和CEA水平低于对照组。说明TSH抑制疗法控制老年甲状腺癌甲状腺全切除术后患者血清Tg、CEA水平,分析原因是TSH抑制疗法控制了甲状腺激素水平,稳定了甲状腺功能,从而降低了Tg和CEA水平,与王德平等[16]研究报道一致。本研究还得出,观察组CD3+和CD4+水平高于对照组,CD8+水平低于对照组。说明老年甲状腺癌甲状腺全切除术后采用TSH抑制疗法有利于调节细胞免疫功能。研究显示,甲状腺癌发生发展与肿瘤分化程度有关,同时与机体免疫功能相关,甲状腺癌患者具有免疫功能失衡特征[17]。甲状腺全切除术后实施TSH抑制疗法可辅助清除肿瘤病灶,降低肿瘤复发和转移发生率,进而促进老年甲状腺癌患者细胞免疫功能改善。
综上所述,老年甲状腺癌甲状腺全切除术后患者采用TSH抑制疗法,对甲状腺功能影响小,可降低TSH水平且能抑制Tg、CEA表达,改善免疫功能,进而临床疗效较好。本研究不足之处在于样本量纳入较少,且仅随访了6个月,随访时间较短,后续会扩大样本量,延长随访时间,提升老年甲状腺癌甲状腺全切除术后治疗效果。
