EZH2表位肽在多发性骨髓瘤中的预测和验证
2021-02-17钟赟刘哲
钟 赟 刘 哲
多发性骨髓瘤(multiple myeloma,MM)是一类源自于B细胞的血液系统恶性肿瘤,它占所有恶性肿瘤的1%,占到了血液系统恶性肿瘤的13.4%,是血液系统恶性肿瘤发病率第二的恶性肿瘤[1]。MM是由浆细胞单克隆性增殖引起,最终导致靶器官受损。目前,尽管部分患者通过化疗、靶向治疗、造血干细胞移植能得到暂时缓解,但是最后发现大部分患者仍会复发[2],进而出现大多数患者仍无法治愈的结果。因此我们亟待寻求一种确实有效的治疗方法,以期望能治愈多发性骨髓瘤。
染色质水平的修饰是基因表达调控的重要途径,(PcG)蛋白介导的基因转录抑制是目前在基因表达调控方面的研究热点[3]。近阶段的研究发现,PcG蛋白与X 染色体的失活、干细胞分化、细胞癌变等存在密切的关系,而EZH2蛋白是PcG蛋白核心复合体的重要构成部分。研究者在多种实体瘤及血液系统肿瘤中均发现EZH2蛋白的高表达,如前列腺癌、乳腺癌、MDS及淋巴瘤等,并且发现 EZH2 蛋白的高表达常与预后相关,它预示肿瘤恶性程度高且有发生广泛转移的倾向[4]。一般认为 EZH2 蛋白通过其甲基转移酶活性在染色体水平抑制基因转录。正常的骨髓浆细胞不表达 EZH2,当发生浆细胞肿瘤时,EZH2会随着疾病进展逐步上调表达。在过去的的研究中,有学者用 siRNA的方法将细胞株中的EZH2表达沉默,发现EZH2表达水平下调的肿瘤细胞株停止生长[5]。 因此,我们基于上述研究成果,初步可预测在肿瘤中大量表达的EZH2蛋白,实际上在肿瘤细胞分化、生长、发展过程中起到了抗凋亡分子的某些作用,因此可认为EZH2蛋白是一种较为理想的恶性肿瘤包括多发性骨髓瘤的免疫治疗假想靶点。
本研究应用生物信息学软件对EZH2蛋白进行HIA-A0201限制性CTL抗原表位的初步预测,验证该表位肽是生理和病理情况下都存在的,为多发性骨髓瘤免疫治疗奠定基础。
1 材料与方法
1.1 临床资料
选取2018年1月至2018年12月的初诊且按NCCN诊断标准确诊为多发性骨髓瘤的患者30例作为MM组,取同期健康体检者30例作为健康对照组,本实验研究中的相关部分已获得所在医院的伦理委员会的批准,并与患者、家属均签署了相关知情等告知性同意书。
1.2 试剂和仪器
人TAP-缺陷型细胞株T2(HLA-A0201)(上海复祥生物科技有限公司提供);流感病毒基质蛋白肽段(上海波泰生物科技有限公司);PBS缓冲液(上海生工生物工程有限公司提供),RPMI1640培养液、FBS(GIBCO公司);胞外布雷菲德菌素(上海同田生物技术有限公司)HIV-l pol肽段、FITC标记小鼠抗人HLA-A02单克隆抗体(北京表源生物技术有限公司);BB7.2与PE标记的aa27及aa670肽段四聚体(北京表源生物技术有限公司);β2微球蛋白(Raybiotech公司)。
主要仪器和设备:流式细胞仪(Beckman Coulter公司);96孔板(丹麦NUNC公司);二氧化碳恒温细胞培养箱(日本SANYO公司生产);无菌超净工作台(吴江市净化设备总厂生产);电热恒温水浴锅(上海医疗器械一厂生产);IMT-2型倒置显微镜(日本olympus公司生产)。
1.3 生物信息软件
本研究采用以下生物信息学软件NCBI NP-00309(http:// www.ncbi.nlm.nih.gov/genbank/);BIMAS(http://www-bimas.cit.nih.gov/ molbio/hla_bind);SYFPEITHI(http://www.syfpeithi.de/ Scripts/ MHCScrver.dll/ EpitopePrediction.htm)。
1.4 主要方法
1.4.1 HLA-A0201限制性EZH2蛋白CTL表位肽预测 根据在Genbank中登记的相关数据,查找出EZH2蛋白的信息,从而确定好EZH2的蛋白氨基酸序列,并由NIH/BIMAS系统预测出数个EZH2蛋白相关的HLA-A0201限制性的CTL表位肽构成,再通过SYFPEITHI系统对上述表位肽进行验证,选取累计积分最高的肽片段。使用超基序方案对已预测出的CTL表位肽片段进行修饰以进一步提高积分。我们通过NIH/BIMAS提供表位肽预测的网络服务站点,将EZH2蛋白序列检测出分别独立预测得分值较高的抗原多肽,预测出多条表位肽,并通过量化基序方案以及超基序方案进一步筛选出最合适的2条表位肽。
1.4.2 多肽的合成与验证 在研究中所使用的全部肽段均由上海波泰生物科技公司合成并验证。结合文献报道及相关预测,我们在实验中预测并选取分别合成出了2条HLA A0201阳性肽(HIV-1 pol肽段,序列:ILKEPVHGV;流感病毒基质蛋白肽段,序列:GILGFVFTL;)作为本实验的阳性对照。
在线筛选出2条EZH2高积分肽段,同时使用HLA-A0201+T2杂交瘤细胞验证肽段的亲和力、稳定性,在此基础上筛选出具备高亲和力和稳定性的一条肽段。
1.4.3 T2细胞表位肽结合亲和实验 将细胞密度为2×105/孔T2细胞混悬液制备备用,并分别依次接种于24孔细胞培养板中备用;实验中按方案设立分组为实验组、阳性对照组、空白对照组,并在实验中每个实验组设3个副孔,通过调整后每孔含2.5 μg/mL β2微球蛋白。实验中每孔加入相应的候选肽段作为实验组,其余部分孔位中加入对照肽段的为阳性对照组,剩余的未加肽段的T2细胞孔位作为空白对照。后将所有细胞孵育18 h,完成后分别收集细胞,洗涤3次,再分别加入FITC标记的HLA-A0201单克隆抗体,并通过流式细胞仪检测平均荧光强度。
试验中使用荧光系数(FI)作为衡量亲和力的指标,荧光系数>1的表位肽被认为HLA-A0201的分子具有高亲和力,荧光系数由以下公式计算得到:荧光系数(FI)=(样本平均荧光强度-空白对照平均荧光强度)/空白对照平均荧光强度。
1.4.4 T2细胞表位肽结合稳定性实验 分别将密度为1×105/孔的混悬液接种到96孔细胞培养板中备用,再分别依次加入β2微球蛋白,分组为无血清1640培养基以及对照肽段和相应的候选肽段,并共同孵育18 h后,再次洗涤细胞后孵育1 h,并预设不同的时间点(0,2,4,8,12,24 h)按计划分次收集细胞。每一个实验组设置3个副孔,分别加入FITC标记的HLA-A0201单克隆抗体,并尽早使用流式细胞仪检测平均荧光强度。
1.4.5 检测患者、健康对照者所筛选肽段相对应五聚体阳性细胞毒性T细胞 分别按分组情况,收集多发性骨髓瘤患者及健康对照者的外周血5 ml,并提取外周血单个核细胞,并将1×106个单个核细胞加入2 μL同型对照和所筛选表位肽对应的五聚体,孵育40 min,加入FITC标记的CD8+单克隆抗体,取出后进行流式细胞仪检测。
1.5 统计学分析
数据采用Graphpad Prism6软件进行统计学分析。
2 结果
2.1 HLA-A0201限制性EZH2蛋白CTL表位肽预测
EZH2蛋白氨基酸序列的确定:我们在Genbank中登记的数据中查找到了EZH2蛋白,它由746个氨基酸残基组成,Genbank登录号为:AAC51520.1,其编码的蛋白质序列如下:mgqtgkksek gpvcwrkrvk seymrlrqlk rfrradevks mfssnrqkil erteilnqew kqrriqpvhi ltsvsslrgt recsvtsdld fptqviplkt lnavasvpim yswsplqqnf mvedetvlhn ipymgdevld qdgtfieeli knydgkvhgd recgfindei fvelvnalgq yndddddddg ddpeereekq kdledhrddk esrpprkfps dkifeaissm fpdkgtaeel kekykelteq qlpgalppec tpnidgpnak svqreqslhs fhtlfcrrcf kydcflhpfh atpntykrkn tetaldnkpc gpqcyqhleg akefaaalta eriktppkrp ggrrrgrlpn nssrpstpti nvleskdtds dreagtetgg enndkeeeek kdetssssea nsrcqtpikm kpnieppenv ewsgaeasmf rvligtyydn fcaiarligt ktcrqvyefr vkessiiapa paedvdtppr kkkrkhrlwa ahcrkiqlkk dgssnhvyny qpcdhprqpc dsscpcviaq nfcekfcqcs secqnrfpgc rckaqcntkq cpcylavrec dpdlcltcga adhwdsknvs ckncsiqrgs kkhlllapsd vagwgifikd pvqknefise ycgeiisqde adrrgkvydk ymcsflfnln ndfvvdatrk gnkirfanhs vnpncyakvm mvngdhrigi fakraiqtge elffdyrysq adalkyvgie remeip。通过CTL表位肽在线预测网站预测出积分较高的肽段:YMCSFLFNL 及 SQADALKYV。如表1。
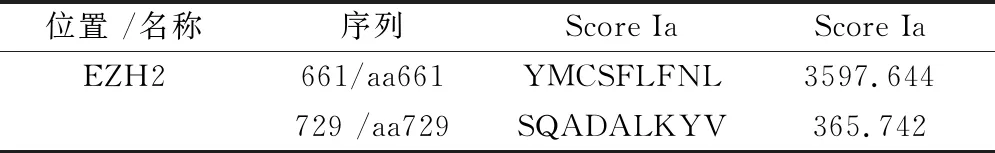
表1 CTL表位肽对EZH2积分较高肽段的预测
完成 EZH2-HLA0201 特异性肽段筛选,筛选出“YMCSFLFNL”肽段进行下一步功能实验,实验结果表明“YMCSFLFNL”肽段与HLA-A020结合是稳定的。见图1、2。
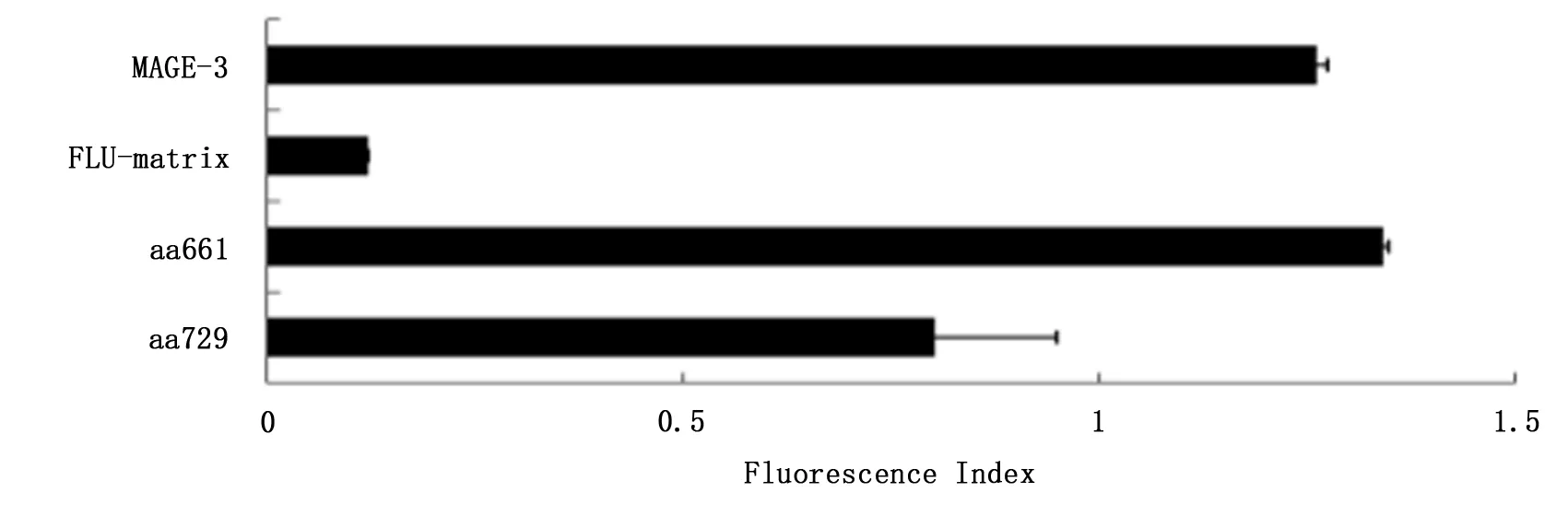
图1 EZH2 肽段与T2细胞结合力实验结果
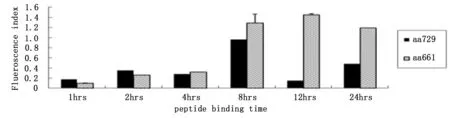
图2 EZH2 肽段与T2细胞结合稳定性实验结果
2.2 HLA-A0201限制性EZH2蛋白CTL表位肽验证
初步证明合成的EZH2-CTLS五聚体在健康供者及患者中都存在,并发现多发性骨髓瘤患者体内 EZH2-CTLS水平显著高于健康对照者。见图3。
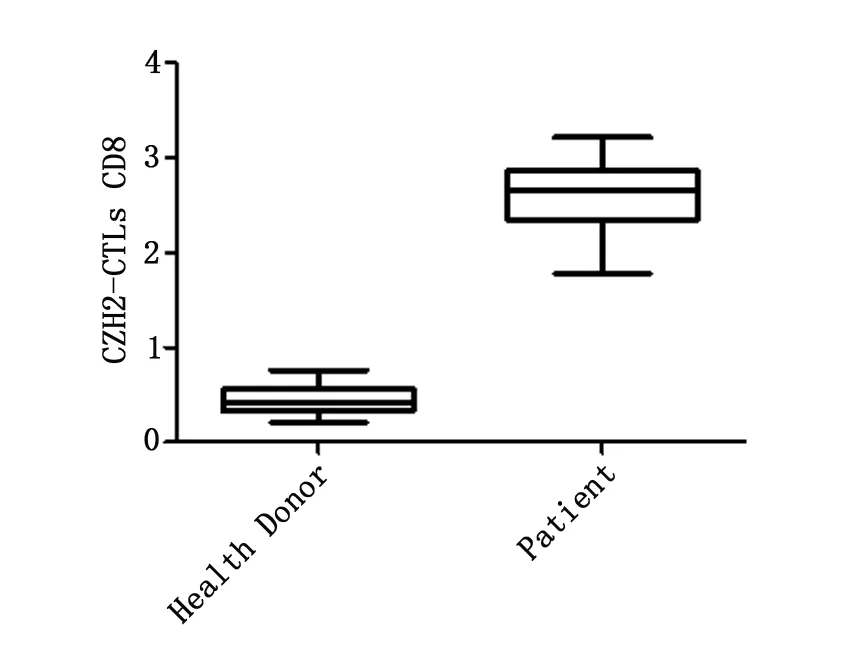
图3 患者和健康对照者EZH2-CTLs水平测定
3 讨论
多发性骨髓瘤是血液系统恶性肿瘤第二高发的,目前治疗中大部分患者仍不能治愈。多发性骨髓瘤的疾病特点是单克隆的浆细胞呈恶性增殖,从而导致多发骨质破坏、并进一步导致肾功能衰竭等在内的各个靶器官的功能性损害。我们希望设计出一种全新的治疗方式来达到稳定甚至起到清除那些已经通过自体造血干细胞移植来达到缓解的或者稳定的患者体内的可能存在的微小残留病灶。
免疫治疗一直是医学研究的热点,免疫治疗或许可以成为治愈MM的一种新的选择。研究者一直积极探索了许多MM的靶点,比如未折叠蛋白(XBP1)[6]、热休克蛋白(HSP)[7]及 CD138+[8]等,但上述靶点均存在相当的局限性[9]。近来的研究发现免疫治疗就是这样一个无极接近设想的治疗效果的理想的选择,免疫治疗可以有效清除骨髓瘤患者体内存在的微小残留病灶,甚至可以达到替代常规化疗巩固疗效的作用。今年来已经有少数学者通过使用来自患者血清的独特型免疫球蛋白作为疫苗进行免疫治疗,但是结果并不理想,因为研究发现在体内这种多发性骨髓瘤特异性T细胞被清除了,而且这种独特型免疫球蛋白肽段也不是所有骨髓瘤患者的共同肿瘤抗原[10]。为了能提供更有效的免疫治疗策略,我们需要找到一种骨髓瘤患者共有的肿瘤特异性抗原。EZH2具有理想肿瘤抗原的特性,在很多肿瘤中高表达,最重要的是EZH2对于肿瘤细胞的生存至关重要,下调或者抑制EZH2的表达会使肿瘤细胞显著凋亡[11-12]。
本研究通过在线筛选出EZH2高积分肽段,同时通过 T2细胞实验进一步筛选出具备高亲和力及稳定性的一条肽段,合成五聚体后已分别在健康供者及患者外周血中检测到不同水平的EZH2-CTLs,证明该表位肽是在生理及病理情况下自然存在的,为后续EZH2表位肽作为MM治疗的靶点运用于临床奠定了基础。
