体外电转染TGF-β1质粒对背根神经节轴突生长的影响①
2021-02-10胡译文王锐英刘瑞端王锐英刘瑞端
胡译文,张 衡,王锐英,沈 翀,刘瑞端,张 衡,王锐英,沈 翀,刘瑞端
(桂林医学院附属医院骨科,广西 桂林 541001)
周围神经损伤是生活和工作中的常见事件,周围神经在受到机械外力及各种理化因素损伤后,其神经元胞体、轴突、髓鞘等均会发生一系列的变性反应。病理表现为胞体肿大,尼氏体溶解或消失。修复周围神经损伤的关键是神经元胞体的存活及轴突的延伸[1]。近年来运用转基因技术治疗周围神经损伤已成为研究热点[2]。转化生长因子β1(transforming growth factor beta1,TGF-β1)是一种相对分子质量为 25 000 的活性多肽,属于转化生长因子TGF-β(transforming growth factor beta)多肽家族,具有拮抗肿瘤坏死因子(tumor necrosis factor-alpha,TNF-a)的效应,抑制细胞内钙离子浓度变化,拮抗兴奋性氨基酸的神经毒性作用。周围神经挤压损伤,TGF-β1含量上升[3-4]。质粒是小型环状DNA分子,是基因工程最常用、最简单的载体。笔者应用电转染方法将构建的TGF-β1质粒转染入背根神经节细胞中[5],培养背根神经节细胞,然后,观察TGF-β1对背根神经节细胞轴突生长的影响。
1 材料和方法
1.1 实验动物
8~10周龄C57BL/6健康雄性小白鼠6只,体重25~35 g,来源于桂林医学院实验动物中心。小鼠的饲养与实验均在桂林医学院实验动物中心完成,环境温度控制在20~23 ℃,湿度控制在40%~50%,室内光照时间为10∶00 am至22∶00 pm,黑暗时间为22∶00 pm至10∶00 am。动物饲料及饮用水均按照严格规范进行处理,小鼠饮用水pH值为3.0~3.5,按需、定期更换笼具及饮水瓶。
1.2 主要实验仪器和试剂
倒置荧光显微镜(德国Carl Zeiss);NucleofectorRII 细胞核转染仪,Amaxa电转液(德国Lonza);TGF-β1质粒(美国Clontech);pBR322质粒(美国Thermo Scientific);胰酶,Ⅱ型胶原酶(Gibco公司);MEM培养基,胎牛血清,兔抗小鼠TGF-β1单克隆抗体,β-actin单克隆抗体,红色荧光二抗免疫组织化学试剂(美国cell singling);兔抗小鼠Tuj1单克隆抗体(美国Covance)。
1.3 背根神经节细胞的分离、培养与分析
分离小鼠DRG 内的背根神经节细胞进行原代培养;培养成功后,进行背根神经节细胞电转染,设对照组和TGF-β1组。具体方法如下:C57BL/6小白鼠脱颈处死后,严格遵守无菌操作,用小组织剪沿小鼠背部皮肤正中线依次剪开皮肤,剥离皮下组织和脊椎旁肌肉,取出小鼠脊柱两侧背根神经节置于MEM无血清培养基中;吸除培养基,于37 ℃ 1 mlⅡ胶原酶中消化90 min,700 r离心 8 min后移除Ⅱ胶原酶,加入500 μl胰酶,37 ℃下消化15~20 min;700 r离心8 min,洗涤3次后,进行转染。对照组中加入100 μl Amaxa电转液(含浓度为4 μg/ml的 pBR322空白质粒10 μl与90 μl Amaxa电转液)重悬细胞团; TGF-β1组加入100 μl电转混合液(浓度为4 μg/ml的TGF-β1质粒10 μl与90 μl Amaxa电转液)重悬细胞团;细胞悬液转移至电转杯,置入NucleofectorRII 细胞核转染仪,选择G13程序进行质粒电转染[6];电转染后,加入含10%胎牛血清(FBS)的MEN培养基,将细胞浓度调整至1×105个/ml,加入至有无菌盖玻片(多聚赖氨酸及层粘连蛋白浸泡过)的24孔培养板中,置37 ℃、5% CO2培养箱中培养,3 d后用无菌PBS洗涤细胞,然后,进行Tuj1免疫组化染色:每孔加入200 μl 4%多聚甲醛PFA固定细胞,PBS液洗3次, 5 min/次;0.5% TritonX-100 孵育20 min,PBS洗3次, 2 min/次;3% H2O2室温孵育5~10 min,每孔加入500 μl封闭液(1%胎牛血清,0.1% Triton X-100,2%山羊血清混合配制而成)于室温下封闭60 min;吸除封闭液,PBS洗3次, 5 min/次;每孔的盖玻片上滴加30 μl兔抗小鼠Tuj1单克隆抗体(1∶1 200)孵育1 h;PBS冲洗3次,滴加30 μl红色荧光二抗孵育1 h,PBS洗3次后,取出盖玻片,用MOUNT液封闭;置于倒置荧光显微镜下观察神经细胞轴突生长情况并拍照。每组取100个DRG细胞,采用Axio-Vision4.6 software软件分析神经细胞轴突长度。
1.4 Western-blot检测TGF-β1
细胞培养3 d后,收集对照组和TGF-β1质粒电转染组的背根神经节细胞,加入RIPA buffer 100 μl细胞裂解液,细胞裂解后以13 500 r离心10 min,提取总蛋白,100 ℃变性10 min;取20 μl总蛋白样品置10% SDS-PAGE胶中电泳分离,然后将蛋白转移至聚偏二氟乙烯膜;5% 脱脂奶粉常规封闭 1 h,加入兔抗小鼠TGF-β1单克隆抗体(1∶1 000),4 ℃过夜,室温下加入二抗(羊抗兔IgG,1∶10 000)孵育1 h,ECL 显色。β-actin单克隆抗体(1∶25 000 稀释液)为内参照。应用Image-J图像分析软件分析数据,实验重复 3 次。
1.5 统计学分析
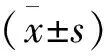
2 结果
2.1 背根神经节细胞形态
背根神经节细胞培养4 h后开始贴壁,1 d后在显微镜下观察可见胞体周围开始有轴突长出,3 d后形态更为典型,细胞胞体呈圆形,胞体发出两条线状轴突,轴突上有少量分叉。
2.2 背根神经节细胞轴突长度
背根神经节细胞培养3 d后,免疫荧光染色,Axio-Vision4.6 software软件分析背根神经节细胞轴突长度,TGF-β1组为(5.231±1.03)mm, 对照组为(3.342±0.72)mm,TGF-β1组背根神经节细胞轴突明显长于对照组, 差异有统计学意义(P<0.05),见图1。

图1 显微镜下观察Tuj1染色后的背根神经节细胞(100×)
2.2 TGF-β1蛋白表达
TGF-β1组TGF-β1蛋白条带灰度扫描值(1.09±0.01)大于对照组(0.46±0.02),差异有统计学意义(P<0.05),TGF-β1组TGF-β1蛋白表达量高于对照组,见图2。

图2 Western-blot检测 TGF-β1蛋白表达
3 讨论
周围神经损伤呈逐年升高趋势,它可引起严重神经功能障碍[7]。周围神经损伤会造成一段或整段神经纤维的变性或坏死,同时不可避免地损伤相应的神经元细胞,引起胞体病理性变化[8]。由于周围神经纤维的可再生性,利用转基因技术增强神经纤维再生能力,抑制神经元细胞胞体肿大及尼氏体溶解,促进轴突再生,修复周围神经损伤[9]。神经轴突的再生需要神经元胞体的基因调节和位于轴突生长锥处的轴突组织合成,因此,近年来运用转基因技术治疗周围神经损伤已经成为研究热点。
TGF-β是有多种功能的蛋白多肽大家族,目前已发现转化生长因子β1-5种分子。转化生长因子β广泛存在于动物的正常组织和转化细胞中,以骨组织和血小板中含量最高,在骨组织中又以TGF-βl含量最高。TGF-βl由两条肽链组成,每条肽链上有112个氨基酸,相对分子质量为25 000,TGF-βl有耐酸、碱,热和耐变性等特性[10]。神经系统的TGF-β1则存在于脑脊膜、脉络膜丛及外周神经与神经节中,有研究发现,TGF-β1可降低细胞内Ca2+浓度,抗细胞凋亡,拮抗兴奋性氨基酸的神经毒性,且具有维持神经的结构稳定性,保护运动和感觉神经元免受损伤[11]。Caruso等[12]研究发现,TGF-β1表达缺失导致患者脑部组织炎性损伤加重。Jiang等[13]用 TGF-β1孵育神经细胞24 h,一氧化氮导致的神经毒性明显降低。近年来,电转染DRG细胞方法已广泛应用于周围神经轴突再生[14],体外电转染有明显的优势:转染所需时间短,瞬时基因转染有更高的转染效率,更适用于对DRG神经元及轴突生长的生物学分析。本实验应用成熟的体外电转染方法将重组TGF-β1质粒转染入背根神经节细胞,实验结果表明,TGF-β1具有促进背根神经节细胞轴突生长,修复周围神经的损伤,但TGF-β1促轴突生长的分子机制还不清楚,还待进一步研究与探索[15]。
