运用希浦传导系统解剖指导传导束起搏定位
2021-02-04蒋丽梦苏蓝黄伟剑
蒋丽梦 苏蓝 黄伟剑
2000年Deshmukh等[1]首次报告了永久性希氏束起搏,2017年黄伟剑等[2]首次提出了左束支起搏的概念,不同部位的精确起搏对术者提出更高的要求:需要熟知房室结区、希氏束和左束支解剖分布特点及其变异。本文从既往研究中总结、分析希浦传导系统的解剖特点以及与传导系统病变发生的关系,以期更好地指导希浦传导系统起搏,提高手术成功率,减少手术相关并发症。
1 房室结区
人房室结位于由冠状窦、Todaro肌腱和三尖瓣围成的Koch三角内[3],长5~7 mm、宽2~5 mm,是心脏激动从心房传导到心室的正常路径。房室结呈一侧稍平的双凸透镜状结构,位于中央纤维体的右侧,冠状窦口的前上方,房间隔右侧的心内膜下,界限清楚,向前延伸形成希氏束,向后形成结后延伸部[4]。见图1。房室结的血供主要来源于右冠状动脉。
2 希氏束
既往文献报道,希氏束平均长1.8 cm,平均直径3~5 mm,由穿透部分和分支部分组成。穿透部分由房室结延续而来,穿过中央纤维体,到达室间隔顶部,长约20 mm,呈线性结构,毗邻室间隔膜部、中央纤维体、二尖瓣环、三尖瓣隔瓣[5-6]。分支部分位于室间隔的顶部,长5~10 mm,呈细长线形结构,在左侧间隔表面向下和稍向前走行一段距离后发出左右束支。Massing等[7]发现大多数人的希氏束走行在左侧室间隔,即“左侧型”;仅少数为穿行于右侧室间隔室上嵴的“右侧型”,这可能影响到延续的左束支近端在室间隔的分布。
Kawashima等[4]报道了105例人体解剖结果,根据希氏束在右侧室间隔内膜下的深度,存在3种解剖分型:Ⅰ、Ⅱ、Ⅲ型。Ⅰ型(46.7%):希氏束位于室间隔膜部,与房室结大小相近,由一层薄的结缔组织包裹,容易与周围的心肌明确区分。Ⅱ型(32.3%):希氏束穿行于室间隔的肌部,远离室间隔膜部的下缘,形态、边界难以与周围心肌区分。Ⅲ型(21.0%):该型为裸露的希氏束,走行于室间隔膜部。因这一类型希氏束直接位于心内膜下,位置比较表浅,所以其结构可以被更清楚地识别。Ⅱ型的希氏束走行深入心内膜下,可以解释部分患者不容易标测到希氏束电位的原因。
关于希氏束内的传导纤维纵向排列理论,早在1976年由Massing等[7]提出,即左右束支在希氏束主干中提前分化,并且彼此分隔,即纵向分离学说[8-9]。Sharma等[10]使用光学和电子显微镜进行的观察发现,希氏束大部分由最终进入左束支的细胞组成,这些细胞被胶原纤维纵向分割,可以减少甚至阻止横向激动的扩散;同时,具有特殊细胞间连接的分隔组织可以促进快速纵向传导:这些发现提示了左右束支在希氏束层面的纵向分离。在1例希氏束起搏联合房室结消融的病例中也证实了解剖分离的电生理现象(图2),由于左右束支在希氏束内的解剖分离,消融前起搏夺获左侧传导系统,左束支逆行激动右束支近端,右束支再顺行传导,因此起搏QRS呈正常形态;而消融阻断电极近端逆传后,改变不同输出电压时起搏形态始终呈右束支传导阻滞图形。
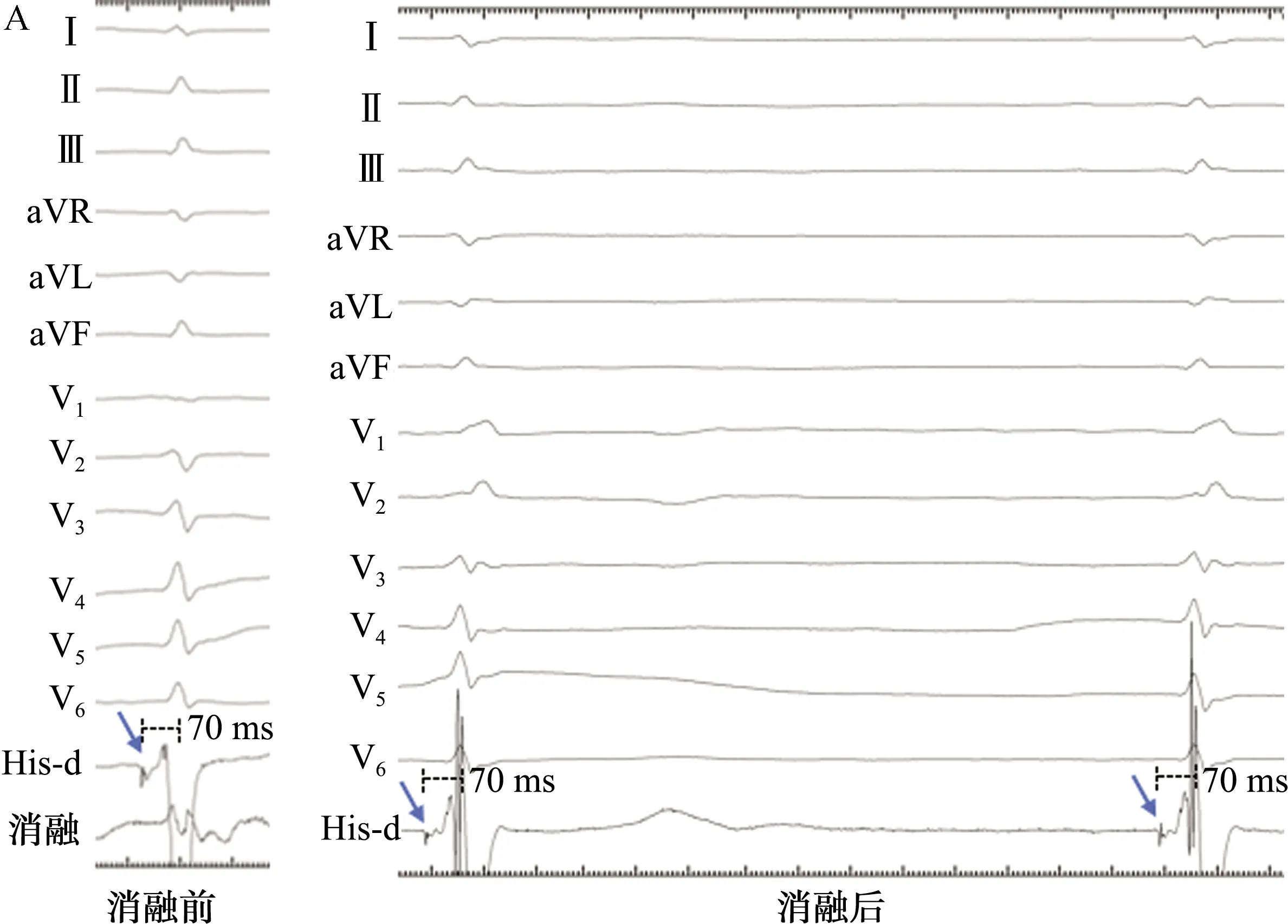
His-d: 希氏束远端电极; AVN:房室结; HB: 希氏束;RBB:右束支;LAF: 左前分支;LPF:左后分支。
3 左束支近端
左束支起源于冠状动脉窦部之间的希氏束分叉部。它的主干及分支的近端穿室间隔肌部,在室间隔膜部顶端以下约15 mm处开始出现在心内膜下,呈带状结构,并在心内膜下向下和稍向前延伸,经过很短的距离后发出一个细长的前束和一个较宽的后束,分别指向前乳头肌和后乳头肌[11]。
左束支最大的解剖特点是变异性大。既往研究认为左束支在起始段狭窄逐渐变宽[11],在Mas-sing等[7]的研究中,左束支近端直径粗细不一,从小于1 mm到14 mm不等,长度在26~45 mm。左束支起始段大都是狭窄的,即使在一些“左侧希氏束”的心脏中,左束支起始部分的宽度也只有2~3 mm。心内膜下心肌和胶原纤维覆盖部分近端左束支,当左束支沿着室间隔从基底部向心尖部走行时,左束支及其分支开始逐渐变宽,覆盖左束支的心肌和胶原纤维逐渐减少,即随着左束支沿室间隔越向远端延伸,左束支在心内膜的位置就越表浅。
左束支分支的数量、位置、大小及走行个体差异较大,并且不可预测,通常可见二分叉型、三分叉型及网状分布型,以网状分布型最多见。有的左束支有几个左前分支,每个分支分别起源于左束支主干;而有的只有一个左前分支,再由这个左前分支分出其他亚分支;一些左束支,其主干发出后可长达20 mm或更长而没有继续分支。各分支远端由纤维连接在整个左心室腔内,形成复杂的心内膜下浦肯野纤维网。这较好地解释了为什么左束支的一个分支发生阻滞时不会影响整个QRS波群的宽度[6]。
4 解剖与传导阻滞的关系
房室结毗邻二尖瓣前瓣、三尖瓣隔瓣、冠状窦等结构,希氏束与左束支近端毗邻室间隔膜部、中央纤维体、二尖瓣环、三尖瓣隔瓣,容易受到这些部位病变(如瓣膜的钙化等)的影响而发生传导阻滞[12]。研究发现主动脉瓣狭窄患者的传导阻滞发生率为26%~90%,与主动脉瓣是否钙化及钙化的程度密切相关[13-14]。Dhingra等[15]也发现了类似的结果,在主动脉瓣狭窄患者中出现房室传导阻滞和室内传导阻滞的患者都伴随不同程度的主动脉瓣钙化。
对于起始部分比较窄的左束支,其邻近结构的一些微小病变就可以引起左束支的完全性传导阻滞。对于呈网状分布的左束支,在微小损伤时则可以通过广泛的纤维连接进行电活动的传递,因而相对不容易发生完全性传导阻滞[16]。左束支从希氏束发出位置的变异也与传导阻滞相关[12]——发出分支的位置越早,其近端就越易受到瓣环等毗邻结构病变的影响而发生完全性左束支传导阻滞。Massing等[7]观察到在右侧希氏束的人群中,其左束支的起源往往比较窄,加之左束支由右向左穿过室间隔,走行距离比较长,因此容易发生左束支传导阻滞。
5 希浦传导系统起搏的电生理标测意义
5.1 指导起搏电极的精确定位
在希浦传导系统起搏术中,清晰了解希氏束的解剖位置可帮助术者快速缩小定位范围,只有将传导束电位标测和起搏标测结合起来,才能实现精确定位。标测记录到希氏束或左、右束支电位,往往意味着起搏电极接近传导束所在区域,起搏状态下结合体表心电图和腔内图QRS形态的改变来判断是否成功夺获相应传导束,并通过测试阈值等参数判断电极位置是否满意。偏房侧的希氏束电极通常定位于三尖瓣瓣环的房侧,电极头端未跨越瓣环。房侧希氏束起搏容易出现感知异常(包括交叉和远场感知)、夺获心室内膜的阈值偏高等缺陷。理论上偏室侧的希氏束起搏更有解剖优势,可以获得更理想的起搏参数,包括良好的心室感知和备份心室起搏阈值。
5.2 记录左束支电位
并不是所有患者都能够记录到传导束电位,如在完全性左束支传导阻滞患者中,左束支区域通常不能标测到左束支电位,可通过希氏束起搏恢复左束支传导、出现窄QRS或右束支传导阻滞形态的逸搏时记录到左束支电位(图3)。
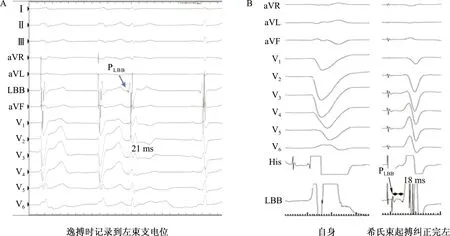
A:左束支传导阻滞时,常规方法不能记录到提前于V波的左束支电位,逸搏时可以记录到左束支电位;B:在完全性左束支传导阻滞时,通过希氏束起搏可以纠正完全性左束支传导阻滞,此时腔内图上记录到位于V波前的左束支电位,PV间期为18 ms;PLBB:左束支电位。
5.3 明确传导阻滞的发生部位
希氏束电位标测可以明确传导束阻滞位置,指导起搏电极跨越传导阻滞位点放置以保证远期安全性(图3)。对于存在房室传导阻滞的患者,希氏束电极腔内图可记录希氏束电位、远场心房波(A波)和心室波(V波);AH间期延长或A波后希氏束电位脱落提示阻滞部位在房室结;而HV间期延长或希氏束到心室的传导脱落提示阻滞部位在房室结以下,部分病例可见希氏束电位分裂成两个部分,提示阻滞发生在希氏束内。见图4。
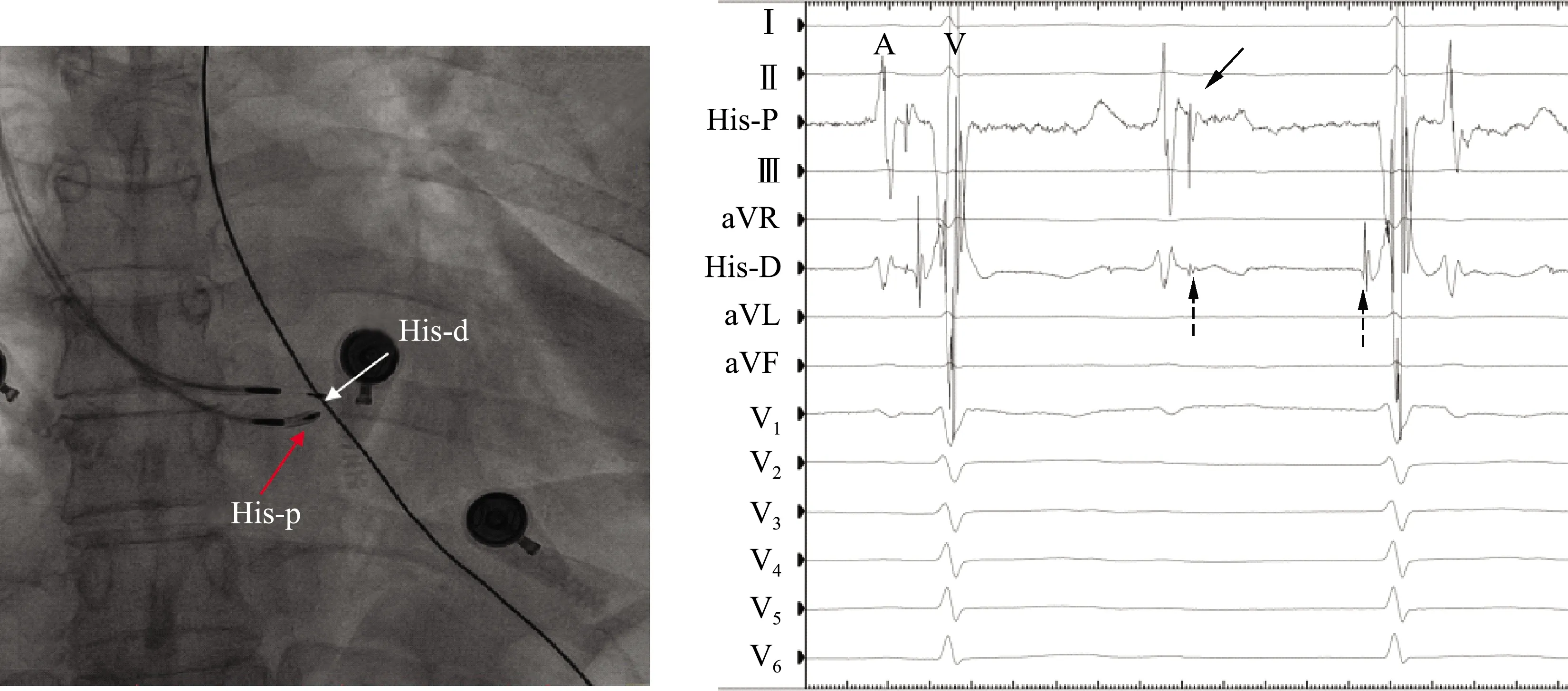
A:两根3830导线电极分别放置在希氏束近端和远端,图中标记为His-p和His-d;B:希氏束电极的腔内图可见远场的心房波(A波)和心室波(V波);在His-d上记录到希氏束电位分裂,证实阻滞部位在希氏束内,HV间期正常并以1 ∶1传导,证实远端电极跨越了传导阻滞部位。(实箭头指示希氏束电位,虚箭头指示希氏束电位分裂为近、远端两个电位)
6 传导束解剖在希浦传导系统起搏中的价值
6.1 选择性和非选择性希氏束起搏
有学者研究了选择性希氏束起搏(selective His-bundle pacing, S-HBP)和非选择性希氏束起搏(nonselective HBP,NS-HBP)与希氏束解剖结构的关系[8,17-18]。Ⅲ型“裸”希氏束直接走行于心内膜下,位置表浅,容易实现S-HBP。Ⅱ型希氏束穿行于室间隔的肌部,周围有较多的胶原纤维覆盖,形态、边界与周围心肌难以区分,起搏夺获希氏束的同时可能激动邻近的心肌而实现NS-HBP。此外,能否实现S-HBP也与电极位置有关。房侧希氏束起搏可能需要较高的阈值才能实现夺获,并且容易发生交叉和远场感知。
6.2 右束支损伤
右束支由希氏束发出,呈直径1~2 mm的细长结构,在右室间隔面心内膜下向心尖部走行,直至到达右心室前外侧乳头肌。在Massing等[7]研究的32个心脏中,右束支在室间隔中始终是一个狭窄无分支的结构。由于右束支具有这种解剖特点,因此在左束支起搏过程中,右束支近端容易受损[19]。
6.3 室间隔穿孔
室间隔穿孔是左束支起搏较常见的术中并发症,由于导线是通过穿间隔途径放置在室间隔左室面,且左束支走行于室间隔左室面心内膜下较浅的位置,因此如何避免术中及术后室间隔穿孔、减少电极重置是术者需要关注的问题。既往的研究发现,随着左束支发出后沿着室间隔越向心尖部走行,其在室间隔左室面心内膜下的位置就越浅表[7,16,20]。在左束支起搏过程中,如果起搏位点在左束支远端,为实现传导束夺获,需将起搏电极更靠近内膜下,那么发生室间隔穿孔的概率就可能升高,因此从安全性角度建议选择左束支近端起搏。
6.4 室间隔动脉的损伤
左束支起搏术中冠脉损伤目前仅有极少数个案报道,但仍是需要关注的问题。室间隔穿支动脉是供应室间隔深部的动脉[21],起搏电极在穿室间隔的过程中,理论上有损伤室间隔穿支血管的风险。室间隔除主要由室间前动脉供血外,室间隔下动脉、斜动脉、旋动脉,甚至左冠状动脉主干均可发出间隔穿支到室间隔深部,术中难以避免因电极损伤微小动脉分支导致的间隔血肿,建议在术中减少间隔拧入次数并密切观察术中胸痛症状。
一些特殊基础疾病,如肥厚型心肌病、外科手术医源性损伤、室缺等先天性心脏病关系到希氏束及左束支起搏能否成功,术前须充分评估。
7 总结
希浦传导系统解剖存在个体差异性,不同患者传导系统基础病变和起搏的适应证各不相同。在生理性起搏的过程中,通过深入掌握解剖结构、灵活运用电生理标测指导植入,可以提高手术的成功率并减少并发症的发生。
