致心律失常性右室心肌病新观点
2021-02-04杨丰菁刘文玲
杨丰菁 刘文玲
致心律失常性右室心肌病(arrhythmogenic right ventricular cardiomyopathy,ARVC)是35岁以下人群发生室性心律失常和心脏性猝死(sudden cardiac death,SCD)的主要原因。自1982年Fontaine等[1]首次详细报道以来,研究者们对该病的认识逐渐深入。制定ARVC诊断标准的国际专家组(International Task Force,ITF)1994年制定了首个ARVC诊断标准[2],但由于其敏感性较低,因此2010年进行了修订[3],2015年发表了治疗共识[4];2019年美国心律学会(HRS)出台了ARVC评估、危险分层及处理的专家共识[5];2020年ITF发表了对目前ARVC诊断标准及鉴别诊断的评估意见[6]。本文将对近年来ARVC的临床研究进展作一概述。
1 概念的变迁
ARVC是一种主要累及右室的遗传性心肌病,以心肌细胞被纤维脂肪组织进行性替代为病理特征,易引发室性心律失常和SCD。近年来发现ARVC可以累及一侧或两侧心室,有报道显示39%的患者主要累及右室,5%累及左室,56%累及双室[7]。故2019HRS专家共识(HRS Expert Consensus Statement)将ARVC称为致心律失常性心肌病(arrhythmogenic cardiomyopathy,ACM)[5],并将ACM的范畴扩展为除继发于心肌缺血、高血压、瓣膜病导致的心律失常以外的其他所有致心律失常性心肌病,包含了遗传性、系统性、感染性和炎症性疾病,如致心律失常性右(左)室心肌病、心脏淀粉样变和结节病、Chagas病和左室致密化不全等。而ITF为了避免混乱,仍然维持ARVC的名称和范畴,并未把其他遗传性、系统性、感染性和炎症性疾病纳入ARVC的范畴[6]。
ARVC的特征性改变为右心室腔扩张及心肌纤维丧失、脂肪浸润和纤维素替代,既往认为其好发于肺动脉漏斗部、右室心尖和下壁,被称为“右室发育不良三角”;目前进展为“ARVC四合院”的观点,其中还包含了左室下侧壁,这是最常累及的左室区域。在ARVC的早期,三尖瓣下(周区)和左室下外侧壁是可能受累的区域[6]。
2 致病基因研究进展
目前发现ARVC相关基因15个,包括5个桥粒蛋白基因和10个非桥粒蛋白基因(表1)[6]。这些基因目前对临床诊断与治疗无特殊价值,在此不再赘述。
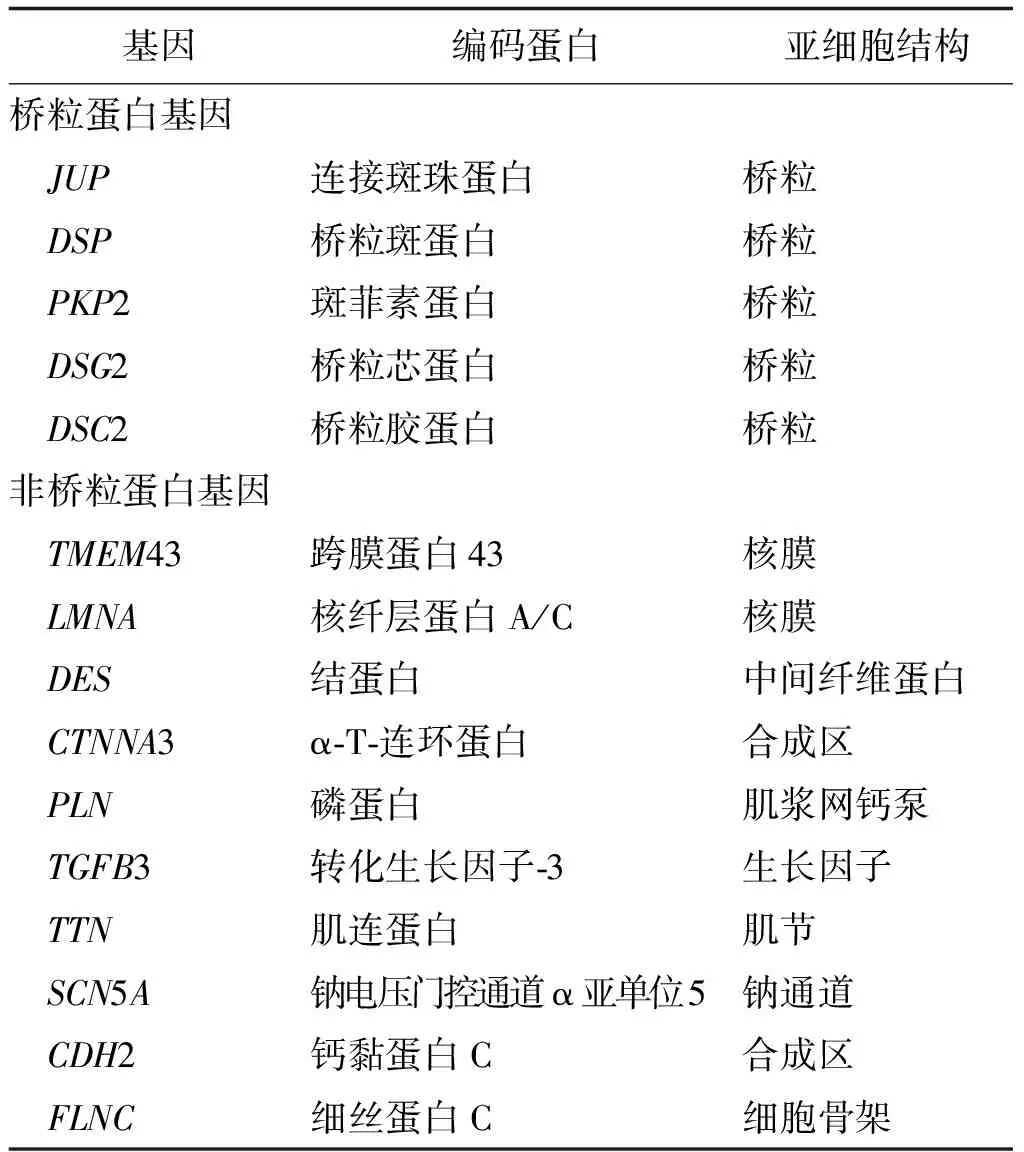
表1 致心律失常性右室心肌病相关基因
3 临床分型
ARVC患者临床表现包括心悸、晕厥甚至猝死,多在运动或精神紧张时出现。ARVC常发生于青少年和年轻成人,是运动性猝死的常见原因之一。
2010年修订版专家组诊断标准(revised Task Force Criteria,rTFC)是针对典型ARVC提出的。随着对疾病认识的深入,目前ITF提出了疾病的临床分型[6]:① 典型ARVC,即仅累及右室;② 双室受累型,包括均衡型、右室优势型和左室优势型,即分别对应于左右心室均衡受累、右室显著受累和左室显著受累;③ 左室型,仅累及左室,临床证实无右室受累。
4 诊断进展
4.1 2010年修订版专家组诊断标准的再评估
既往对ARVC的诊断主要依据2010年rTFC[3]。怀疑ARVC的患者应行12导联心电图、信号平均心电图、二维超声心动图和(或)心脏磁共振(cardiac magnetic resonance,CMR)以及动态心电图监测进行评估。运动试验可揭示室性心律失常,也在推荐之列。对ARVC先证病例的所有一级和二级亲属均应进行同样的无创性评估。
目前发现2010 ITF诊断积分有可能造成误诊:一方面,由于将基因变异作为诊断条件,错误解释心电图和影像,以及将其他类似的疾病误诊为ARVC而造成过度诊断;另一方面,由于缺乏CMR的特征性表现而漏诊。2019 ITF提出了一些新的诊断意见,将CMR作为评估心室容量、收缩功能、室壁运动和心肌组织成分的标准方法,并提出了左室优势型ARVC的诊断标准[6]。
4.1.1 分子遗传学 由于目前对ARVC遗传基础的了解不深,加之在正常人群和其他心肌病患者中高频率的疾病相关基因变异而产生的高遗传干扰,可能导致误诊,因此,根据遗传性心肌病分子遗传学检测的建议,基因分型一般被用于已经满足ARVC临床诊断标准的先证者中确定致病性或可能致病性突变,并且利用特异突变检测筛选家族成员的基因携带者,以识别处于临床前阶段的患者。根据分子遗传学专家的分析,对临床临界表现的患者进行基因检测,如果疾病分子遗传学结果支持诊断,将有助于明确临床诊断。家族基因筛查也可用于心律失常危险分层。考虑到基因剂量效应,桥粒蛋白基因变异的复合或双基因杂合突变预示着可能发生严重的心律失常。
4.1.2 心肌组织检查 心肌内膜活检不作为ARVC的常规检查,仅用于某些散发性ARVC和主要左室受累的先证者;在这些患者中,最终的诊断取决于组织学排除某些疾病,如慢性心肌炎、结节病或其他心肌疾病。除心肌组织病理学检查外,免疫组化分析可用于评估桥粒蛋白在闰盘内的定位,对诊断亦有价值。右室心内膜电压标测(epicardial voltage mapping,EVM)建议仅用于特殊ARVC患者的诊断和准备进行消融治疗的心律失常患者。
4.1.3 整体或局部功能障碍和结构改变 由于当时在CMR对ARVC的诊断价值方面经验有限、特异性低,CMR的组织学特征(纤维化、脂肪浸润和纤维脂肪瘢痕)未纳入2010年ITF的诊断标准。然而,最近的研究表明,CMR结合局部室壁运动评估和组织特征可用于ARVC的诊断;当发现室壁运动改变和造影前后信号异常(包括左室脂肪浸润和延迟钆增强)时,可诊断ARVC,其准确率最高可达98%。因此目前主张采用增强CMR对该病进行确诊和更好地了解临床特征。
4.1.4 心律失常 ARVC心律失常谱很广,从孤立性室性早搏(premature ventricular complexes,PVCs)到持续性室速、室颤。心律失常的严重程度在不同患者和疾病的不同阶段差异很大,心律失常发作时的12导联QRS波群形态有助于判断心律失常的起源和机制。按照2010 ITF诊断标准,室速的形态关系到诊断:左束支传导阻滞型室速或电轴向下提示右(左)室流出道起源,为诊断ARVC的一个“次要条件”,但其特异性较低,有可能将特发性右室流出道室速误诊为ARVC。目前认为,左束支传导阻滞型室速和电轴向上或不定提示右室游离壁起源的室速诊断ARVC的特异性更高,归类为诊断的“主要条件”。右束支传导阻滞型室速可能是左室受累或左室优势型的表现。24 h 动态心电图监测研究显示,多数ARVC患者有频发室早,无论是孤立性还是成对早搏>500次PVC/24 h,按照目前ITF标准均符合诊断条件,而不强调异位QRS波群形态。然而,这是有局限性的,因为起源于右室下壁的室早比>500 次PVC/24 h的数量及起源于右室流出道的室早特异性更高。通过运动试验诱发的在12导联心电图上记录的PVCs比24 h动态心电图监测更具有诊断意义。
4.1.5 复极和除极心电图异常 ARVC的心电图改变包括V1—V3导联T波倒置、右胸导联QRS波延长、右胸导联S波升支≥55 ms及Epsilon波。(1)V1—V3导联T波倒置。目前认为右胸导联T波倒置是最常见的ARVC心电图改变。有研究表明,T波倒置程度同电解剖标测异常区域成正比。心电图存在明显电压异常时,可无复极异常[8]。(2)去极异常,如QRS波增宽、时限延长,宽大的S波,完全或不完全性右束支传导阻滞(同心脏瘢痕相关)[9]。伴有右胸导联终末激动时限(TAD)≥55 ms,特别是T波倒置是ARVC的特异性心电图改变。V1和V2导联ST段下斜型抬高同右室透壁疾病进展相关[8]。(3)肢体导联低电压提示左室受累。(4)Epsilon波。rTFC将Epsilon波作为ARVC的主要诊断条件,目前认为由于受到心电图机滤过和采样率的影响而变异比较大。因此,研究认为Epsilon波作为诊断条件要慎重[6]。
4.2 左室优势型的致心律失常性心肌病的诊断标准
(1)心电图改变:肢体导联QRS波低电压(<0.5 mV),下侧壁导联T波倒置。
(2)右束支传导阻滞型心动过速。
(3)结构与功能学特征符合左室低动力、无扩张和纤维化。
5 鉴别诊断
目前认为ARVC除了应该与特发性右室心律失常、Brugada 综合征鉴别以外,还应与下述两类疾病相鉴别:① 结节病累及心脏,导致炎症、肉芽肿样改变浸润右室,心内膜心肌活检有重要的鉴别诊断意义,但为有创性检查。心脏结节病早期多表现为传导阻滞等心律失常,并有纵隔肺门淋巴结肿大等心脏外结节病受累表现,可与ARVC鉴别。② 扩张型心肌病,部分ARVC发展至左室或双心室受累时可出现V4—V6导联T波倒置、右束支传导阻滞型室速及左室射血分数下降等表现,此时应与扩张型心肌病鉴别。
其他须与ARVC进行鉴别的疾病包括先天性心脏病,因容量负荷增大而导致的右室整体扩张与功能障碍,如房间隔缺损、肺动脉高压、Uhl’s畸形(亦称羊皮纸样右心)及运动员心脏等。
6 治疗进展
6.1 治疗目标
目前临床上治疗ARVC患者最重要的目标包括:① 降低死亡率,包括心律失常性SCD或心力衰竭(心衰)导致的死亡;② 遏制右(左)室或双室功能障碍和心衰的进展;③ 通过减少(消除)心悸、室性心动过速再发、ICD放电(适当的或不适当的)改善症状,提高生活质量;④ 改善心衰症状,增加心功能储备。治疗方法包括改变不健康的生活方式、药物治疗、导管消融、ICD和心脏移植[4]。
6.2 危险分层及ICD应用
目前认为,ARVC患者猝死的原因主要为室速、室颤。近期一项纳入45项研究的Meta分析表明,ARVC的确诊患者中每年有10.6%出现心律失常事件;在疑似ARVC的患者中为3.7%/年;在ARVC突变基因携带者中为3.7%/年[10]。ARVC的风险预测因子包括持续性室速、非持续性室速、不明原因晕厥以及严重右(左)心功能不全[4,11]。确诊ARVC的患者中,预测因子包括男性、年龄、V3导联T波倒置、右心功能不全、有非持续性室速、室颤发作史。临界ARVC患者中,其他预测因子包括电生理检查结果阳性和从事体力劳动或运动时发生心律失常。在携带突变基因的患者,ARVC的预测因子为多个致病基因、左室功能不全、晕厥前兆[10]。
SCD是ARVC最严重的后果,年轻ARVC患者猝死率高达20%,特别是有遗传背景者。对SCD高危人群而言,植入ICD是最有效的预防措施。但是,目前可用于ARVC危险分层研究的数据有限,基本上都是回顾性的三级转诊中心的资料,近来较大规模的注册研究资料的病例大多也是来自同一中心过去已经发表的数据。来自欧洲和北美的18个中心合作开发了一个风险模型,入选了528例诊断为 ARVC但无室性心律失常或心脏骤停的患者,平均随访4.83年,发现男性、年轻、近6个月发生过晕厥、之前发生过非持续性室速、前下壁导联T波倒置、右(左)室射血分数降低为室性心律失常的预测因子。ARVC患者5年无心律失常事件生存率73.6%[12]。
目前指南推荐的ICD植入指征[4-5]如下:① 有血流动力学不稳定、持续性室速或室颤的ARVC患者应植入ICD(Ⅰ级推荐);② 无论有无心律失常,有右室、左室或双室严重收缩功能障碍的ARVC患者应植入ICD(Ⅰ级推荐);③ 血流动力学稳定、有持续性室速的ARVC患者,可考虑植入ICD(Ⅱa级推荐);④ 有主要危险因素,如不明原因的晕厥、中度心室功能障碍或非持续性室速的ARVC患者,可考虑植入ICD(Ⅱa级推荐);⑤ 经过充分与患者沟通,告知ICD植入长期风险和获益后,有次要危险因素的ARVC患者可考虑植入ICD(Ⅱb级推荐)。
6.3 导管消融术
若经最大剂量药物(包括胺碘酮)治疗后仍有持续性或频发单形性室速,行导管消融术可减少室速发作及ICD放电。
经恰当ICD干预的ARVC患者,一次或多次心内膜室速消融失败者建议行心外膜室速消融术。
目前研究表明,由有经验的医生开展心内膜和心外膜联合消融,进行广泛心内膜、心外膜基质修饰,可消除患者可诱导的室性心律失常。上述手术操作安全而有效,长期随访中,在未应用抗心律失常药物(如胺碘酮等)的情况下,大多数接受联合射频消融术的患者未再发生室性心律失常[13-16]。
持续性室速或频繁恰当ICD干预的室速,药物治疗有效但不愿接受药物治疗的ARVC患者,也可以考虑行室速导管消融术。药物难治性、血流动力学稳定、单形性室速且未植入ICD的患者,导管消融术可作为首选治疗方法。在消融前完善影像学检查如CT或磁共振,可以帮助辨别基质(通过对比剂延迟增强CMR,尤其是左室优势型的致心律失常性心肌病)、观察纤维脂肪浸润(对比剂增强CT)、观察冠状动脉以在射频消融过程中避开冠状动脉[17]。
6.4 心力衰竭和抗血栓药物治疗
右心衰和(或)左心衰的ARVC患者应采用血管紧张素转化酶抑制剂、血管紧张素Ⅱ受体阻滞剂、β受体阻滞剂和利尿剂进行规范化药物治疗。无症状的右室和(或)左室功能障碍的ARVC患者,可考虑应用血管紧张素转化酶抑制剂或血管紧张素Ⅱ受体阻滞剂治疗。有腔内血栓或静脉(动脉)血栓史的患者,长期口服抗凝药二级预防。
7 总结
ARVC或ACM是一种以心律失常和猝死为突出表现的、进展性的遗传性心肌病,主要依据临床表现、心电图、心脏影像学改变及基因检测进行诊断。尽管治疗方法已发展多年,但仍然面临着严峻挑战。为了进一步改善危险分层和治疗方法,需要了解更多关于自然史、长期预后和风险评估的信息。目前的治疗和预防措施只是姑息疗法,而不是根治性的。ARVC最终的确切治疗方法尚有待于对病因、发病机制和分子机制新的发现和认识。
