非诺贝特联合热量限制饮食治疗非酒精性脂肪性肝病合并2型糖尿病患者疗效研究*
2021-02-04梁小丽邝继孙刘秋莉
梁小丽,邝继孙,刘秋莉,符 弟
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)为除酒精或肝炎病毒感染等因素以外的病因所致的肝细胞内脂肪过度堆积。研究[1]显示,2型糖尿病(type 2 diabetes mellitus,T2DM)是其主要的合并症之一。饮食控制为NAFLD合并T2DM患者的基础干预方案,热量限制饮食可通过提供低碳水化合物饮食和高纤维食物降低热量摄入。既往研究[2]显示,热量限制饮食可改善NAFLD患者体内代谢紊乱,但仍无法彻底纠正患者肝脏脂肪沉积和肝损伤。非诺贝特为调节血脂类药物,其作用机制为抑制胆固醇的吸收或在体内的合成,在多种代谢紊乱性疾病中应用效果良好[3,4]。本研究应用非诺贝特联合热量限制饮食治疗NAFLD合并T2DM患者,观察了短期疗效及血清人类软骨糖蛋白-39(human cartilage glycoprotein-39, HCgp39)、脂联素(adiponectin,APN)和非对称二甲基精氨酸(asymmetric dimethylarginine,ADMA)水平的变化,现报道如下。
1 资料与方法
1.1 一般资料 2018年2月~2020年1月我院内分泌科收治的NAFLD合并T2DM患者128例,男68例,女60例;年龄30~77岁,平均年龄为(49.6±6.2)岁。符合《中国2型糖尿病防治指南(2017年版)》[5]的诊断标准,空腹血糖≥7.0 mmol/L和(或)糖耐量试验餐后 2 h 血糖≥11.1 mmol/L;符合《非酒精性脂肪性肝病诊疗指南(2018年更新版)》[6]的诊断标准,经肝脏超声检查确定肝脏存在弥漫性脂肪变,既往酒精摄入量女性<70 g/周,男性<140 g/周。其中中度脂肪肝71例,重度脂肪肝57例;体质指数(body mass index,BMI)为25.1~33.4 kg/m2,平均为(27.3±1.2)kg/m2;腰围为76.7~118.6 cm,平均为(98.1±4.8)cm。排除标准:1型糖尿病、妊娠期糖尿病以及其他特殊类型的糖尿病者;合并严重的高血压、冠心病、脑血管疾病者;合伴有严重的感染、贫血、营养不良、急慢性消化系统疾病者;既往存在肝脏手术史者;滥用药物或毒品史者;合并病毒性肝病、自身免疫性肝病、药物性肝损伤、肝性脑病、胆囊炎、胆瘘等其他肝胆疾病者;不耐受非贝诺特治疗或对热量限制饮食治疗的依从性差者。采用随机数字表法将患者分成两组,每组64例,两组性别、年龄、BMI和病情等一般资料比较无统计学差异(P>0.05),具有可比性。本研究方案已经获得我院医学伦理委员会审核批准,患者签署知情同意书。
1.2 治疗方法 对照组采用热量限制饮食治疗,给予每日热量摄入为1200~1500 kcal,同时在研究期间限制动物脂肪和含较高饱和脂肪酸的脂肪摄入,多进食蔬菜类、水果类和豆制品;观察组在对照组治疗的基础上给予非诺贝特片(金陵药业股份有限公司南京金陵制药厂,国药准字H32024400)0.1口服,1次/d。两组均持续治疗观察12 w。

2 结果
2.1 两组肝功能指标水平比较 在治疗结束时,观察组肝功能指标水平均显著低于对照组,差异具有统计学意义(P<0.05,表1)。
2.2 两组治疗前后血糖指标及IR水平比较 治疗结束时,观察组的血糖指标及IR均显著低于对照组,差异具有统计学意义(P<0.05,表2)。
2.3 两组血脂指标水平比较 在治疗结束时,观察组血清TC、TG和LDL-C水平均显著低于对照组,而HDL-C水平显著高于对照组,差异均具有统计学意义(P<0.05,表3)。
2.4 两组血清疾病相关因子水平比较 在治疗结束时,观察组血清HCGP39和ADMA水平均显著低于,而血清APN水平显著高于对照组,差异均具有统计学意义(P<0.05,表4)。

表1 两组肝功能指标水平比较
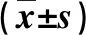
表2 两组血糖指标和胰岛素抵抗水平比较
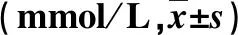
表3 两组血脂指标比较
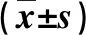
表4 两组血清疾病相关因子比较
3 讨论
近年来,随着经济生活水平的提高,人们的营养结构和生活方式发生了很大的变化,高热量饮食多,而运动量减少,容易导致机体产生代谢综合征。流行病学研究[7-9]亦显示,NAFLD和T2DM等代谢紊乱性疾病发病率呈上升趋势。IR、血糖和血脂水平升高等为NAFLD和T2DM共同的发病机制,NAFLD合并T2DM患者血糖、血脂水平和肝功能损伤的控制较为困难[10]。热量限制饮食可直接控制机体热量摄入,控制血糖水平,并避免肝脏合成过量脂肪,从而改善NAFLD合并T2DM的病情。非诺贝特为贝特类调脂药,可进一步促进脂质在肝脏的代谢,对NAFLD合并T2DM患者具有良好的治疗效果。
NAFLD合并T2DM患者血糖水平高,且存在IR,可导致肝脏合成TG增多并以脂肪微粒的形式储存在肝细胞质中,而HDL-C可帮助TG在肝脏的运输过程,并抑制LDL氧化过程,减轻氧化LDL所致的血管内皮损伤[11]。热量限制饮食可减少IR肥胖大鼠体内游离脂肪酸水平,启动体内脂肪细胞内基因转录和分化调控,抑制前脂肪细胞增殖,进而减少脂肪促炎因子的分泌[12]。非诺贝特则可通过上调胰腺胰岛素合成转录因子基因表达,促进胰岛素的生物合成,降低机体IR,改善糖脂代谢[13]。非诺贝特的调脂作用还表现在抑制脂质的合成,促进脂质代谢,增加载脂蛋白A1和A11的分泌。非诺贝特为过氧化物酶体增殖物激活受体-α(peroxisome proliferators-activated receptors-α,PPAR-α)的配体,而PPAR-α信号通路可介导脂肪细胞增殖分化、脂肪代谢,并促进脂肪重新分布,使脂肪组织由肝脏转移至皮下[14]。本研究在治疗结束时,观察组血糖和血脂指标及IR均显著低于对照组,而HDL-C水平显著高于对照组,提示非诺贝特联合热量限制饮食可改善NAFLD合并T2DM患者的血脂代谢。
APN为脂肪细胞分泌的胰岛素增敏激素。NAFLD合并T2DM患者APN分泌降低可抑制机体对胰岛素的敏感度,影响脂肪酸的氧化和对血糖的利用,进而增加肝脏脂质沉积,而脂毒可导致肝脏氧化应激和免疫损伤[15]。HCGP39为肝脏持续性炎症和肝纤维化生物标志物,ADMA为血管内皮损伤因子,在NAFLD合并T2DM患者肝损伤过程中发挥重要作用[16,17]。非诺贝特一方面可通过人类的线粒体氧化途径影响脂肪酸的摄入、转化和分解代谢,直接抑制肝脏病理性脂肪变性,控制肝纤维化进程;另一方面,它还可抑制炎性细胞因子、趋化因子和促纤维化基因的表达,减少肝星状细胞的活化。本研究提示非诺贝特联合热量限制饮食可减轻NAFLD合并T2DM患者肝脏损伤。
