西黄丸治疗非小细胞肺癌作用机制的网络药理学探究和分子对接验证
2021-01-13王玥慧王芬李钰鑫周杰李志明刘传波
王玥慧 王芬 李钰鑫 周杰 李志明 刘传波


摘要 目的:采用网络药理学和分子对接的方法探究西黄丸防治非小细胞肺癌(NSCLC)潜在分子机制。方法:在中药系统药理学数据库与分析平台(TCMSP)及BATMAN-TCM数据库中筛选分析西黄丸的有效活性成分及作用靶点。在GeneCards数据库与人类孟德尔遗传数据库(OMIM)中检索获取NSCLC的相关靶点,选取与西黄丸的交集靶点作为研究靶点。利用STRING数据库构建蛋白质-蛋白质相互作用(PPI)网络图。采用Cytoscape 3.7.0软件构建药物-靶点-疾病可视化互作网络图。使用DAVID数据对筛选分析出的关键靶点,进行基因本体(GO)功能富集分析和京都基因和基因组百科全书(KEGG)通路富集分析,最后运用AutoDock Vina软件和Pymol软件对药物有效活性成分和关键靶点进行分子对接验证。结果:通过筛选得到西黄丸51个主要活性成分,包括槲皮素、β-谷甾醇等,其中作用于NSCLC的靶点有178个,关键靶点有MAPK1、JUN、AKT1、TP53、RELA等。GO和KEGG分析结果显示,西黄丸治疗NSCLC的机制涉及多个生物学过程及PI3K-AKT信号通路、MAPK信号通路、TNF信号通路等多种信号通路。药物有效活性成分与关键靶点对接活性良好。结论:网络药理学分析显示西黄丸治疗NSCLC是多成分、多靶点、多通路协同起效,为后续相关实验提供了充分的理论依据。
关键词 西黄丸;非小细胞肺癌;网络药理学;分子对接;机制研究
Abstract To explore the potential molecular mechanism of Xihuang Pills in preventing and treating non-small cell lung cancer(NSCLC) by means of network pharmacology and molecular docking.Methods:The effective active components and targets of Xihuang Pills were screened and analyzed in TCM MSP and BATMAN-TCM database.We searched the related targets of NSCLC in GeneCards database and OMIM database,and selected the intersection target with Xihuang Pills as the research target.Protein-protein interaction network diagram was constructed by using STRING database.The network diagram of drug-target-disease visual interaction was constructed by using Cytoscape 3.7.0 software.GO function enrichment analysis and KEGG pathway enrichment analysis were carried out on the selected key targets by using DAVID data.Finally,the effective active ingredients and key targets of drugs were verified by molecular docking with AutoDock Vina software and Pymol software.Results:A total of 51 main active components of Xihuang Pills were screened,including quercetin,β-sitosterol,etc.Among them,there were 178 targets acting on NSCLC,and the key targets were MAPK1,JUN,AKT1,TP53,RELA,etc.GO and KEGG analysis showed that the mechanism of Xihuang Pills in treating NSCLC involved many biological processes and PI3K-Akt signal pathway,MAPK signal pathway,TNF signal pathway and other signal transduction pathways.The active ingredients of medicine had good docking activity with key targets.Conclusion:Network pharmacological analysis shows that Xihuang Pills is a multi-component,multi-target,multi-channel synergistic effect in the treatment of NSCLC,which provides sufficient theoretical basis for subsequent related experiments.
Keywords Xihuang Pills; NSCLC;Network pharmacology; Molecular docking; Mechanism research
中圖分类号:R285文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.24.001
肺癌是最常见的癌症,组织学类型中80%为非小细胞肺癌(Non-small Cell Lung Carcinoma,NSCLC)[1],大部分患者就诊时已经处于中晚期,错过最佳治疗时期,预后极差。很多现代研究证明中医药能够有效减轻癌症患者的临床症状,提高生命质量,减少治疗带来的不良反应,更好地帮助NSCLC患者实现“带瘤生存”[2]。
西黄丸由清代名医王洪绪所创,首载于《外科证治全生集》,由牛黄、麝香、乳香、没药组成,具有清热解毒、活血祛瘀、化痰消坚、解毒散痈等功效。现在西黄丸常应用于肺癌、乳腺癌、胃癌、肠癌等多种恶性肿瘤的辅助治疗。现代药理学研究显示,西黄丸具有抑制肿瘤细胞增殖转移、促进癌细胞凋亡、抑制血管生成、调节免疫微环境等作用[3-6]。其中,牛黄能够有效抑制肿瘤细胞转移、诱导其凋亡[7-8]。麝香可以诱导肿瘤细胞凋亡,逆转化疗药物的多药耐药[9-10]。乳香、没药能够通过抑制细胞增殖来发挥强大的抗肿瘤作用等[11]。但西黄丸具体抗NSCLC的机制尚不明确。
本研究运用网络药理学的研究方法,推测西黄丸防治NSCLC的有效活性成分、作用靶点及参与调控的细胞信号转导等,阐释西黄丸抗NSCLC的作用机制,为后续相关研究提供更充分的科学依据。
1 资料与方法
1.1 西黄丸活性成分的搜索与筛选 利用中药系统药理学数据库与分析平台(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)和中药分子机制的生物信息学分析工具(BATMAN-TCM,http://bionet.ncpsb.org/batman-tcm/)分别检索西黄丸中各药味的化学成分。在TCMSP数据库中,以口服生物利用度(Oral Bioavailability,OB)≥30%,类药性(Drug Likeness,DL)≥0.18为筛选条件,获得主要有效活性成分化合物。
1.2 西黄丸活性成分-靶点网络的构建 在UniProt数据库(https://www.uniprot.org/)将所有蛋白质名称转换成基因名称。通过Cytoscape 3.7.0软件(https://cytoscape.org/)构建活性成分-靶点网络。
1.3 NSCLC疾病靶点的筛选 以“Non-Small Cell Lung Cancer”为关键词在GeneCards(人类基因数据库,https://www.genecards.org/)和OMIM数据库(Online Mendelian Inheritance in Man,https://www.ncbi.nlm.nih.gov/omim)中搜索非小细胞肺癌的相关基因,剔除重复基因。
1.4 西黄丸-NSCLC共同靶点筛选及蛋白互作网络的构建 将西黄丸-NSCLC共同靶点导入STRING 11.0(https://string-db.org/)数据库,物种选择“Homo Sapiens”,最低相互作用域值设为0.9(Highest Confidence),其他参数保持默认数值,获得靶点联系网络图,将该图进一步导入Cytoscape 3.6.0软件构建蛋白質-蛋白质相互作用(PPI)网络。
1.5 基因本体(GO)功能富集分析和京都基因和基因组百科全书(KEGG)通路富集分析 将西黄丸-NSCLC共同靶点以Gene Symbol的格式导入DAVID 6.8数据库(https://david.ncifcrf.gov/),分别选择生物过程(Biological Process,BP)、分子功能(Molecular Function,MF)和细胞组分(Cellular Component,CC)进行基因本体(GO)富集分析,选择KEGG进行共同靶点基因通路富集分析。
1.6 “西黄丸-靶点-NSCLC-通路”网络的构建 在KEGG富集分析中,选取与NSCLC相关性较强的通路,在Cytoscape 3.6.0软件中构建“西黄丸-靶点-NSCLC-通路”可视化网络图。
1.7 分子对接分析 根据西黄丸-靶点-NSCLC关系网中的Degree值,筛选5个关键靶点,从PubChem数据库中确定活性成分的化合物名称、分子量和2D结构,然后在RCSB PDB数据库(http://www.rcsb.org/)中下载活性成分所对应的3D结构。然后利用AutoDock Vina软件(http://vina.scripps.edu/),准备分子对接所需的配体和蛋白质,对于目标蛋白,其晶体结构须预处理,包括去除水分子、加氢、修饰氨基酸、优化能量和调整力场参数,之后满足配体结构的低能量构象。最后将这5个关键靶点结构与西黄丸的活性成分结构进行分子对接,其Affinity(kcal/mol)值即代表二者结合的结合能力,结合能力越低,配体与受体结合越稳定。最后,使用Pymol软件分析和观察对接结果。
2 结果
2.1 西黄丸活性成分及其靶点 检索到西黄丸有效活性成分共51个,对应的靶点共470个,经筛选后,牛黄、麝香、乳香、没药有效成分分别为5、9、5、32个,靶点分别有5、30、10、153个。见表1。
2.2 西黄丸活性成分-靶点网络图 采用Cytoscape 3.7.0软件构建西黄丸活性成分-靶点网络,去除独立节点后共有236个节点,517条边。其中粉色节点代表靶点,黄色节点代表作用牛黄的活性成分,紫色节点代表麝香的活性成分,橙色节点代表乳香的活性成分,绿色节点代表没药的活性成分,边代表节点间的相互作用关系。Degree值显示活性成分中槲皮素(Degree=124),Β-谷甾醇(Degree=33),豆甾醇(Degree=26),雄甾酮(Degree=26),3α-羟基-5α-17-酮(Degree=26)等在西黄丸中发挥着主要作用。见图1。
2.3 共同靶点及PPI网络 在GeneCards和OMIM数据库中分别找到相关靶点4 911和468个,合并去重,将西黄丸靶点与NSCLS靶点进行筛选得到506个相关靶点,将其导入STRING数据库,去除独立节点,最终得到195个节点与732条交互关系。导入Cytoscape 3.8.0制作可视化网络图,其中红色和紫色节点由Degree值的中位值分开,颜色越深,Degree值越大,其Degree值前5位分别为MAPK1、JUN、AKT1、TP53、RELA。见图2~4,表2。
2.4 分子对接 以2.3中得到的5个关键靶点为配体,以西黄丸51种活性成分为受体,通过AutoDock Vina软件进行分子对接,验证活性成分与靶点作用位点结合力的强弱。通过筛选,得出5个关键靶点与西黄丸中活性成分结合能力较强,选取最低结合自由能组合,使用Pymol软件进行绘图。见图5~6。
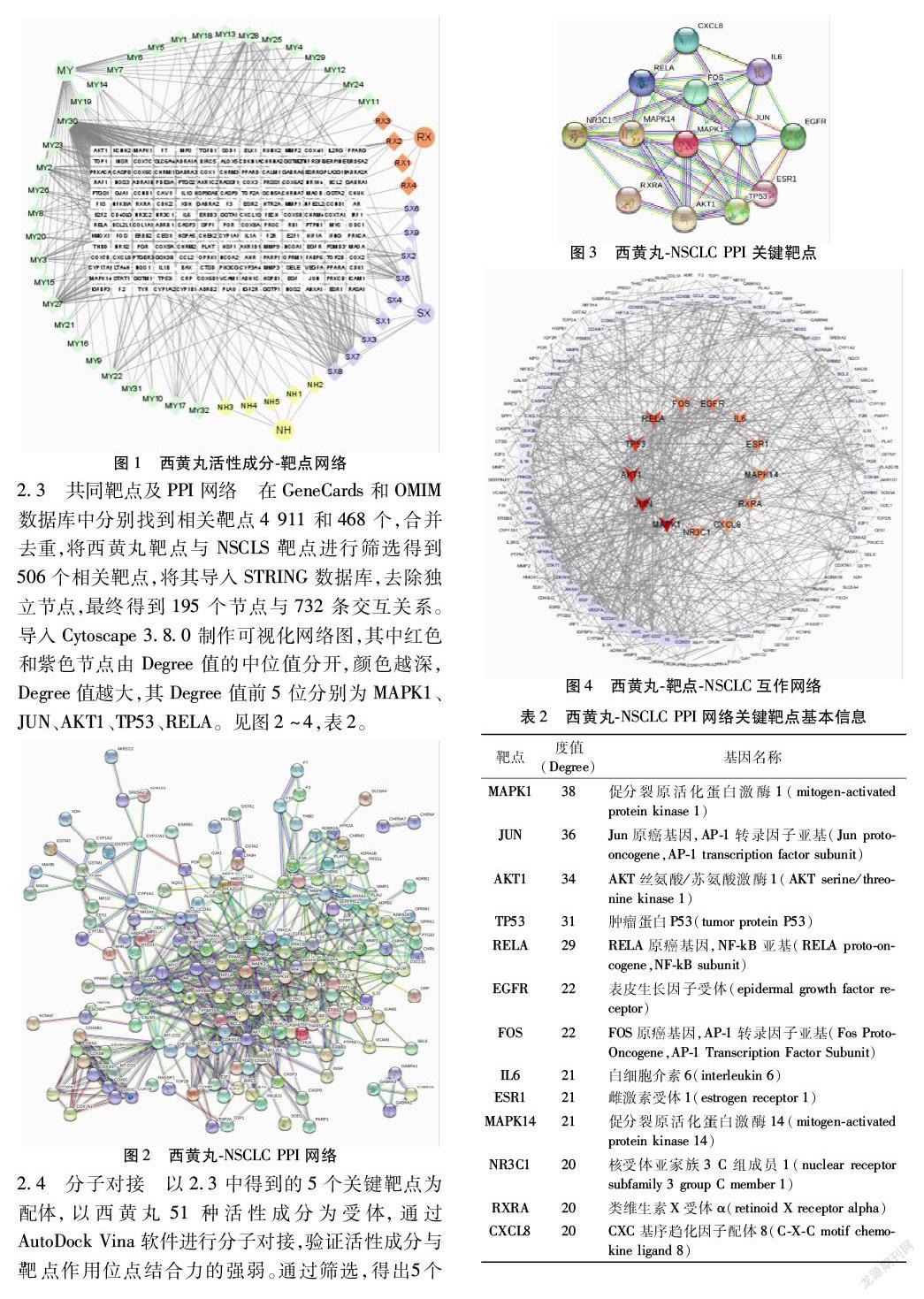
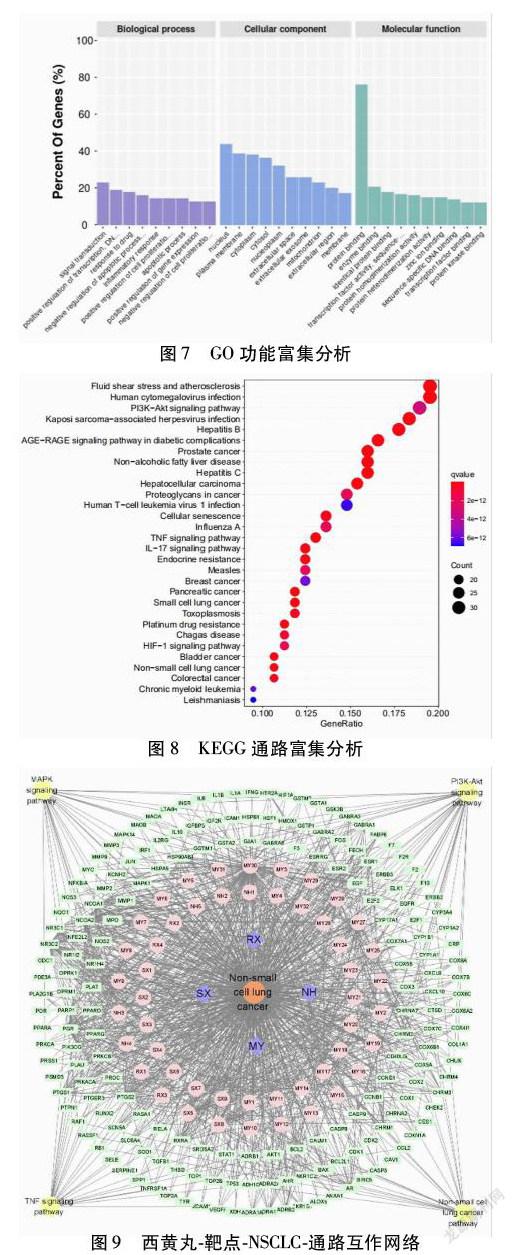
2.5 GO分析和KEGG通路富集分析 使用DAVID数据库,进行GO功能富集和KEGG通路富集分析,其中GO分析中生物学行为主要富集在RNA转录和信號转导;细胞组分富集在细胞核和质膜;分子功能富集在蛋白质结合和酶结合。KEGG富集分析显示西黄丸通过多条信号通路治疗NSCLC,涉及的富集通路有:癌症蛋白聚糖、PI3K-AKT信号通路、TNF信号通路、IL-17信号通路、NSCLC信号通路、铂类耐药相关通路等。选取前50个富集通路中的NSCLC信号通路、TNF信号通路、PI3K-AKT信号通路、MAPK信号通路,构建“西黄丸-靶点-NSCLC-通路”网络,其中绿色为共同靶点,黄色为通路,粉色为活性成分,紫色为药物名称,橙色为疾病名称。见图8~9。
3 讨论
本研究通过构建活性成分-靶点网络图,得知西黄丸关键活性成分有槲皮素、β-谷甾醇、豆甾醇、雄甾酮、3α-羟基-5α-17-酮等。现代研究表明槲皮素能够通过抑制Src基因,下调Fn14/NF-kappaB信号通路的表达,最终抑制NSCLC的增殖和转移,发挥抗NSCLC作用[12];通过调节miR-16-5p/WEE1轴增强NSCLC对放疗的敏感性[13];通过下调IL-6/STAT-3信号的表达,促进诱导NSCLC A549细胞系凋亡[14];通过抑制snail依赖性AKT的激活和非snail依赖性ADAM9的表达抑制NSCLC的迁移能力[15]。这些研究不仅为抑制NSCLC转移提供了新的见解,也提示槲皮素在治疗转移性NSCLC中具有潜在的应用价值。β-谷甾醇不仅可以有效诱导口腔鳞状细胞癌SCC9细胞凋亡,对H22荷瘤小鼠具有一定的抑瘤作用,还能够有效提高NK细胞对胰腺癌SW-1990细胞的杀伤力[16-18]。且Wang等[19]研究表明,β-谷甾醇联合BAMBI过表达,可以诱导肺癌A549细胞G0/G1细胞周期阻滞,抑制细胞增殖。豆甾醇则不仅可以通过抑制Nrf2信号通路增强子宫内膜癌细胞对化疗敏感性,还能够诱导卵巢癌细胞凋亡,抑制胃癌细胞增殖和转移迁移[20-22]。因此,西黄丸能够通过相关通路抑制肿瘤细胞的增殖转移,诱导凋亡。
通过分析西黄丸-NSCLC靶点互作网络关系图得知,西黄丸治疗NSCLC的潜在靶点主要有MAPK1(丝裂原活化蛋白激酶1)、JUN(转录因子AP-1)、AKT1(蛋白激酶1)、TP53(肿瘤坏死蛋白53)、RELA(转录因子P65)等。MAPK是丝氨酸/苏氨酸激酶构成的蛋白激酶,处于许多分子信号网络的核心,调控着细胞的增殖、分化及转录表达等[23]。研究表明MAPK1的转录及翻译的表达量在NSCLC组织中较正常肺组织明显升高[24]。且MAPK1/ERK2通路在肺癌形成早期就已被激活,促进肿瘤细胞增殖,可见MAPK1是肿瘤早期防治的潜在重要靶点[25]。原癌基因JUN和FOS被磷酸化激活后,以JUN和FOS异源二聚体或JUN同源二聚体的形式结合到转录因子激活蛋白AP-1启动子结合位点,参与细胞恶性转化,促进肺癌发生发展[26]。有体内实验研究显示,在致癌物诱导的小鼠肺癌发生模型中,肺上皮细胞选择性表达TAM67显性阴性突变体能够抑制AP-1的活性,进而有效抑制由化学致癌物诱导的肺癌发生,AP-1的转录调控是介导小鼠肺癌发生的重要机制[27]。AKT是PI3K下游的关键分子,参与调控细胞增殖、代谢、凋亡,可被各种致癌驱动因素(如EGFR和KRAS突变)不当激活,对肿瘤细胞的生长和成活至关重要[28-29]。AKT1是AKT激酶家族的一员,研究显示AKT1不仅能够促进K-RAS或EGFR突变的NSCLC细胞的侵袭和转移,还可以提高NSCLC细胞对化疗药物的敏感性[30-31]。TP53,又称P53基因,是一种著名的肿瘤抑制基因,可引发细胞凋亡,抑制细胞增殖,然而50%的人类癌症中存在着P53突变,突变会导致TP53因构象变化而产生致癌转化,使细胞生长、凋亡和DNA修复的规律被打乱,导致细胞恶性转化[32-34]。野生型TP53和变异型TP53的预计生存期分别是27个月和19个月,TP53突变是NSCLC的负预后因子,不同变异外向具有不同的预后值,可以辅助我们更好地判断NSCLC患者的预后[35]。RELA是NF-κB转录复合物的一种亚型,能够靶向促进肿瘤细胞增殖、生存、转移、侵袭、血管生成、抗化疗及放射治疗[36]。
本研究GO富集分析显示,西黄丸治疗NSCLC的生物功能主要定位在RNA转录、信号转导、DNA转录调控及对药物的反应等;参与了蛋白质结合和酶结合等分子功能;KEGG富集分析显示,西黄丸治疗NSCL涉及了多条信号通路,包括PI3K-AKT信号通路、MAPK信号通路、TNF信号通路、癌症相关信号通路等。PI3K-AKT信号通路调控着细胞生长、代谢和凋亡,在癌症中常常被激活,PIK3CA突变率为3.7%[37]。目前在SCLC细胞系中并未发现PIK3CA突变,但在NSCLC中PIK3CA突变率日益增加,尤其是鳞状细胞癌,因此瞄准PI3K-AKT通路是鳞状细胞肺癌的潜在治疗选择[38]。TNF信号通路不仅能够诱导NSCLC的发生,还能促进肿瘤细胞增殖和淋巴转移[39-40]。还有研究证明,MAPK信号通路可以通过调节肺腺癌PD-L1,改善肿瘤微环境[41]。
本研究通过网络药理学筛选分析西黄丸和NSCLC的相关靶点,构建活性药物-靶点-疾病互作网络图,实现活性成分和关键靶点的分子对接,结果显示活性成分和关键靶点对接良好,进而初步推测西黄丸发挥作用的主要活性成分是槲皮素,β-谷甾醇,豆甾醇等;潜在治疗靶点是MAPK1、JUN、AKT1、TP53等;涉及PI3K-AKT信号通路、MAPK信号通路等多条信号通路,体现西黄丸治疗NSCLC多成分、多靶点、多通路协同作用的复杂网络机制,为西黄丸的后续实验研究提供了更多的理论依据。
参考文献
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2]Yoder LH.Let′s talk ‘cancer prevention’[J].Medsurg Nurs,2005,14(3):195-198.
[3]于海涛,張巍,于英君.中药抗肿瘤作用机制的研究[J].中医临床研究,2010,2(8):88-90.
[4]杜旦锋,郭丽,盛丽娜,等.西黄丸抗肿瘤转移作用及其机制研究[J].中药材,2018,41(8):1995-1998.
[5]王贺义.西黄丸对人肾母细胞瘤SK-NEP-1细胞增殖、凋亡的影响及其机制的探讨[D].郑州:郑州大学,2018.
[6]金沈锐,张新胜,祝彼得,等.西黄丸对肝癌细胞SMMC7721分泌的血管内皮生长因子及基质金属蛋白酶2、9的影响[J].中成药,2008,30(7):1079-1081.
[7]吴志远,李芳芳,张昆,等.人工牛黄对小鼠乳腺癌肺转移的影响[J].中草药,2012,43(10):2013-2016.
[8]汪世元,陈孝平,蔡红娇,等.体外培育牛黄诱导人肝癌HepG2细胞凋亡的实验研究[J].华中科技大学学报:医学版,2005,34(6):754-756.
[9]马伟.麝香促进肺腺癌细胞增殖及凋亡效果的体外实验研究[J].四川中医,2016,34(11):48-51.
[10]卢鹏,樊晶晶,罗旭,等.麝香酮对肺癌细胞的顺铂耐药和小鼠体内的肿瘤生长的作用[J].广西医科大学学报,2020,37(11):1948-1953.
[11]陈珊珊,秦旭华,金沈锐,等.西黄丸及乳香、没药、乳没药对对多种人恶性肿瘤细胞株体外增殖影响的比较研究[J].中药药理与临床,2016,32(3):102-104.
[12]Dong Y,Yang J,Yang L,et al.Quercetin Inhibits the Proliferation and Metastasis of Human Non-Small Cell Lung Cancer Cell Line:The Key Role of Src-Mediated Fibroblast Growth Factor-Inducible 14(Fn14)/Nuclear Factor kappa B(NF-κB) pathway[J].Med Sci Monit,2020,26:e920537.
[13]Wang Q,Chen Y,Lu H,et al.Quercetin radiosensitizes non-small cell lung cancer cells through the regulation of miR-16-5p/WEE1 axis[J].IUBMB Life,2020,72(5):1012-1022.
[14]Mukherjee A,Khuda-Bukhsh AR.Quercetin down-regulates IL-6/STAT-3 signals to induce mitochondrial-mediated apoptosis in a nonsmall-cell lung-cancer cell line,A549[J].J Pharmacopuncture,2015,18(1):19-26.
[15]Chang JH,Lai SL,Chen WS,et al.Quercetin suppresses the metastatic ability of lung cancer through inhibiting Snail-dependent Akt activation and Snail-independent ADAM9 expression pathways[J].Biochim Biophys Acta Mol Cell Res,2017,1864(10):1746-1758.
[16]裴浩,李海朋,黄莹莹,等.β-谷甾醇诱导口腔鳞状细胞癌SCC9细胞凋亡及机制研究[J].口腔医学研究,2019,35(1):42-45.
[17]林明珠,赵岩,蔡恩博,等.β-谷甾醇对H_(22)荷瘤小鼠体内抗肿瘤作用[J].中国公共卫生,2017,33(12):1797-1800.
[18]程静,刘军权,陈复兴,等.β-谷甾醇对人自然杀伤细胞杀伤胰腺癌SW-1990细胞的影响[J].检验医学与临床,2012,9(24):3078-3080,3082.
[19]Wang X,Li M,Hu M,et al.BAMBI overexpression together with β-sitosterol ameliorates NSCLC via inhibiting autophagy and inactivating TGF-β/Smad2/3 pathway[J].Oncol Rep,2017,37(5):3046-3054.
[20]Liao H,Zhu D,Bai M,et al.Stigmasterol sensitizes endometrial cancer cells to chemotherapy by repressing Nrf2 signal pathway[J].Cancer Cell Int,2020,20:480.
[21]Bae H,Song G,Lim W.Stigmasterol causes oOvarian cancer cell apoptosis by inducing endoplasmic reticulum and mitochondrial dysfunction[J].Pharmaceutics,2020,12(6):488.
[22]Li K,Yuan D,Yan R,et al.Stigmasterol exhibits potent antitumor effects in human gastric cancer cells mediated via inhibition of cell migration,cell cycle arrest,mitochondrial mediated apoptosis and inhibition of JAK/STAT signalling pathway[J].J BUON,2018,23(5):1420-1425.
[23]Orton RJ,Sturm OE,Vyshemirsky V,et al.Computational modelling of the receptor-tyrosine-kinase-activated MAPK pathway[J].Biochem J,2005,392(Pt 2):249-261.
[24]童偉,刘永煜,玉寒冰,等.环氧合酶-2抑制剂对非小细胞肺癌A549细胞VEGF表达的影响[J].解剖学研究,2015,37(6):454-456,467.
[25]López-Malpartida AV,Ludea MD,Varela G,et al.Differential ErbB receptor expression and intracellular signaling activity in lung adenocarcinomas and squamous cell carcinomas[J].Lung Cancer,2009,65(1):25-33.
[26]Short JD,Pfarr CM.Translational regulation of the JunD messenger RNA[J].J Biol Chem,2002,277(36):32697-32705.
[27]Tichelaar JW,Yan Y,Tan Q,et al.A dominant-negative c-jun mutant inhibits lung carcinogenesis in mice[J].Cancer Prev Res(Phila),2010,3(9):1148-1156.
[28]Vivanco I,Sawyers CL.The phosphatidylinositol 3-Kinase AKT pathway in human cancer[J].Nat Rev Cancer,2002,2(7):489-501.
[29]Pao W,Girard N.New driver mutations in non-small-cell lung cancer[J].Lancet Oncol,2011,12(2):175-180.
[30]Rao G,Pierobon M,Kim IK,et al.Inhibition of AKT1 signaling promotes invasion and metastasis of non-small cell lung cancer cells with K-RAS or EGFR mutations[J].Sci Rep,2017,7(1):7066.
[31]Lee MW,Kim DS,Min NY,et al.Akt1 inhibition by RNA interference sensitizes human non-small cell lung cancer cells to cisplatin[J].Int J Cancer,2008,122(10):2380-2384.
[32]Soussi T,Wiman KG.Shaping genetic alterations in human cancer:the p53 mutation paradigm[J].Cancer Cell,2007,12(4):303-312.
[33]Deben C,Van den Bossche J,Van Der Steen N,et al.Deep sequencing of the TP53 gene reveals a potential risk allele for non-small cell lung cancer and supports the negative prognostic value of TP53 variants[J].Tumour Biol,2017,39(2):1010428317694327.
[34]VanderLaan PA,Rangachari D,Mockus SM,et al.Mutations in TP53,PIK3CA,PTEN and other genes in EGFR mutated lung cancers:Correlation with clinical outcomes[J].Lung Cancer,2017,106:17-21.
[35]Jiao XD,Qin BD,You P,et al.The prognostic value of TP53 and its correlation with EGFR mutation in advanced non-small cell lung cancer,an analysis based on cBioPortal data base[J].Lung Cancer,2018,123:70-75.
[36]Park MH,Hong JT.Roles of NF-κB in cancer and iDiseases and their therapeutic approaches[J].Cells,2016,5(2):15.
[37]Scheffler M,Bos M,Gardizi M,et al.PIK3CA mutations in non-small cell lung cancer(NSCLC):genetic heterogeneity,prognostic impact and incidence of prior malignancies[J].Oncotarget,2015,6(2):1315-1326.
[38]Yamamoto H,Shigematsu H,Nomura M,et al.PIK3CA mutations and copy number gains in human lung cancers[J].Cancer Res,2008,68(17):6913-6921.
[39]刘睿,宋琴琴,张志,等.肿瘤坏死因子-β遗传变异与非小细胞肺癌发病风险遗传易感性的关系[J].中华预防医学杂志,2015,49(1):41-44.
[40]Zhang S,Wang H,Xu Z,et al.Lymphatic metastasis of NSCLC iInvolves chemotaxis effects of lymphatic endothelial cells through the CCR7-CCL21 axis modulated by TNF-α[J].Genes(Basel),2020,11(11):1309.
[41]Stutvoet TS,Kol A,de Vries EG,et al.MAPK pathway activity plays a key role in PD-L1 expression of lung adenocarcinoma cells[J].J Pathol,2019,249(1):52-64.
(2020-12-29收稿 責任编辑:魏庆双)
