大黄虫丸对转化生长因子-β1诱导A549细胞上皮-间充质转化的影响
2021-01-13蒋锋利黄茂蔡松任士杰孙文丽张晶赵明镜张立山
蒋锋利 黄茂 蔡松 任士杰 孙文丽 张晶 赵明镜 张立山

摘要 目的:基于“IPF患者存在肺絡干血”假说,观察大黄虫丸含药血清对TGF-β1诱导后A549细胞上皮-间充质转化(EMT)及Smad3,Collagen Ⅲ表达的影响,探讨其防治特发性肺纤维化(IPF)的作用机制。方法:正常培养并取对数生长期A549细胞,TGF-β1对其诱导48 h,电子显微镜下观察A549细胞的形态学变化;选择吡非尼酮(PFD)为阳性对照药,RT-PCR法检测EMT相关基因及Smad3 mRNA的表达;Western Blottingting法检测Smad3,p-Smad3,Collagen Ⅲ蛋白表达。结果:成功获取发生EMT的A549细胞;以α-SMA mRNA表达情况判断EMT程度由高到低依次为:模型组(M),大黄虫丸含药血清大剂量组(D),西药组(P),大黄虫丸含药血清中剂量组(Z),大黄虫丸含药血清小剂量组(X),空白对照组(K);与M组比较,Z组,X组,P组中Collagen Ⅲ表达不同程度降低(P<0.05),且其在Z组与K组中表达差异无统计学意义(P>0.05);与M组及K组比较,各观察组Smad3表达差异无统计学意义(P>0.05),但对其基因及磷酸化,即Smad3 mRNA及p-Smad3的表达有影响,且与M组比较,Z组,X组,P组中均不同程度降低(P<0.05),D组中表达虽低于M组,但差异无统计学意义(P>0.05)。结论:大黄虫丸对TGF-β1诱导后A549细胞发生EMT程度与Smad3 mRNA及Collagen Ⅲ的表达有影响,推测大黄虫丸对IPF的保护机制可能与不同程度阻断或逆转了TGF-β1/Smad3介导的EMT有关。
关键词 大黄虫丸;肺络干血;特发性肺纤维化;含药血清;上皮细胞-间充质转化;转化生长因子-β1;α-平滑肌肌动蛋白;Ⅲ型胶原蛋白
Abstract Objective:To observe the effects of Dahuang Zhechong Pills-containing serum on EMT and the expression of Smad3 and Collagen Ⅲ Protein in A549 cells after TGF-β1 induction based on the hypothesis of “the presence of pulmonary collateral hard blood in IPF patients”,and to explore its role in the prevention and treatment of idiopathic pulmonary fibrosis mechanism.Methods:Normally we grew and took A549 cells in logarithmic growth phase,TGF-β1 intervened for 48 h,observed the morphological changes of A549 cells under electron microscope; choosed pirfenidone as a positive control drug,RT-PCR method to detect the expression of EMT related genes and Smad3 mRNA; Western Blotting was used to detect the expression of Smad3,p-smad3,Collagen Ⅲ protein.Results:The A549 cells with EMT were successfully obtained; the degree of EMT was determined from α-SMA mRNA expression in order from high to low:model group(M),large-dose group of Dahuang Zhechong Pills containing serum(D),Western medicine group(P),middle-dose group of Dahuang Zhechong Pills containing serum(Z),little-dose group of Dahuang Zhechong Pills containing serum(X),blank control group(K); Compared with M,the expression of Collagen Ⅲ in Z,X,and P decreased to varying degrees(P<0.05),and there was no difference in the expression of Z and K(P>0.05); compared with M and K,there was no difference in the expression of Smad3 in each experimental group(P>0.05),but it had an effect on the expression of its genes and phosphorylation,that is,the expression of Smad3 mRNA and p-smad3.All of them decreased in different degrees(P<0.05).Although the expression in D was lower than M,it was not statistically significant(P>0.05).Conclusion:Dahuang Zhechong Pills has the effect on EMT and the expression of Smad3 mRNA and Collagen Ⅲ in A549 cells after TGF-β1 induction.It is speculated that the protective mechanism of Dahuang Zhechong Pills on IPF may be related to the blocking or reversal of EMT mediated by TGF-β/Smad3 to varying degrees.
Keywords Dahuang Zhechong Pills; Pulmonary collateral hard blood; IPF; Drug-containing serum; EMT; TGF-β1; α-SMA; Collagen Ⅲ
中图分类号:R289.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.24.007
特发性肺纤维化(Idiopathic Pulmonary Fibrosis,IPF)是一种原因不明,慢性进展,致死性间质性肺病,隶属中医“肺痿”“肺痹”范畴,亦有医家将其归为“喘证”,病性为本虚标实。该病以间充质细胞聚集体和能表达α-平滑肌肌动蛋白(α-SMA),且能促进有丝分裂及细胞外基质(ECM)分泌增加的肌成纤维细胞构成的“成纤维细胞灶”为其病理特征[1]。武维屏,姜良铎为代表的中医肺病专家提出“肺系络病”理论,将其病机概括为“气虚血瘀,痰热互结,痹阻肺络”[2-3]。基于以上认识,我们提出“IPF患者存在肺络干血”的假说,认为“肺络干血是肺纤维化病因,细胞外基质沉积是干血实质”[4]。针对“干血”一证,张仲景治以“缓中补虚”之大黄虫丸,尤在泾将本方治法概括为“润以濡其干,虫以动其瘀,通以去其闭”,实为仲景治疗“干血”的三大法门。
前期实验中,我们证实大黄虫丸对博来霉素致IPF大鼠的保护作用可能通过抑制MMP-2的产生来实现[5]。本实验通过制备不同浓度大黄虫丸含药血清,正常培养并取对数生长期A549细胞进行实验,TGF-β1(5 ng/mL)对其诱导48 h,电子显微镜下观察A549细胞的形态学变化;选择吡非尼酮作为阳性对照药,RT-PCR法检测EMT相关基因及Smad3 mRNA的表达;Western Blotting法检测Smad3,p-Smad3,Collagen Ⅲ蛋白表达,以期探索大黄虫丸对IPF防治作用的更多内在机制,进一步丰富捜剔肺络法防治IPF的学术内涵。
1 材料与方法
1.1 材料
1.1.1 动物与细胞 选取健康SD雄性大鼠60只,体质量250~300 g。由北京维通利华试验动物技术有限公司提供,SPF/VAF级,许可证号:SCXK(京)2016-0006。大鼠饲养环境,湿度为5%~10%,温度(22±2)℃,12 h/12 h光照/暗循环,可以自由获取食物和饮水。本实验通过北京中医药大学东直门医院伦理委员会审批(伦理审批号:19-34)。
人肺泡上皮A549细胞株(中国科学院典型培养物保藏委员会细胞库,北京)。
1.1.2 药物 大黄虫丸(北京同仁堂,国药准字:Z11020002,批号:17013170);注射用盐酸博来霉素(杭州瀚晖制药有限公司,国药准字:H20055883,批号:19033911);吡非尼酮胶囊(北京康蒂尼药业,国药准字:H20133376,批号:190505)。
1.1.3 试剂与仪器 总RNA提取试剂盒(北京基谱生物,货号:GPQ1801),Smad3抗体(Abcam公司,美国,货号:ab40854),p-Smad3抗体(CST公司,美国,货号:9520),Ⅲ型胶原蛋白抗体(Proteintech公司,美国,货号:22734-1-AP),Actin抗体(Abcam公司,美国,货号:ab6276),山羊抗鼠IgG,HRP(Abcam公司,美國,货号:ab6789)。二氧化碳培养箱(SANYO公司,日本,型号:MC0175),离心机(Eppendorf公司,德国,型号:Centrifuge 5415D),倒置显微镜(OLYMPUS公司,日本,型号:CKX41),荧光定量PCR仪(杭州博日科技,型号:9600Plus),分光光度计(Thermo scientific公司,美国,型号:GENESYSTM 50),温控摇床(海门其林贝尔,型号:TS-2000A),电泳仪(北京凯元信瑞,型号:PP-1150)。
1.2 方法
1.2.1 大黄虫丸含药血清的制备及保存 SD大鼠适应性喂养3 d后,参照卢磊等[6]方法制备含药血清。按人与动物等效剂量换算法,分别算得大黄虫丸大,中,小及吡非尼酮的给药剂量为1.8 g/(kg·d),0.9 g/(kg·d),0.45 g/(kg·d)及0.18 g/(kg·d),以上剂量分别各给10只SD大鼠灌服,1次/d,持续7 d。末次给药1 h后,3%戊巴比妥钠(0.15 mL/100 g)腹腔内麻醉,无菌条件腹主动脉取血,冰上静置2 h,4 ℃,3 000 r/min(离心半径13.5 cm)离心15 min取上清液,分装并标记,56 ℃灭活30 min,-80 ℃快速冻固保存,待用。剩余20只SD大鼠灌以等量等渗盐水,以同样方法制备空白血清并保存,待用。
1.2.2 实验分组与造模 实验分为空白对照组(K组),模型组(M组),西药组(P组),模型+大黄虫丸含药血清大剂量组(D组),模型+大黄虫丸含药血清中剂量组(Z),模型+大黄虫丸含药血清小剂量组(X组)。参照Hidenori Kasai等的方法复制IPF细胞模型[7]。收集对数生长期A549细胞,调整细胞悬液浓度至5×104/mL,每孔2.5 mL接种于6孔板,2组均设3个复孔,37 ℃,5%CO2条件下,培养24 h。换液,均加入无血清DMEM/F-12培养基2.5 mL,继续培养24 h。换液,K组每孔加入2.5 mL培养基,其余各组每孔加入2.5 mL相应含TGF-β1(5 ng/mL)及药物血清的培养基,继续培养48 h,倒置显微镜下观察并拍照。见图1。结合2.2中,M组与K组比较,E-cadherin mRNA表达显著降低(P<0.01),间充质标志α-SMA mRNA表达显著升高(P<0.01),表明IPF细胞模型成功[8]。
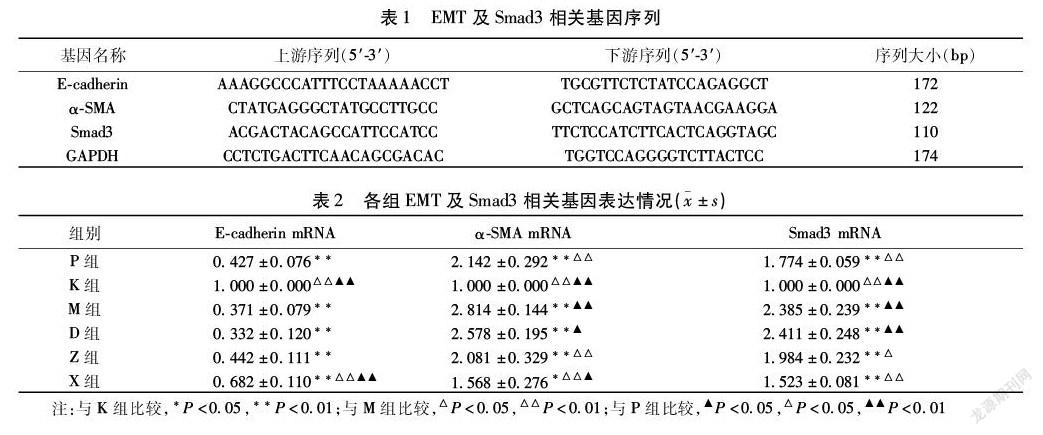
1.2.3 RT-PCR法检测EMT及Smad3相关基因表达 不同浓度大黄虫丸含药血清对TGF-β1诱导48 h后A549细胞表达上皮性钙黏蛋白(E-cadherin)mRNA,α-SMA mRNA,Smad3 mRNA情况的影响。获取1.2.2中各观察组细胞,按总RNA提取试剂盒(DNaseⅠ)试剂盒说明提取细胞样本中总RNA并定量,1%琼脂糖凝胶进行电泳,检测RNA的完整性。按mRNA cDNA合成试剂盒说明逆转录合成cDNA,-20 ℃保存备用。按mRNA/lncRNA qPCR试剂盒说明进行扩增,反应程序为95 ℃ 30 s,(95 ℃ 5 s,60 ℃ 30 s)×45个循环,同时在60~95 ℃进行融解曲线分析,采用2-△△Ct法进行数据的相对表达强度分析,所有样本均设3个重复。引物设计由北京基谱生物科技有限公司完成。见表1。
1.2.4 Western Blotting法检测Smad3,p-Smad3,Collagen Ⅲ蛋白表达
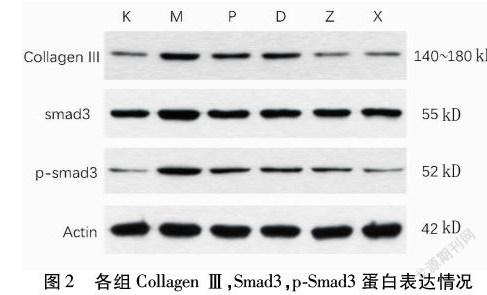
Western Blotting法检测不同浓度大黄虫丸含药血清对TGF-β1诱导48 h后A549细胞表达Smad3,p-Smad3,Collagen Ⅲ蛋白情况的影响。重复1.2.2实验分组及细胞培养过程,获取TGF-β1诱导48 h后A549细胞。按蛋白质提取试剂盒(北京基谱生物,货号:GPP1815)说明进行蛋白提取,BCA法蛋白定量,依照电泳上样量需要用SDS-PAGE上样缓冲液(5×)调整蛋白浓度,100 ℃煮沸变性10 min备用。配制12%的分离胶,5%浓缩胶。算得待检测蛋白样品上样量60 μg,浓缩胶恒压80 V,约20 min;分离胶恒压120 V,电泳至溴酚蓝到凝胶底部。2 h恒流300 mA转膜至PVDF膜,5%BSA室温封闭1 h。将PVDF膜置于杂交袋中,分别加入配制好的一抗4 ℃孵育过夜。TBST洗膜3次,10 min/次,加入相应二抗,室温孵育1 h。TBST洗膜3次,10 min/次。按ECL Plus Western Blotting Kit试剂盒说明暗室中曝光,显影并定影。
条带灰度值采用Quantity One v.4.6.2软件进行读取,除以内参Actin灰度值,即得样品中目标蛋白的相对表达量,所有样本均设3个重复。
1.3 统计学方法 采用SPSS 25.0统计软件进行数据分析,计量数据以均数±标准差(±s)表示,各组间差异用单因素方差分析,两两比较用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 M组和K组组织学结果
M组中A549细胞经TGF-β1诱导48 h,形态逐渐由鹅卵石状变为伸长的纺锤形或梭形,细胞圆形度降低,与成纤维细胞,肌纤维母细胞形态相似。见图1。
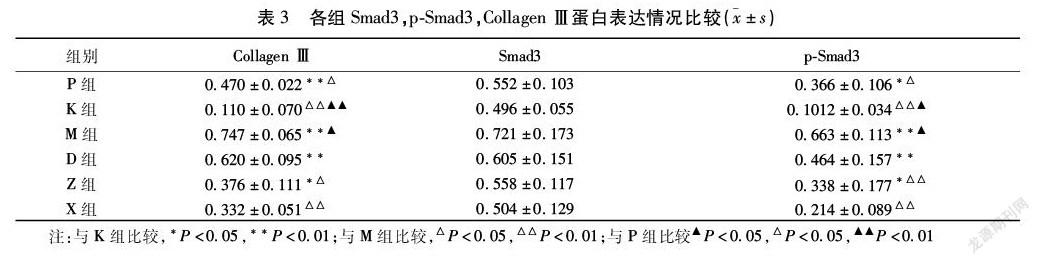
2.3 各组Smad3,p-Smad3,Collagen Ⅲ蛋白表达 与K组比较,M组中Collagen Ⅲ、Smad3和p-Smad3的表达较K组显著增加(P<0.01),说明TGF-β1诱导48 h后的A549细胞核转录过程十分活跃。PFD处理后,与M组比较,P中Collagen Ⅲ、Smad3和p-Smad3的表达显著降低(P<0.05)。同样的,在D组、Z组和X组中也观察到这种现象。当剂量为0.45 g/(kg·d)时,则显示出较好的治疗效果。见图2,表3。
3 讨论
转化生长因子-β(TGF-β)是一种多功能细胞因子,具有促进细胞增殖,分化,凋亡及ECM形成等生物活性,被認为是诱导包括肺在内诸多脏器纤维化的“主开关”[9]。肺损伤的患者和动物的肺纤维化中已发现TGF-β1过表达[10-11],且TGF-β1作为上皮-间充质转化(Epithelial-mesenchymal Transition,EMT)诱导剂在包括肝脏,肾近端小管,晶体等上皮细胞中已被证实[12]。在IPF进展中,肺泡及气道上皮中均发现存在EMT,其中肺泡上皮细胞(AEC)是肺纤维化的主要致病介质[13]。α-SMA表达说明成纤维细胞分化为成肌纤维细胞,是ECM信号的来源,且这一过程促进了肺损伤的发展[14]。另外,α-SMA,I型胶原,Ⅲ型胶原,纤连蛋白及波形蛋白消融可减轻小鼠肺组织样本中的纤维化[15]。Smads是TGF-β超家族细胞内重要的信号转导和调节分子,该信号通路与人类诸多疾病的发生密切相关[16]。除Smads介导的细胞核转录外,TGF-β还可以激活包括促分裂原激活的蛋白激酶(MAPK)途径,Rho样GTPase信号转导途径及磷脂酰肌醇3激酶(PI3K)/AKT等多种信号途径来促使脏器纤维化[17]。
前期研究中证实,EMT可以被多种中药制剂阻断或逆转,表现出对IPF的保护。柴胡皂苷D可通过mTOR信号通路抑制A549细胞EMT,且呈明显的剂量-时间依赖关系[18]。姜黄素通过Wnt3a/β-catenin信号通路抑制EMT,从而阻断胃癌细胞(MKN45)的增殖,迁移及侵袭[19];姜黄素可逆转缺氧诱导的肝癌细胞(HepG2)增殖和迁移能力增加,可能与其抑制缺氧诱导的HIF1-α蛋白上调和EMT有关[20]。黄芩苷通过TGF-β/Smads信号转导途径减轻因辐射诱导Ⅱ型AEC发生的EMT[21]。穿心莲内酯通过TGF-β1介导的Smads依赖性和非依赖性途径抑制T细胞的增殖和成纤维细胞分化,从而改善了博莱霉素诱导的肺纤维化[22]。槲皮素通过增加E-cadherin表达,降低神经性钙黏蛋白(N-cadherin),波形蛋白(Vimentin)表达,使得TGF-β1诱导的肝癌细胞(SMMC-7721)EMT得到明显抑制[23]。白藜芦醇通过阻断TGF-β1/Smad3信号通路转导,抑制了TGF-β1诱导的人肺上皮细胞A549的增殖及上皮间质转化[24]。人参皂苷Rg1可能通过抑制EMT来改善COPD大鼠小气道纤维化[25]。黄芪甲苷可通过AKT/β-catenin信号通路抑制TGF-β1诱导的人腹膜间皮细胞(HMrSV5)EMT程度[26]。大黄素通过抑制TGF-β1/ADAMTS-1信号抑制肺成纤维细胞增殖及其EMT,并减少Ⅰ/Ⅲ型胶原合成[27]。
本研究中,E-cadherin mRNA表达降低与α-SMA mRNA表达升高为发生EMT的标志。如结果所示,α-SMA mRNA表达由高到低依次为:M组,D组,P组,Z组,X组,K组。与M组比较,除D组外其余组,作为间充质细胞标志α-SMA mRNA表达均显著降低(P<0.01),提示中小剂量大黄虫丸可显著改善TGF-β1诱导48 h后A549细胞EMT程度,且效果上X组优于P组(P>0.05)。作为衡量IPF程度的重要指标,亦是ECM重要成分的Collagen Ⅲ表达由高到低依次为:M组,D组,P组,Z组,X组,K组。本研究结果还提示大黄虫丸可不同程度抑制TGF-β1诱导48 h后A549细胞表达Smad3 mRNA及p-Smad3,且大体上与剂量呈负相关,进而影响TGF-β1/Smad3信号通路介导的EMT程度,起到抗纤维化作用,且此过程可能受到其他与EMT相关信号通路的影响,尚需进一步研究证实。此外,与M组比较,D组中表达α-SMA mRNA,Collagen Ⅲ虽不同程度降低,但均无差异(P>0.05),且E-cadherin mRNA的表达甚至为各用药组最低,即其抑制EMT效果最差。提示大黄虫丸对IPF的保护作用可呈双向性,剂量的选择是主要影响因素。
综上所述,TGF-β1/Smads信号通路在IPF的發生与进展中起重要作用,作为正向调节剂,磷酸化Smad3过表达可促进与TGF-β1信号密切相关的EMT发生。本研究结果表明,大黄虫丸对TGF-β1诱导后A549细胞发生EMT程度与Smad3基因及磷酸化的表达有影响,推测大黄虫丸对IPF的保护机制可能与不同程度阻断或逆转了TGF-β1/Smad3介导的EMT有关,为大黄虫丸可作为IPF患者的潜在有效治疗药物提供了更多科学依据。
参考文献
[1]Sgalla G,Iovene B,Calvello M,et al.Idiopathic pulmonary fibrosis:pathogenesis and management[J].Respir Res,2018,19(1):32.
[2]崔红生,邱冬梅,武维屏.肺间质纤维化从络病辨治探析[J].中医杂志,2003,44(12):946-947.
[3]姜良铎,张晓梅,肖培新.特发性肺间质纤维化的病因病机探讨[J].中华中医药杂志,2008,23(11):984-986.
[4]张立山,武维屏.干血与肺间质纤维化[J].中国中医药信息杂志,2012,19(12):96-99.
[5]余松,张立山,王晓飞,等.大黄虫丸对博来霉素致肺纤维化模型大鼠MMP-2和TGF-β1的影响[J].环球中医药,2018,11(3):331-335.
[6]卢磊,刘晓丹,张培影.中药血清药理学及血清药物化学研究进展[J].中国中医急症,2018,27(1):178-181,188.
[7]Kasai H,Allen JT,Mason RM,et al.TGF-beta1 induces human alveolar epithelial to mesenchymal cell transition(EMT)[J].Respir Res,2005,6:56.
[8]阮越勇,张浩军,疏欣杨,等.转化生长因子β1诱导A549细胞上皮-间充质转化的时间相关性[J].中日友好医院学报,2019,33(1):22-26,封2.
[9]Dennler S,Goumans MJ,ten Dijke P.Transforming growth factor beta signal transduction[J].J Leukoc Biol,2002,71(5):731-740.
[10]Liu B,Cao B,Zhang D,et al.Salvianolic acid B protects against paraquat-induced pulmonary injury by mediating Nrf2/Nox4 redox balance and TGF-β1/Smad3 signaling[J].Toxicol Appl Pharmacol,2016,309:111-120.
[11]Hseu YC,Yang TY,Li ML,et al.Chalcone flavokawain A attenuates TGF-β1-induced fibrotic pathology via inhibition of ROS/Smad3 signaling pathways and induction of Nrf2/ARE-mediated antioxidant genes in vascular smooth muscle cells[J].J Cell Mol Med,2019,23(2):775-788.
[12]Willis BC,Borok Z.TGF-beta-induced EMT:mechanisms and implications for fibrotic lung disease[J].Am J Physiol Lung Cell Mol Physiol,2007,293(3):L525-534.
[13]O′Connor JW,Gomez EW.Biomechanics of TGFβ-induced epithelial-mesenchymal transition:implications for fibrosis and cancer[J].Clin Transl Med,2014,3:23.
[14]Wang Y,Lin C,Ren Q,et al.Astragaloside effect on TGF-β1,SMAD2/3,and α-SMA expression in the kidney tissues of diabetic KKAy mice[J].Int J Clin Exp Pathol,2015,8(6):6828-6834.
[15]Chen Y,Zhang W,Geng N,et al.MMPs,TIMP-2,and TGF-beta1 in the cancerization of oral lichen planus[J].Head Neck,2008,30(9):1237-1245.
[16]Yasuoka H,Zhou Z,Pilewski JM,et al.Insulin-like growth factor-binding protein-5 induces pulmonary fibrosis and triggers mononuclear cellular infiltration[J].Am J Pathol,2006,169(5):1633-1642.
[17]Gyrfi AH,Matei AE,Distler J.Targeting TGF-β signaling for the treatment of fibrosis[J].Matrix Biol,2018,68-69:8-27.
[18]史小東,郑金旭,钱海,等.柴胡皂甙D经mTOR通路抑制A549细胞的上皮间质转化[J].江苏大学学报:医学版,2019,29(2):113-116.
[19]常远鸿,江梅,刘凯歌.姜黄素对缺氧诱导肝癌细胞HepG2上皮细胞间质转分化(EMT)的逆转作用[J].现代肿瘤医学,2012,20(9):1763-1767.
[20]刘文虎,袁江北,张帆,等.姜黄素通过Wnt3a/β-catenin/EMT信号通路抑制胃癌细胞的增殖、迁移及侵袭[J].中国中药杂志,2019,44(14):3107-3115.
[21]Lu J,Zhong Y,Lin Z,et al.Baicalin alleviates radiation-induced epithelial-mesenchymal transition of primary type Ⅱ alveolar epithelial cells via TGF-β and ERK/GSK3β signaling pathways[J].Biomed Pharmacother,2017,95:1219-1224.
[22]Li J,Feng M,Sun R,et al.Andrographolide ameliorates bleomycin-induced pulmonary fibrosis by suppressing cell proliferation and myofibroblast differentiation of fibroblasts via the TGF-β1-mediated Smad-dependent and-independent pathways[J].Toxicol Lett,2020,321:103-113.
[23]冯亚莉,李珂,刘金海,等.槲皮素-3-O-酰胺类衍生物的合成及其抗癌活性研究[J].中草药,2020,51(16):4133-4141.
[24]张云珍,方海燕,余红,等.白藜芦醇抑制TGF-β1/Smad3信号通路对人肺上皮细胞A549 EMT调控的影响及机制[J].广东医学,2019,40(15):2130-2134.
[25]刘乾,管思彬,韩锋锋,等.人参皂甙Rg1慢性阻塞性肺疾病大鼠肺组织上皮间充质转化的影响[J].实验动物与比较医学,2018,38(6):422-427.
[26]俞曼殊,史俊,赵君谊,等.黄芪甲苷调控Akt信号通路阻抑人腹膜间皮细胞间充质转化的实验研究[J].南京中医药大学学报,2019,35(1):53-57.
[27]刘理静,尹辉明,贺兼斌,等.大黄素抑制肺成纤维细胞增殖及转分化和胶原蛋白合成[J].细胞与分子免疫学杂志,2016,32(7):921-925.
(2020-06-16收稿 责任编辑:张雄杰)
