灵芝三萜化合物的抗肿瘤靶点预测与活性验证
2017-03-20杜国华王宏旭闫征刘莉莹陈若芸
杜国华+王宏旭+闫征+刘莉莹+陈若芸
[摘要]研究發现灵芝三萜类化合物具有抗肿瘤活性,但其作用靶点尚不清楚,该试验主要研究灵芝三萜类化合物的抗肿瘤活性并对其可能的作用靶点进行预测。采用Discovery Studio软件的LibDock模块,以灵芝子实体中的26种三萜类化合物作为配体,分别与抗肿瘤作用明确的11个靶点蛋白进行分子对接,获得对接的打分结果,评判配体与靶点蛋白受体结合的亲和力,从而进行灵芝三萜类化合物抗肿瘤的虚拟筛选,探讨可能的作用靶点。同时,MTT实验检测26种灵芝三萜类化合物对5种肿瘤细胞的抑制能力,计算IC50,以此反映化合物的抗肿瘤活性。对接结果表明,对接位置数目大于5,且对接得分高于100,可以作为判断化合物是否具有活性的阈值,据此筛选出8种灵芝三萜类化合物可能具有抗肿瘤活性,其中5个具有多靶点作用的三萜成分。MTT细胞实验显示,灵芝酸Y对肺癌细胞H460显示了一定的抑制活性,IC50为22.4 μmol·L-1,其次是7-oxo-ganoderic acid Z2,IC50为43.1 μmol·L-1。其他三萜类化合物对被测肿瘤细胞株未显示活性或活性很弱。该研究建立的分子对接虚拟筛选方法可用于灵芝抗肿瘤活性成分的初步筛选,通过该方法的筛选,结合MTT细胞毒活性实验结果,发现灵芝酸Y具有抗肿瘤,尤其抗肺癌开发的潜在可能性,7-oxo-ganoderic acid Z2和ganoderon B具有一定的抑制活性,其抗肿瘤作用有待于进一步深入研究,该研究结果可为抗肿瘤药物的研制提供参考。
[关键词]灵芝子实体; 三萜类化合物; 抗肿瘤; 分子对接; 虚拟筛选
[Abstract]It has reported that Ganoderma lucidum triterpenoids had anti-tumor activity. However, the anti-tumor target is still unclear. The present study was designed to investigate the anti-tumor activity of G. lucidum triterpenoids on different tumor cells, and predict their potential targets by virtual screening. In this experiment, molecular docking was used to simulate the interactions of 26 triterpenoids isolated from G. lucidum and 11 target proteins by LibDock module of Discovery Studio2016 software, then the anti-tumor targets of triterpenoids were predicted. In addition, the in vitro anti-tumor effects of triterpenoids were evaluated by MTT assay by determining the inhibition of proliferation in 5 tumor cell lines. The docking results showed that the poses were greater than five, and Libdock Scores higher than 100, which can be used to determine whether compounds were activity. Eight triterpenoids might have anti-tumor activity as a result of good docking, five of which had multiple targets. MTT experiments demonstrated that the ganoderic acid Y had a certain inhibitory activity on lung cancer cell H460, with IC50 of 22.4 μmol·L-1, followed by 7-oxo-ganoderic acid Z2, with IC50 of 43.1 μmol·L-1. However, the other triterpenoids had no anti-tumor activity in the detected tumor cell lines. Taking together, molecular docking approach established here can be used for preliminary screening of anti-tumor activity of G.lucidum ingredients. Through this screening method, combined with the MTT assay, we can conclude that ganoderic acid Y had antitumor activity, especially anti-lung cancer, and 7-oxo-ganoderic acid Z2 as well as ganoderon B, to a certain extent, had anti-tumor activity. These findings can provide basis for the development of anti-tumor drugs. However, the anti-tumor mechanisms need to be further studied.
[Key words]fruiting bodies of Ganoderma lucidum; triterpenoids; anti-tumor; molecular docking; virtual screening
灵芝Ganoderma lucidum(Leyss. Ex Fr)Karst.又称瑞草、灵芝草,是灵芝属药食两用真菌,世界各地均有分布,以热带和亚热带地区为多。我国灵芝药用已有2 000多年的历史,在《神农本草经》中,记载着赤芝、黑芝、紫芝等几种灵芝的功效。大量药理研究表明,灵芝具有调节免疫、抗肿瘤[1-2]、抗衰老、提高机体耐缺氧能力等活性。其中研究较多的灵芝多糖具有抗肿瘤、抗氧自由基、抗衰老、提高免疫力、活血化瘀等多种生物活性。
近年来从灵芝中分离得到的另一类具有药理活性的化学成分是三萜类化合物,是当今灵芝研究的一个热点[3-5]。三萜类化合物具有抗肿瘤[6]、保肝排毒[7]、抗微生物、镇静、抗疲劳、耐缺氧等多种药理活性,但是确切的抗肿瘤活性作用机制尚不清楚,常规筛选和高通量筛选需要样品制备和比较高的成本,而通过分子对接发现药物的作用靶点简单而高效,对确定化合物的靶点具有提示作用。因此,本研究主要针对中药药效弱、多靶点的特点,基于计算机虚拟筛选和细胞活性筛选技术,从灵芝三萜类化合物中筛选抗肿瘤活性的天然配体和可能的作用靶点,为灵芝抗肿瘤作用靶点研究提供理论基础和参考。
1 材料
5种肿瘤细胞株,即肺癌细胞株H460、肝癌细胞株HepG2、胃癌细胞株BGC823、乳腺癌细胞株MDA-MB-231、结肠癌细胞株HCT116本实验室保存,传代培养。
灵芝三萜类化合物LZ1~LZ26,依次为灵芝酸A,B,灵芝烯酸A,B,灵芝酸C6,I,G,LM2,C2,C1,H,灵芝赤芝酸A,灵芝酸ε,M,AM1,J,灵芝烯酸G,赤芝酮B,D,F,灵芝烯酸H,灵芝酸AP3,Y,7-oxo-ganoderic acid Z, 7-oxo-ganoderic acid Z2和ganoderon B(也称作lucidadiol)。由中国医学科学院药物研究所植化室课题组从赤芝中以高效液相色谱分离得到[8],并鉴定结构,纯度≥98%。
RPMI 1640培养基购自Gibco公司,培养用胎牛血清(FCS,北京元亨圣马生物技术研究所),MTT,0.25%胰酶购自Solabio公司,其他试剂均为国产分析纯。所用溶液均用Milli Q水配制。酶标仪(Spectra Max190,美国MD公司)。
2 方法
2.1 小分子配体的准备 从Pubchem数据库下载本文研究的三萜类化合物结构,导入软件Discovery Studio 2016(DS2016)中。对于网站上不能查到的化合物,应用画图软件ChemDraw Ultra 7.0画出其结构,直接拷贝到DS中。考虑到配體对映异构体等因素,采用DS中的Prepare Ligand处理该体系,通过此操作不仅可以对小分子的构象进行能量优化处理,产生三维结构,加氢,还可以产生异构体,26种三萜类化合物如此处理后产生81种用于对接的配体分子。
2.2 蛋白文件的处理 本文所用蛋白见表1,其晶体结构均源自Brookhaven(布鲁克海文)蛋白质数据库。使用DS2016软件对这些蛋白进行除去水分子、去除蛋白多构象、补充非完整的氨基酸残基、添加极性氢处理,最后给蛋白施加CHARMm力场得到用于对接的蛋白。
2.3 分子对接 以灵芝三萜类化合物为配体,以11个抗肿瘤作用的靶点为受体,利用DS2016软件的LibDock模块进行分子对接,对接的结果以打分函数Libdock Score给出。Libdock Score越高,预测小分子与受体结合的活性越高。另外通过DS2016软件分析得到配体与受体的氢键数,找到对配体结合有重要贡献的氨基酸残基。
2.4 细胞毒活性实验 对26种三萜类化合物的抗肿瘤活性试验在肺癌细胞株H460、肝癌细胞株HepG2、胃癌细胞株BGC823、乳腺癌细胞株MDA-MB-231、结肠癌细胞株HCT116共5种细胞株上进行。将肿瘤细胞的细胞悬液按一定浓度接种于96孔培养板,置于37 ℃ 5%CO2培养箱培养24 h。加 入待测化合物的工作液,其终浓度为0.1,1,10,100 μmol·L-1(每个浓度4个复孔)。作用72 h后弃去
培养液,每孔加入100 μL含0.5 g·L-1MTT的培养基。置于培养箱继续培养4 h后弃液,每孔加入DMSO 150 μL,震摇10 min,使蓝色结晶完全溶解,以检测波长570 nm、参考波长655 nm于酶标仪测定每孔吸收值,计算IC50。
3 结果
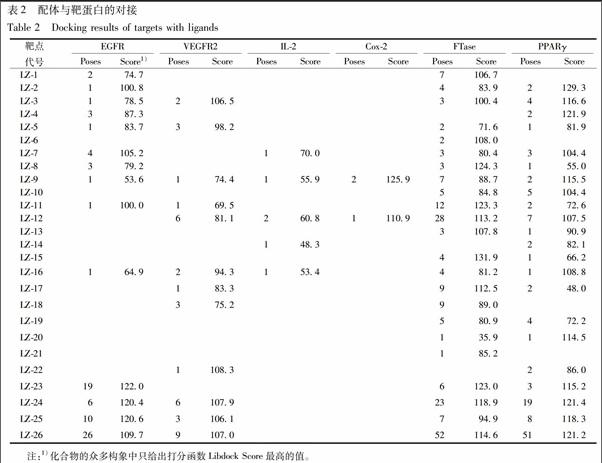
3.1 三萜化合物与靶点蛋白的对接 三萜化合物配体和靶点蛋白对接完成后产生对接位点数目(poses)和对接的得分(Libdock Score)。由对接结果可知,26种三萜类化合物与5种靶蛋白Bcl-x1, TNF-α, CDK2, FAK, PD-1均不能对接上,能与IL-2对接上的化合物很少且得分很低,只有灵芝酸C2和灵芝赤芝酸A 2种化合物能够与Cox-2对接上,且得分比较高,但是对接位点数目很少。具体的分子对接结果见表2。
DS2016软件的对接结果表明,对接位置数目大于5,且对接得分高于100的灵芝三萜类化合物有8种,LZ-1,11,12,17,23~26,对接效果好的这些三萜类化合物可能具有抗肿瘤活性,其中LZ-12,23~26这5种三萜类化合物可能存在多靶点作用。
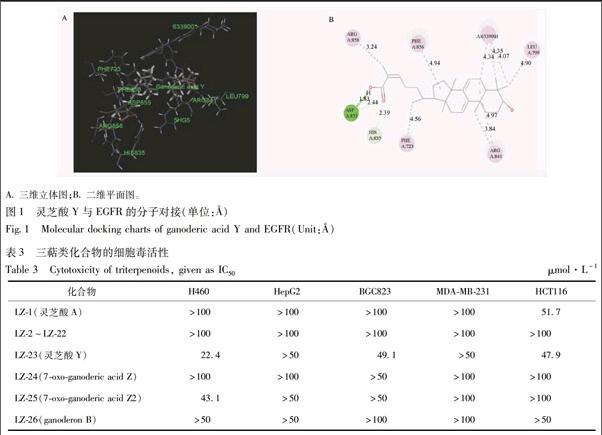
尤其以灵芝酸Y(LZ-23)与EGFR的对接效果最好,因此对其作进一步分析。灵芝酸Y与EGFR的分子对接效果见图1。由二维平面图1B可知,灵芝酸Y侧链羧基上的羟基与Asp855残基存在明显的氢键作用,氢键距离为1.83,灵芝酸Y侧链羧基上的羰基氧原子也与Asp855,His835 2个残基之间具有明显的相互作用,推测共轭双键的存在促进化合物与周围氨基酸形成氢键和其他相互作用。灵芝酸Y还与残基Phe723,Phe856分别形成了π键-烷基化作用。另外,灵芝酸Y处于Arg841,Phe723,Arg858,Phe856,Leu799等氨基酸残基的包围之中,存在多个烷基化作用,推断可能是因为这些残基与配体的相互作用增强了配体与受体的结合能力,从而使该配体化合物的活性提高。
3.2 细胞毒活性实验 26种灵芝三萜类化合物对实验测试的5种肿瘤细胞株的IC50列于表3。实验结果显示,26种化合物单体对5种被测肿瘤细胞株的抑制作用显著不同。灵芝酸A,灵芝酸Y,7-oxo-ganoderic acid Z,7-oxo-ganoderic acid Z2和ganoderon B表现出细胞毒活性,其中灵芝酸A只对HCT116细胞株表现出弱活性;灵芝酸Y对 肿瘤细胞H460,BGC823,HCT116具有一定的抑制活性,7-oxo-ganoderic acid Z2对H460有一定的抑制活性(IC50<50 μmol·L-1);尤其灵芝酸Y对肺癌细胞株H460的细胞毒活性最强,IC50为22.4 μmol·L-1。而其他化合物对所有被测细胞株都没有表现出细胞毒活性(IC50>100 μmol·L-1)。
4 讨论
针对中药抗肿瘤治疗体现出药效弱、多靶点作用的特点,本文对灵芝三萜成分的抗肿瘤作用进行了多靶点的计算机虚拟筛选和MTT法体外筛选两方面的研究。
对接结果显示,ganoderon B和7-oxo-ganoderic acid Z可以与EGFR, VEGFR2, FTase, PPARγ 4个靶蛋白的多个位点能够对接上,且对接位置的数目大于5,对接打分高于100,7-oxo-ganoderic acid Z2的对接情况与之相似,推断这3种化合物可能会与这4个靶点作用,因此,细胞水平表现出弱活性的试验结果,文献[9]研究结果显示,7-oxo-ganoderic acid Z对HepG2的LC50为22.08 μmol·L-1,这些是相符的。而灵芝酸Y与EGFR靶点对接良好,对接位置的数目多达19,得分高达122.02,与PPARγ和FTase 2个靶点对接稍弱些,MTT实验结果灵芝酸Y却表现出比较强的细胞毒活性,推测灵芝酸Y的作用靶点可能是EGFR, PPARγ或FTase。但是灵芝酸A, H, 灵芝烯酸G与FTase的对接位置数目和对接打分比较高,灵芝赤芝酸A与FTase和PPARγ的對接也比较好,但是它们几乎没有表现出细胞毒活性,原因可能是测定细胞的这种受体表达不高所致。据此,可以推断灵芝酸Y对H460的作用靶点可能主要是EGFR,而灵芝酸A, H, 灵芝烯酸G的作用靶点可能是FTase,可以通过进一步的实验来证明确切的作用靶点。
Chen Chun-Ru等[6]对从赤芝子实体中分离到的46个三萜成分的细胞毒活性进行了评价,结果显示lucidadiol对海拉癌细胞株有很强的细胞毒活性,其IC50为5 μmol·L-1。而本实验ganoderon B对肿瘤细胞株显示弱的细胞毒活性,这可能是因为不同的肿瘤细胞的敏感度和受体表达不同导致的。
灵芝赤芝酸A与PPARγ和FTase 2个靶点的对接位置数目大于5,对接得分高于100,但是细胞实验结果却没有表现出细胞毒活性,对此,还需要其他的实验加以验证。
而其他三萜化合物对接结果显示结合弱,体外5种细胞的MTT实验结果也没有显示活性,2种方法的结果相吻合。事实上,文献[10]研究结果也表明,三萜化合物灵芝酸A、灵芝酸B、灵芝酸I、灵芝酸G、灵芝酸H基本没有细胞毒活性或者活性很弱,其中灵芝酸B对HepG2的IC50为0.65 g·L-1,相当于1.258 mmol·L-1,灵芝酸I对HepG2的IC50为0.26 g·L-1,相当于0.488 mmol·L-1,结果是相符的。
从结构上看,化合物灵芝酸Y、7-oxo-ganoderic acid Z和7-oxo-ganoderic acid Z2的侧链上含有共轭双键,结果表现出一定的生物活性,ganoderon B侧链上含有一个不共轭的双键,其活性相对弱一些,而其他22种三萜化合物不具备这种结构,也几乎没有表现出细胞毒活性,见图2。因此,推测灵芝三萜结构中侧链上与羧基共轭的双键可能是活性基团,对化合物活性贡献比较大。
灵芝酸Y活性最好,主要是其结构除了侧链含有共轭双键活性基团外,母核上还含有一对共轭烯键,使得灵芝酸Y分子与靶点蛋白氨基酸残基易于形成了π键-烷基化作用,见图1,从而表现出比较好的活性。
综上,通过分子对接可以预测化合物的作用靶点,初步筛选活性化合物,利用细胞毒活性实验进一步验证化合物活性,为灵芝三萜化合物的抗肿瘤研究提供理论依据。
5 结论
26种灵芝三萜类化合物在同一种细胞株上表现出显著不同的抑制作用,这与化合物的结构有关,侧链上的双键,尤其是共轭双键是活性基团,能够使得侧链羧基容易与氨基酸残基形成氢键,从而表现出比较强的活性。
通过计算机虚拟筛选和体外细胞毒活性测试发现灵芝酸Y对肺癌细胞H460表现出较强的细胞毒活性,是本研究初步筛选出的比较有潜力的抗肿瘤化合物。但是三萜成分抗肿瘤机制复杂,有待于进一步深入研究。
[参考文献]
[1]Patel S, Goyal A. Recent developments in mushrooms as anti-cancer therapeutics: a review[J]. Biotech, 2012, 2:1.
[2]Martinez-Montemayor M M, Acevedo R R, Otero-Franqui E, et al. Ganoderma lucidum (Reishi) inhibits cancer cell growth and expression of key molecules in inflammatory breast cancer[J]. Nutr Cancer, 2011, 63(7):1085.
[3]Yadav V R, Prasad S, Sung B, et al. Targeting inflammatory pathways by triterpenoids for prevention and treatment of cancer[J]. Toxins, 2010, 2:2428.
[4]Zhao Z Z, Yin R H, Chen H P, et al. Two new triterpenoids from fruiting bodies of fungus Ganoderma lucidum[J]. J Asian Nat Prod Res, 2015, 17(7):750.
[5]Li P, Deng Y P, Wei X X, et al. Triterpenoids from Ganoderma lucidum and their cytotoxic activities[J]. Nat Prod Res, 2013, 27(1):17.
[6]Cheng C R, Yue Q X, Wu Z Y, et al. Cytotoxic triterpenoids from Ganoderma lucidum[J]. Phytochemistry, 2010, 71(13): 1579.
[7]Wang M Y, Liu Q, Chen Q M. Effects of triterpenoids from Ganoderma lucidum (Leyss. Ex Fr.) karst on tree different experimental liver injury models in mice[J]. Acta Pharm Sin, 2000, 35(5): 326.
[8]李保明,古海鋒,李晔,等. HPLC测定不同产地灵芝中9种三萜酸[J]. 中国中药杂志,2012,37(23):3599.
[9]Ruan W, Wei Y, Popovich D G. Distinct responses of cytotoxic Ganoderma lucidum triterpenoids in human carcinoma cells[J]. Phytother Res, 2015, 29(11):1744.
[10]Ruan W, Lim A H, Huang L G, et al. Extraction optimization and isolation of triterpenoids from Ganoderma lucidum and their effect on human carcinoma cell growth[J]. Nat Prod Res, 2014, 28(24):2264.
[责任编辑 丁广治]
