基于网络药理学探讨小青龙汤治疗慢性阻塞性肺疾病的作用机制
2021-01-13张平安高娜陈明哲张莹雪李奕璇吴建军
张平安 高娜 陈明哲 张莹雪 李奕璇 吴建军

摘要 目的:利用网络药理学分析小青龙汤治疗慢性阻塞性肺疾病(COPD)的作用机制。方法:在中药系统药理学数据库与分析平台(TCMSP)检索小青龙汤药物活性成分和靶点,绘制中药-化合物-靶基因网络,筛选关键化合物;利用GeneCards和人类孟德尔遗传数据库(OMIM)搜索COPD疾病基因;绘制韦恩图并获取药物-疾病共同基因;利用小青龙汤-慢阻肺药物疾病共同基因绘制蛋白质-蛋白质相互作用(PPI)网络,根据网络关系选择核心基因;对核心基因分别进行基因本体(GO)功能注释和富集分析和京都基因和基因组百科全书(KEGG)通路富集分析。结果:挖掘得到小青龙汤中药活性成分137个,潜在作用靶点188个,慢性阻塞性肺疾病相关靶点6 949个,小青龙汤-COPD共同靶点160个,主要富集于92个生物过程和49条信号通路上。结论:小青龙汤中多个药物含有山柰酚、槲皮素、(+)-儿茶素、豆甾醇、β-谷固醇等成分,可作用于AKT1、IL6、MAPK1、PTGS2、TP53等核心基因,调控氧化应激反应、血小板α-颗粒等生物过程,参与HIF-1、PI3K-AKT信号通路的调节,干预氧化应激反应和炎症反应等过程,产生抑制炎症反应、抗氧化应激的作用,进而通过上述过程参与COPD的炎症反应与氧化应激过程。
关键词 网络药理学;小青龙汤;慢性阻塞性肺疾病;靶基因;GO功能注释;KEGG通路富集分析;炎症反应;氧化应激
Abstract Objective:to analyze the mechanism of Xiaoqinglong Decoction in the treatment of chronic obstructive pulmonary disease(COPD) by network pharmacology.Methods:the active ingredients and targets of Xiaoqinglong Decoction were searched in TCMSP database platform,and the traditional Chinese medicine compound target gene network was drawn to screen the key compounds; the COPD disease genes were searched by genecards and OMIM database; the Wayne map was drawn to obtain the drug disease common gene; the PPI protein interaction network was drawn by Xiaoqinglong Decoction COPD drug disease common gene Go functional annotation and KEGG pathway enrichment analysis were performed on the core genes.Results:137 active components of Xiaoqinglong decoction,188 potential targets,6949 targets related to COPD and 160 common targets of Xiaoqinglong Decoction COPD were obtained,which were mainly enriched in 92 biological processes and 49 signal pathways.Conclusion:Many drugs in Xiaoqinglong Decoction contain kaempferol,quercetin,(+)-catechin,stigmasterol,β-sitosterol and other components,which can act on AKT1,IL6,mapk1,PTGS2,TP53 and other core genes,regulate oxidative stress response,platelet α-granule and other biological processes,participate in the regulation of HIF-1,PI3K Akt signaling pathway,intervene in oxidative stress response and inflammatory response,and produce high yield Through the above process,it participates in the inflammatory reaction and oxidative stress process of COPD.
Keywords Network pharmacology; Xiaoqinglong Decoction; Chronic obstructive pulmonary disease; Target gene; Go function annotation; KEGG pathway enrichment analysis; Inflammatory response; Oxidative stress
中圖分类号:R285文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.24.003
慢性阻塞性肺疾病(Chronic Obstructive Pulmoriary Disease,COPD)又称慢阻肺,是一种持续存在的慢性气道炎症疾病,以反复出现的呼吸道症状和不可逆转的气流受限为特征,发作期外周气道和肺实质的中性粒细胞和巨噬细胞以及包括Tc1和ILC3淋巴细胞等炎症细胞的数量明显增加,其释放的诸多炎症介质也与疾病密切相关[1]。有研究证明持续的气道与全身炎症反应与COPD明显相关,可以通过趋化因子、免疫细胞的表达水平来预测COPD的急性加重及预后[2]。COPD以其逐年升高的发病率,正逐渐成为影响人们健康的慢性疾病。2017全球疾病负担指出,累计至2017年全球COPD患者已达3亿人,其中从2007到2017增长了24.9%[3]。
COPD在中医属于“肺胀”“喘证”。《灵枢·经脉第十》指出“肺手太阴之脉……是主肺所生病者,咳,上气喘喝”,认为喘证为肺气不能宣肃而引起。《类证治裁·喘证》提出“喘由外感者治肺,由内伤者治肾”,认为外感者郁闭肺气,内伤者肾气不衡,故当温肾以纳气,宣肺以复升降。《金匮要略》明确提出:“肺胀,咳而上气,……心下有水,小青龙加石膏汤主之。”认为肺胀的病机为外邪束肺,寒饮内停郁而化热,与肺失宣肃,肾阳不足相关。而小青龙汤出自汉代张仲景的《伤寒论》“伤寒表不解,心下有水气,干呕发热而咳,……少腹满或喘者,小青龙汤主之”[4]。小青龙汤针对外寒内饮的病机而设,患者多为素体阳气不足寒饮内停,又遇寒邪外束,肺气郁闭而成外寒内饮证。有研究证明小青龙汤可广泛用于表现为外寒内饮、痰湿(饮)伏肺者的COPD,症见咳嗽、咳痰、咳吐痰涎或泡沫样痰,甚或喘息、气短、胸闷、憋气,或见发热、恶寒、小便不利者,舌苔白滑、脉弦滑或浮紧[5]。
临床上对于COPD的治疗常给予支气管扩张剂、β受体激动剂联合糖皮质激素以抑制气道重塑,改善预后,但长期应用糖皮质激素存在引起感染等诸多不良反应。近年来网络药理学借助大量的网络数据库资源,在临床和实验的研究中不断得到应用。通过利用系统生物学的优势,构建药物-靶点-疾病的整体网络关系,针对中药的微观药理来调控基因的表达以阐释药物多途径、多靶点治疗疾病的调节机制,符合中医的整体观念的理论[6]。故本研究拟从网络药理学的角度,研究小青龙汤治疗COPD的作用机制,为进一步研究小青龙汤提供思路。
1 资料与方法
1.1 筛选小青龙汤的活性成分和靶基因 在中药系统药理学数据库与分析平台(TCMSP,http://ibts.hkbu.edu.hk/LSP/tcmsp.php)中筛选出小青龙汤中药中的活性成分,活性成分的筛选条件为口服生物利用度(OB)≥30%,类药性(DL)≥0.18;然后查阅文献,去除无对应靶点的成分,得到对应靶基因,然后利用UniProt数据库将靶基因进行标准化。
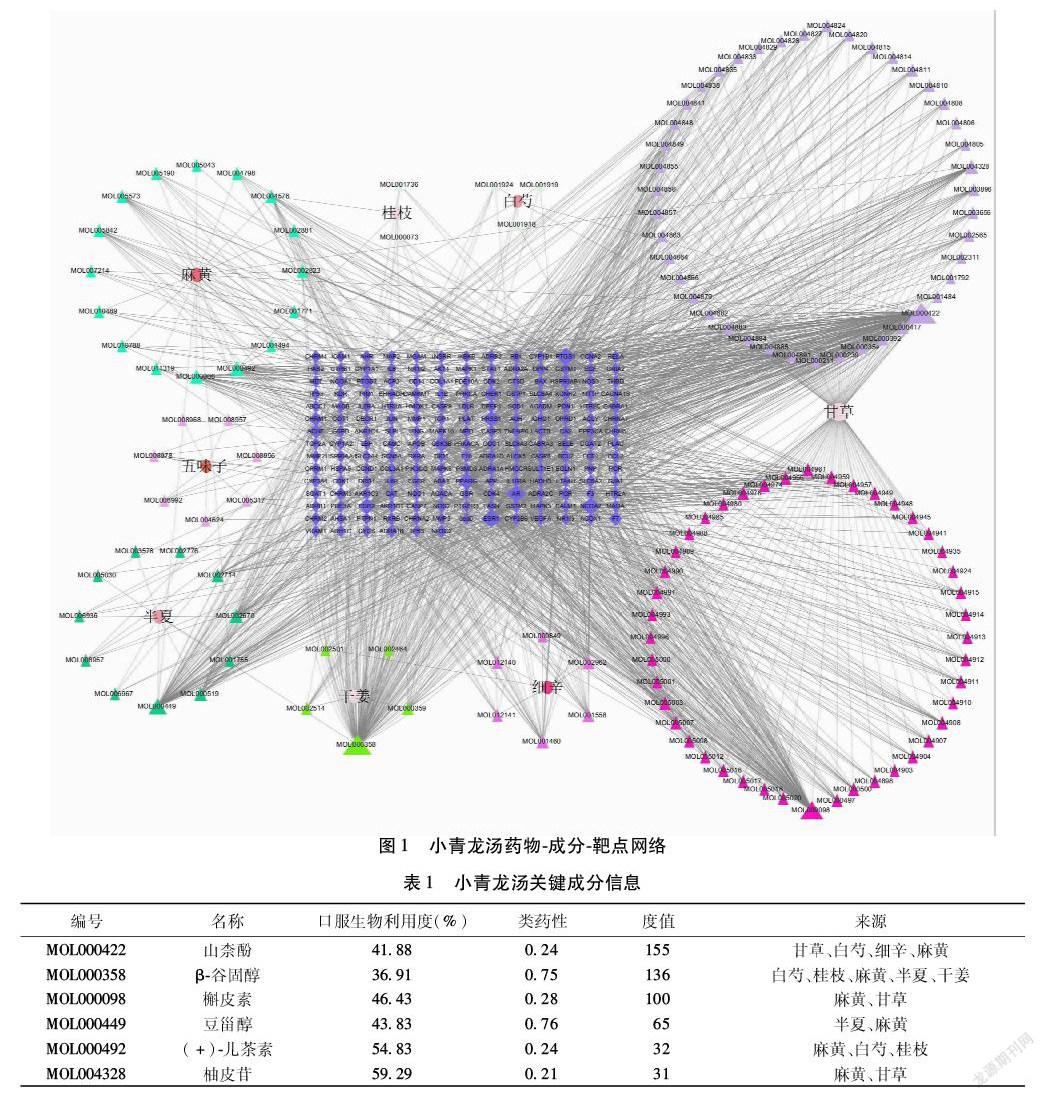
1.2 制作小青龙汤中药-化合物-靶基因网络 利用筛选出的活性成分和靶基因在Cytoscape 3.7.2软件上绘制小青龙汤药物-成分-靶基因网络,获得Network Analyzer数据,筛选Degree值选择关键成分。
1.3 获取COPD相关基因,得到小青龙汤-COPD疾病共同基因 以“Chronic Obstructive Pulmonary”为关键词,在基因数据库GeneCards(https://www.genecards.org)、人類孟德尔遗传数据库(OMIM)(https://www.omim.org)中检索与COPD疾病有关的基因,取并集然后与小青龙汤药物基因在Venny2.1网站上(https://bioinfogp.cnb.csic.es/tools/venny/index.html)绘制韦恩图,得到药物-疾病共同基因。
1.4 制作蛋白质-蛋白质相互作用(PPI)网络,进行网络拓扑分析,得到药物疾病核心基因 利用药物-疾病共同基因在STRING(https://string-db.org/)平台上构建蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络,选择蛋白属种“Homo Sapiens”,最低相互作用阈值“Medium Confidence”为0.4,进而设置其他默认参数。为选择核心基因利用CytoNCA进行网络拓扑分析,筛选分析结果中度中心性DC、介度中心性BC、接近中心性CC、特征向量中心性EC、局部边连通性LAC等数值,选Degree值2倍中位值,其他选中位值进行筛选,获取药物-疾病核心基因。
1.5 进行基因本体(GO)富集分析和京都基因和基因组百科全书(KEGG)通路富集分析 通过R 4.0.2软件将小青龙汤-COPD核心基因进行GO基因功能注释BP、CC、MF(生物过程、细胞组分、分子功能)和KEGG通路富集分析。根据GO富集结果,选取q-value值<0.05,富集基因个数BP≥4个,CC≥2个,MF≥2个,共184个生物过程,KEGG富集结果根据q-value值<0.05,富集基因数≥4个,共49条通路。其中针对GO 3个过程选取前10个,KEGG选取前30个绘制柱状图。
2 结果
2.1 小青龙汤活性成分筛选结果 得到小青龙汤活性成分共137个,对应靶蛋白基因188个。活性成分中白芍3个,桂枝2个,五味子7个,细辛6个,麻黄16个,半夏11个,干姜5个,甘草87个。
2.2 中药-成分-靶点网络 通过Cytoscape 3.7.2绘制中药-成分-靶点网络。见图1。根据Degree值选取小青龙汤关键成分,如山柰酚、β-谷固醇、槲皮素、豆甾醇、(+)-儿茶素、柚皮苷等主要成分,其中山柰酚为甘草、白芍、细辛、麻黄的共有成分;β-谷固醇为白芍、桂枝、麻黄、半夏、干姜的共有成分;槲皮素、柚皮苷是麻黄、甘草的共有成分;豆甾醇是半夏、麻黄的共有成分;(+)-儿茶素是麻黄、白芍、桂枝的共有成分。见表1。
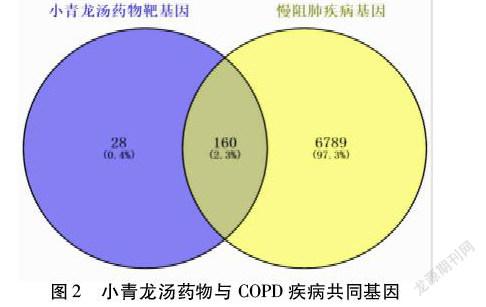
2.3 COPD疾病基因靶点、药物-疾病共同基因 经过GeneCards数据库和OMIM数据库搜索得到COPD疾病相关基因并删除重复基因得到6 949个疾病基因,疾病基因与药物基因利用Venny2.1平台绘制韦恩图,得到小青龙汤药物与COPD疾病共同基因160个。见图2。
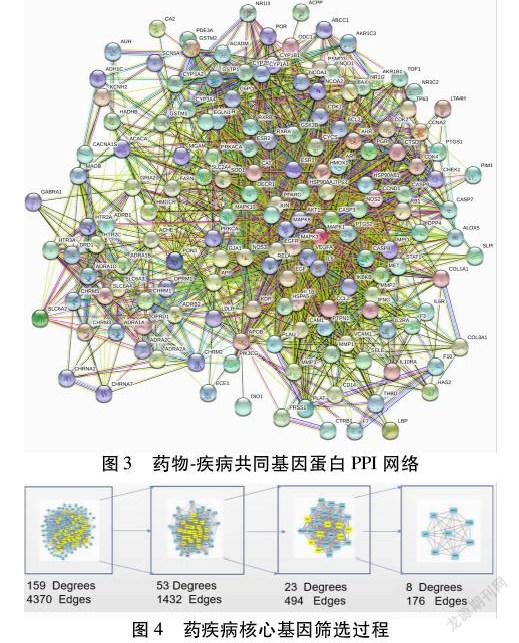
2.4 PPI网络和药物-疾病核心基因 通过STRING平台得到PPI蛋白网络。利用CytoNCA进行网络拓扑分析,根据筛选条件,得到AKT1(AKT丝氨酸/苏氨酸激酶1)、JUN(AP-1转录因子亚单位)、EGF、IL6(白细胞介素6受体)、VEGFA(血管内皮生长因子A)、MAPK1(丝裂原活化蛋白激酶1)、PTGS2(前列腺素内过氧化物合酶2)、TP53(肿瘤蛋白P53)等核心基因,可知小青龙汤通过这些核心基因发挥作用。见图3~4。
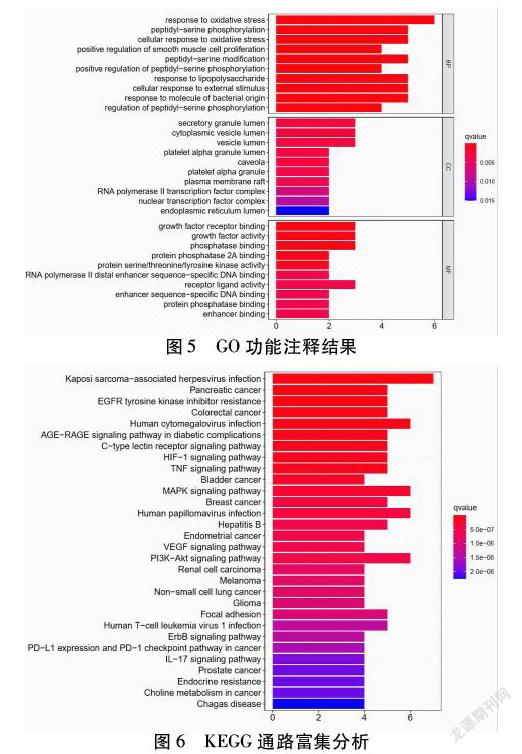
2.5 GO功能注释结果 小青龙汤-COPD核心基因在R 4.0.2上GO功能注释结果得到生物过程57个,细胞组分35个,分子功能92个,共184个生物过程。涉及氧化应激反应(Response To Oxidative Stress)、细胞对氧化应激的反应(Cellular Response To Oxidative Stress)、分泌颗粒腔(Secretory Granule Lumen)、血小板α顆粒(Platelet Alpha Granule)、丝氨酸/苏氨酸/酪氨酸激酶活性(Protein Serine/Threonine/Tyrosine Kinase Activity)等生物过程。见表2。
2.6 KEGG通路富集分析结果 小青龙汤-COPD核心基因在R 4.0.2上KEGG通路富集分析结果得出核心基因主要富集在HIF-1信号通路(HIF-1 Signaling Pathway)、PI3K-AKT信号通路(PI3K-AKT Signaling Pathway)、肿瘤坏死因子信号通路(TNF Signaling Pathway)、MAPK信号通路(MAPK Signaling Pathway)、血管内皮生长因子信号通路(VEGF Signaling Pathway)等通路。见图5~6,表2。
3 讨论
3.1 COPD发病机制 炎症和氧化应激反应机制仍被认为是COPD的重要发病机制,而蛋白酶-抗蛋白酶失衡则与气道重塑相关。炎症机制主要引起气道、肺实质和肺血管的慢性炎症改变;氧化应激不但可以导致细胞功能障碍,诱导细胞凋亡,还可以引起蛋白酶-抗蛋白酶失活,促进炎症反应。相关研究显示,COPD的发病机制以气道炎症为核心,以线粒体功能障碍、上皮-间充质转化、氧化应激、铁离子代谢和基因多态性有关,参与COPD的肺泡破坏,肺功能的下降以及COPD的加重[7]。因此有关气道炎症与氧化应激的研究对研发治疗COPD的药物有重要意义。
3.2 小青龙汤关键药物成分作用机制分析 通过小青龙汤中药-成分-靶点网络的分析得到小青龙汤的关键化学成分为山柰酚、β-谷固醇、槲皮素、豆甾醇、(+)-儿茶素、柚皮苷。有研究证明山柰酚通过调节促炎酶的活性和炎症相关基因表达,抑制转录因子、黏附分子以及基质金属蛋白酶发挥抗炎作用[7]。其抗炎作用的发挥与MAPK、PI3K和Janus激酶/信号转导及转录激活通路有关,通过降低巨噬细胞衍生趋化因子、干扰素诱导蛋白-10、白细胞介素-8等炎症介质的释放,发挥抗炎作用[9]。山柰酚还可以显著抑制还原型辅酶Ⅱ或Fe2+诱导的脂质微粒系统中的脂质过氧化,发挥抗氧化应激的作用[10]。有研究证明槲皮素显著抑制缺氧诱导的人肝癌Hep G2细胞的上皮-间质转化,其机制可能通过槲皮素抑制缺氧诱导的人肝癌细胞中HIF-1α蛋白的累积发挥抗氧化、抗肿瘤作用[11]。(+)-儿茶素具有抑制脂质过氧化及DNA氧化损伤,调控细胞活性氧与胞内蛋白质表达及细胞因子水平,发挥抗氧化、抗肿瘤作用[12]。有研究证明豆甾醇通过增加过氧化氢酶、超氧化物歧化酶、谷胱甘肽的活性发挥抗氧化作用;抑制环氧化酶-2、诱生型一氧化氮合酶的表达发挥抗炎作用[13]。可知小青龙汤可能通过以上药物成分发挥抗氧化、抗炎症的作用。
3.3 预测小青龙汤治疗COPD的靶点 由网络分析得出小青龙汤作用于COPD的核心基因可能为AKT丝氨酸/苏氨酸激酶1、白细胞介素6受体、血管内皮生长因子A、丝裂原活化蛋白激酶1、前列腺素内过氧化物合酶2、肿瘤蛋白P53。IL-6是IL-1和少量TNF-α介导的单核细胞、吞噬细胞、血管内皮细胞、成纤维细胞炎症反应的多效性细胞因子[14]。有研究证明IL-6可以促进B细胞增殖分化和分泌抗体;诱导炎症反应,引起机体发热、白细胞增多、血管通透性增高而参与炎症反应[15]。前列腺素内过氧化物酶又称环氧合酶(COX),COX-2是目前发现的哺乳动物中含有的一种环氧合酶同工酶,而多种来源于细胞内外的刺激因子如白细胞介素-1(IL-1)、脂多糖(LPS)、肿瘤坏死因子(TNF)、以及活性氧中间产物可以在成纤维细胞、内皮细胞、巨噬细胞内诱导COX-2的表达,增强活性氧的损伤[16]。有研究证明花生四烯酸的代谢产物前列环素能够通过环氧合酶途径而引起缺氧条件下的缺氧性肺血管收缩,加重缺氧的状态[17]。有研究已证实p38 MAPK信号通路在肺部疾病中发挥的重要作用是通过炎症反应、肿瘤侵袭等途径来实现的[18]。丝裂原活化蛋白激酶(MAPK)可以被多种刺激如细胞因子、生长因子、各种应激作用于MAPK中的苏氨酸和酪氨酸残基磷酸化而活化,研究发现p38 MAPK在COPD和哮喘的发病过程中与气道重塑相关,气道平滑肌细胞p38 MAPK的明显活化与香烟提取物的刺激密切相关,抑制p38 MAPK的活化可以缓解平滑肌细胞的增生而改善气道重塑[19]。由此可知小青龙汤可能通过白细胞介素6受体、丝裂原活化蛋白激酶1以及前列腺素内过氧化物合酶2等靶点,发挥抗炎、抗氧化应激的作用。
3.4 小青龙汤治疗COPD生物过程预测分析 通过GO功能注释结果分析得到核心基因主要富集于氧化应激反应、细胞对氧化应激的反应、分泌颗粒腔、血小板α颗粒、丝氨酸/苏氨酸/酪氨酸激酶活性等生物过程。机体在受到内外源性伤害因子刺激的情况下会发生氧化应激反应,自由基大量产生,并释放大量活性氧(ROS),在此过程中自身抗氧化能力下降而致使氧化与抗氧化能力的失衡[20]。有研究证明氧自由基及活性氧可以直接减弱黏膜功能和内皮细胞的黏附性,增强内皮渗透性,最终对气道上皮细胞造成直接损伤及炎症反应[21]。血小板除参与止血和血栓形成外,还具有调节机体炎症反应、创伤修复、免疫应答、血管生成和肿瘤转移等作用[22]。血小板α-颗粒含有的大量AngⅠ可以激活PI3K/AKT信号通路,抑制内皮细胞凋亡,维持血管壁完整性;抑制核因子κB的合成,抑制炎症反应;血小板激活后,α-颗粒脱颗粒,进而释放大量P-选择素,而抑制P-选择素可明显减少血栓形成及炎症细胞浸润[23]。由此可知小青龙汤可能通过以上生物过程发挥抗炎,抗氧化应激的作用。
3.5 小青龙汤治疗COPD疾病通路结果预测分析 KEGG通路富集分析结果显示,小青龙汤-COPD药物疾病核心基因主要富集在HIF-1、PI3K-AKT、肿瘤坏死因子、MAPK信号通路中。COPD患者因为通气功能障碍,弥散功能受损常常存在缺氧状态。Semenza等[24]在1992年研究促红细胞生成素基因表达的影响因素时,发现了缺氧诱导因子(HIF-1)存在于缺氧诱导的细胞核提取物中,并且与缺氧应激相关。在机体处于缺氧的情况下,HIF-1α可以大量聚集于胞质内而不被降解消耗。在机体处于缺氧的状态时,大量聚集的HIF-1α能够进入细胞核并且和HIF-1β逐步相结合,结果形成了活化并且可以抗蛋白酶水解的稳定型异源二聚体HIF-1[25]。此外活化的HIF-1会结合并激活缺氧反应元件(Hypoxia Response Element,HRE)这一特定的缺氧易感基因的HRE使其开始转录,进而继续调控下游靶基因的表达,以发挥介导细胞缺氧适应性反应的作用[26]。HIF-1还可以通过调控缺氧代偿性反应、新生血管的生成调节、免疫反应以及细胞外基质纤维化与能量代谢、物质运输等过程,使组织的缺氧耐受力不断增强,可以使机体更好地适应低氧环境的影响[27]。HIF-1抗细胞凋亡的作用还与PI-3K/AKT通路、MAPK信号通路有关。Jiang等[28]在研究COPD的发病机制时发现,HIF-1可以激活核因子κB信號通路以加速COPD的进展。另有研究证明PI3K-AKT信号通路可以通过激活磷酸化的蛋白激酶B(Protein Kinase B,AKT)发挥调控炎症细胞活化、炎症介质合成和释放、抗氧化反应等作用,最终诱导气道平滑肌增殖而引起气道重塑[29]。有研究证明抑制MAPK信号可以抑制细胞凋亡,抑制炎症反应,保护组织缺血/再灌注损伤[30]。由此可知小青龙汤正是通过上述通路发挥抗炎、抗氧化应激的作用。
综上所述,本研究通过网络药理学的研究发现小青龙汤治疗COPD的分子机制可能为:小青龙汤中多个药物含有山柰酚、槲皮素、(+)-儿茶素、豆甾醇、β-谷固醇等成分,可作用于AKT1、IL6、MAPK1、PTGS2、TP53等核心基因,调控氧化应激反应、血小板α-颗粒等生物过程,参与HIF-1、PI3K-AKT信号通路的调节,干预氧化应激反应和炎症反应等过程,产生抑制炎症反应、抗氧化应激的作用,进而通过上述过程参与COPD的炎症反应与氧化应激过程。其结果为进一步的实验验证提供了思路。
参考文献
[1]Polosukhin VV,Richmond BW,Du RH,et al.Secretory IgA deficiency in individual small airways is associated with persistent inflammation and remodeling[J].Am J Respir Crit Care Med,2017,195(8):1010-1021.
[2]李四香,赵爽,李为民.中性粒细胞与淋巴细胞比值在慢性阻塞性肺疾病中的应用研究进展[J].中国呼吸与危重监护杂志,2020,19(3):304-308.
[3]Collaborators GBDCRD.Global,regional,and national deaths,prevalence,disability-adjusted life years,and years lived with disability for chronic obstructive pulmonary disease and asthma,1990-2015:a systematic analysis for the Global Burden of Disease Study 2015[J].Lancet Respir Med,2017,5(9):691-706.
[4]张仲景.伤寒论[M].钱超尘,郝万山整理.北京:人民卫生出版社,2005:37.
[5]吴建军,李欣,秦阳,等.小青龙汤在慢性阻塞性肺疾病中的应用[J].中医杂志,2016,57(22):1925-1928.
[6]解静,高杉,李琳,等.网络药理学在中药领域中的研究进展与应用策略[J].中草药,2019,50(10):2257-2265.
[7]李锋,周新.慢性阻塞性肺疾病的发病机制研究进展[J].中国呼吸与危重监护杂志,2019,18(1):88.
[8]Devi KP,Malar DS,Nabavi SF,et al.Kaempferol and inflammation:From chemistry to medicine[J].Pharmacol Res,2015,99:1-10.
[9]张雅雯,邵东燕,师俊玲,等.山奈酚生物功能研究进展[J].生命科学,2017,29(4):400-405.
[10]Soucek P,Kondrova E,Hermanek J,et al.New model system for testing effects of flavonoids on doxorubicin-related formation of hydroxyl radicals[J].Anticancer Drugs,2011,22(2):176-184.
[11]李丝丝.槲皮素对缺氧诱导的人肝癌细胞上皮间质转化影响的初步研究[D].合肥:安徽医科大学,2017.
[12]涂云飞.活性氧关联的儿茶素生物活性研究进展[J].生命科学,2013,25(3):295-299.
[13]周志远,卢群,刘洋,等.豆甾醇的研究及开发进展[J].中国当代医药,2015,22(24):15-17.
[14]DeLong WG Jr,Born CT.Cytokines in patients with polytrauma[J].Clin Orthop Relat Res,2004(422):57-65.
[15]唐任光.白细胞介素-6及其受体与食管癌的关系研究进展[J].右江医学,2007,35(2):199-201.
[16]McCullough L,Wu L,Haughey N,et al.Neuroprotective function of the PGE2 EP2 receptor in cerebral ischemia[J].J Neurosci,2004,24(1):257-268.
[17]金咸.花生四烯酸与低氧性肺动脉高压[J].基础医学与临床,1996,16(1):26-30.
[18]李丹丹.p38丝裂原活化蛋白激酶在肺部疾病中的研究进展[J].复旦学报:医学版,2018,45(3):413-417.
[19]Vogel ER,VanOosten SK,Holman MA,et al.Cigarette smoke enhances proliferation and extracellular matrix deposition by human fetal airway smooth muscle[J].Am J Physiol Lung Cell Mol Physiol,2014,307(12):L978-986.
[20]劉琪,李文军,唐志红,等.藻蓝蛋白对氧化应激相关疾病防治作用的研究进展[J].海洋科学,2017,41(10):132-138.
[21]Rennard SI.Inflammation and repair processes in chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,1999,160(5 Pt 2):S12-16.
[22]王艳.脓毒症患者预后相关生物标志物研究进展[J].中华实用诊断与治疗杂志,2014,28(8):737-739.
[23]李晓兰,张媛莉,邵义明.血小板α-颗粒在脓毒症中作用的研究进展[J].中华实用诊断与治疗杂志,2018,32(7):715-717.
[24]Semenza GL,Wang GL.A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation[J].Mol Cell Biol,1992,12(12):5447-5454.
[25]李昭,王学彬.缺氧诱导因子-1α在风湿性疾病中的研究进展[J].中华风湿病学杂志,2018,22(1):54-57.
[26]Wu D,Potluri N,Lu J,et al.Structural integration in hypoxia-inducible factors[J].Nature,2015,524(7565):303-308.
[27]Semenza GL.Oxygen sensing,hypoxia-inducible factors,and disease pathophysiology[J].Annu Rev Pathol,2014,9:47-71.
[28]Jiang H,Zhu Y,Xu H,et al.Activation of hypoxia-inducible factor-1alpha via nuclear factor-kappa B in rats with chronic obstructive pulmonary disease[J].Acta Biochim Biophys Sin(Shanghai),2010,42(7):483-488.
[29]Dinavahi SS,Nyayapathy S,Perumal Y,et al.Combined inhibition of PDE4 and PI3Kδ modulates the inflammatory component involved in the progression of chronic obstructive pulmonary disease[J].Drug Res(Stuttg),2014,64(4):214-219.
[30]庞会婷,罗朵生,郭姣.三七化学成分分析及其抗炎机制的网络药理学探讨[J].中草药,2020,51(21):5538-5547.
(2020-12-16收稿 责任编辑:魏庆双)
