miR-556-3p通过靶基因SASH1调控子宫内膜癌细胞的活力、迁移和侵袭*
2021-01-06吴园园
梁 磊,杨 波,吴园园,孙 莉
(中国人民解放军联勤保障部队第九八〇医院妇产科,河北石家庄 050082)
子宫内膜癌是最常见的妇科恶性肿瘤之一,全世界2018 年估计有38 万例新病例,9 万例死亡病例[1]。子宫内膜癌的5 年相对存活率约为82%,但在过去的几十年中,子宫内膜癌的发病率和死亡率都有所增加,晚期子宫内膜癌仍缺乏有效的治疗方法[2-3]。微小RNA(microRNA,miRNA,miR)是小的非编码RNA 分子,大约为22 个核苷酸,通过与相应mRNA 靶标的3´-非翻译区(3´-untranslated region,3´UTR)结合,导致mRNA降解和翻译抑制,从而对基因调节起重要的作用。miRNA 参与增殖、转移、凋亡等多种生物学过程。先前的研究发现,差异表达的miRNA 如miR-135a[4]、miR-320a、miR-340-5p[5]和miR-27a-5p[6]可能与子宫内膜癌的进展有关。研究表明,miR-556-3p在食管癌组织中上调表达,过表达miR-556-3p 促进食管癌细胞的增殖和侵袭[7]。SASH1(SAM and SH3 domain-containing 1)在宫颈癌[8]和胃癌[9]组织中的表达下调,可作为宫颈癌和胃癌患者的独立预后因素。miR-128 通过靶向下调SASH1 的表达促进了骨肉瘤细胞增殖,抑制了细胞凋亡[10]。但miR-556-3p和SASH1在子宫内膜癌组织中的表达及其对子宫内膜癌细胞活力、迁移和侵袭的影响,且二者是否存在靶向关系目前知之甚少。因此,本研究考察miR-556-3p 对子宫内膜癌细胞活力、迁移和侵袭的影响,以及对SASH1 的靶向调控,以期为子宫内膜癌靶向治疗提供参考。
材料和方法
1 临床组织标本
2015 年4 月~2017 年12 月在本院收集子宫内膜癌和癌旁组织35 例。所有子宫内膜癌样品均从进行子宫切除术的患者中收集,其中,子宫内膜癌患者经病理学确诊,且术前未接受过放、化疗,术前3 个月内未进行过激素治疗。此项研究获得所有参与者的知情同意,医院伦理委员会予以批准通过。每例样本离体后,保存于液氮中,用于RT-qPCR分析。
2 细胞与主要试剂
子宫内膜癌Ishikawa 细胞购自ATCC。DMEM培养基和胎牛血清(fetal bovine serum,FBS)均购自Gibco;Lipofectamine 2000 和Trizol 试剂均购自Invit⁃rogen;MTT 和二甲基亚砜(dimethylsulfoxide,DMSO)均购自Sigma-Aldrich;cDNA 反转录试剂盒(Thermo Fisher Scientific);RIPA 裂解缓冲液、兔抗SASH1 抗体、兔抗细胞周期蛋白D1(cyclin D1)抗体、兔抗p21 抗体、兔抗基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)抗体、兔抗基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)抗体和辣根过氧化物酶偶联的II 抗均购自Abcam;增强型化学发光试剂购自Pierce;Dual-Luciferase Reporter As⁃say System购自Promega。
3 方法
3.1 细胞培养、分组与转染 Ishikawa 细胞在DMEM 培养基中培养,该培养基含有10% FBS、1×105U/L青霉素和100 mg/L链霉素。将子宫内膜癌细胞在37 ℃的含5%CO2的潮湿培养箱中培养。选取对数生长期的细胞用于实验。将细胞分为anti-miR-556-3p 组(转染anti-miR-556-3p)、anti-miR-NC 组(转染阴性对照anti-miR-NC)、pcDNA-SASH1 组(转染pcDNA-SASH1)、pcDNA 组(转染阴性对照pcDNA 3.1)、miR-556-3p 组(转染miR-556-3p)、miR-NC 组(转染阴性对照miR-NC)、anti-miR-556-3p+si-NC 组(共转染anti-miR-556-3p 和阴性对照si-NC)和antimiR-556-3p+si-SASH1 组(共转染anti-miR-556-3p 和si-SASH1)。转染时,使用胰蛋白酶消化并计数细胞。将Ishikawa 细胞以每孔2×105接种到6 孔板中,培养24 h。当细胞融合度达到80%时,根据制造商的说明,使用Lipofectamine 2000进行转染。Ishikawa细胞在转染培养基中于37℃、5% CO2环境中生长6 h,然后在新鲜培养基中培养以进行进一步的分析。anti-miR-556-3p、miR-556-3p、si-SASH1 和pcDNASASH1 及各自阴性对照anti-miR-NC、miR-NC、si-NC和pcDNA 3.1均获自RiboBio。
3.2 RT-qPCR 检测子宫内膜癌组织、癌旁组织和Ishikawa 细胞中miR-556-3p 和SASH1 mRNA 的 表达 使用TRIzol 试剂提取子宫内膜癌组织、癌旁组织或转染后Ishikawa 细胞的总RNA;使用cDNA 反转录试剂盒,根据制造商的说明,将总RNA(1 μg)合成互补的cDNA 模板;使用RT-qPCR 测定miR-556-3p和SASH1 mRNA 的表达水平。U6 和GAPDH 用作内参照。miR-556-3p 的正向引物序列为5′-GGGGTG⁃TAAACATCCTCGACTG-3′,反向引物序列为5′-ATTGCGTGTCGTGGAGTCG-3′;U6的正向引物序列为5′-GCTTCGGCAGCACATATACTAAAAT-3′,反向引物序列为5′-CGCTTCAGAATTTGCGTGTCAT-3′;SASH1 的正向引物序列为5′-CGGGAAAGCGT⁃CAAGTCGGA-3′,反向引物序列为5′-ATCTCCTTTCTTGAGCTTGAG-3′;GAPDH 的正向引物序列为5′-GTCAACGGATTTGGTCTGTATT-3′,反向引物序列为5′-AGTCTTCTGGGTGGCAGT⁃GAT-3′。
3.3 MTT 法检测Ishikawa 细胞的活力 将Ishikawa细胞的浓度调至1×108/L,并在96 孔板中培养24 h。按照细胞分组进行不同处理。24、48 和72 h 后,将20 μL MTT 试剂(5 g/L)添加到每个孔中,然后孵育2 h。用移液管弃去上清液,加入100 μL DMSO 并摇动15 min。用酶标仪测量490 nm处的吸光度(A)。
3.4 Transwell小室法检测Ishikawa细胞的迁移和侵袭能力 将Matrigel 与无血清DMEM 培养基按1∶5的比例混匀,包被上腔室用于侵袭分析(Transwell 迁移分析时,上腔室未用Matrigel 包被)。将转染的Ishikawa细胞重悬于无血清的DMEM培养基中,并以每孔3×104细胞的密度加入到Transwell 上腔室中。下腔室加入500 μL 补充有10% FBS 的DMEM 培养基作为化学引诱剂。温育24 h 后,除去未侵袭/迁移的细胞,并对侵袭/迁移的细胞染色,并在显微镜下计数。
3.5 Western blot 检测SASH1、cyclin D1、p21、MMP-2 和MMP-9 的蛋白表达 使用RIPA 裂解缓冲液从转染的Ishikawa细胞中提取总蛋白。30 μg蛋白进行10% SDS-PAGE,并在120 V 下分离;然后将蛋白转移到聚偏二氟乙烯膜上,并使用含5%脱脂奶粉的Tris-HCl-Tween 缓冲盐溶液(Tris buffered saline with Tween,TBST)在室温下封闭1 h;不同的Ⅰ抗(抗SASH1、cyclin D1、p21、MMP-2 和MMP-9 抗体,稀释度均为1∶1 000)于4℃与膜孵育过夜;将膜用TBST溶液洗涤3 次,然后将膜与II 抗(稀释度为1∶5 000)在室温下孵育1 h,然后用TBST 溶液洗涤3 次;在增强型化学发光试剂中对蛋白进行可视化。GAPDH被用内参照,测定SASH1、cyclin D1、p21、MMP-2 和MMP-9蛋白的表达水平。
3.6 StarBase 预测和双萤光素酶报告基因实验分析miR-556-3p 和SASH1 的靶向关系 使用StarBase(http://starbase.sysu.edu.cn/)在线数据库检测miR-556-3p 的潜在靶标,发 现miR-556-3p 与SASH1 的3´UTR 存在部分互补配对的序列,并由RiboBio 合成。分别通过PCR扩增含有miR-556-3p假定结合位点的野生型(wild-type,WT)和突变型(mutant,MUT)SASH1 3´ UTR 片段,将扩增的片段插入到pmirGLO 双萤光素酶表达载体中,以构建WT-SASH1和MUT-SASH1萤光素酶报告基因载体。将Ishikawa细胞以每孔5×104的浓度接种到24孔板中过夜;按照制造商的方案,使用Lipofectamine 2000 将细胞与WT-SASH1 或MUT-SASH1 和miR-NC 或miR-556-3p共转染;48 h 后,使用Dual-Luciferase Reporter Assay System测定萤光素酶活性。
4 统计学处理
采用SPSS 22.0软件进行数据的统计和分析,结果以均数±标准差(mean±SD)表示。两组间比较采用t检验,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。以P<0.05 为差异有统计学显著性。
结 果
1 miR-556-3p 和SASH1 在子宫内膜癌组织中的表达
RT-qPCR 和Western blot 检测结果显示,与癌旁组织比较,子宫内膜癌组织中miR-556-3p 表达量显著增加,SASH1的mRNA 和蛋白表达量显著减少(P<0.05),见图1。
2 抑制miR-556-3p 表达对子宫内膜癌Ishikawa 细胞活力、迁移和侵袭的影响
如图2 所示,与anti-miR-NC 组比较,anti-miR-556-3p 组子宫内膜癌Ishikawa 细胞的miR-556-3p 表达量显著减少,48 h和72 h的细胞活力显著减弱,迁移细胞数和侵袭细胞数显著减少,cyclin D1、MMP-2和MMP-9 蛋白水平显著降低,p21 蛋白水平显著升高(P<0.05)。
3 SASH1 过表达对子宫内膜癌Ishikawa 细胞活力、迁移和侵袭的影响
如图3 所示,与pcDNA 组比较,pcDNA-SASH1组子宫内膜癌Ishikawa 细胞中SASH1 蛋白表达量显著增加,48 h和72 h的细胞活力显著减弱,迁移细胞数和侵袭细胞数显著减少,cyclin D1、MMP-2 和MMP-9 蛋白水平显著降低,p21 蛋白水平显著升高(P<0.05)。
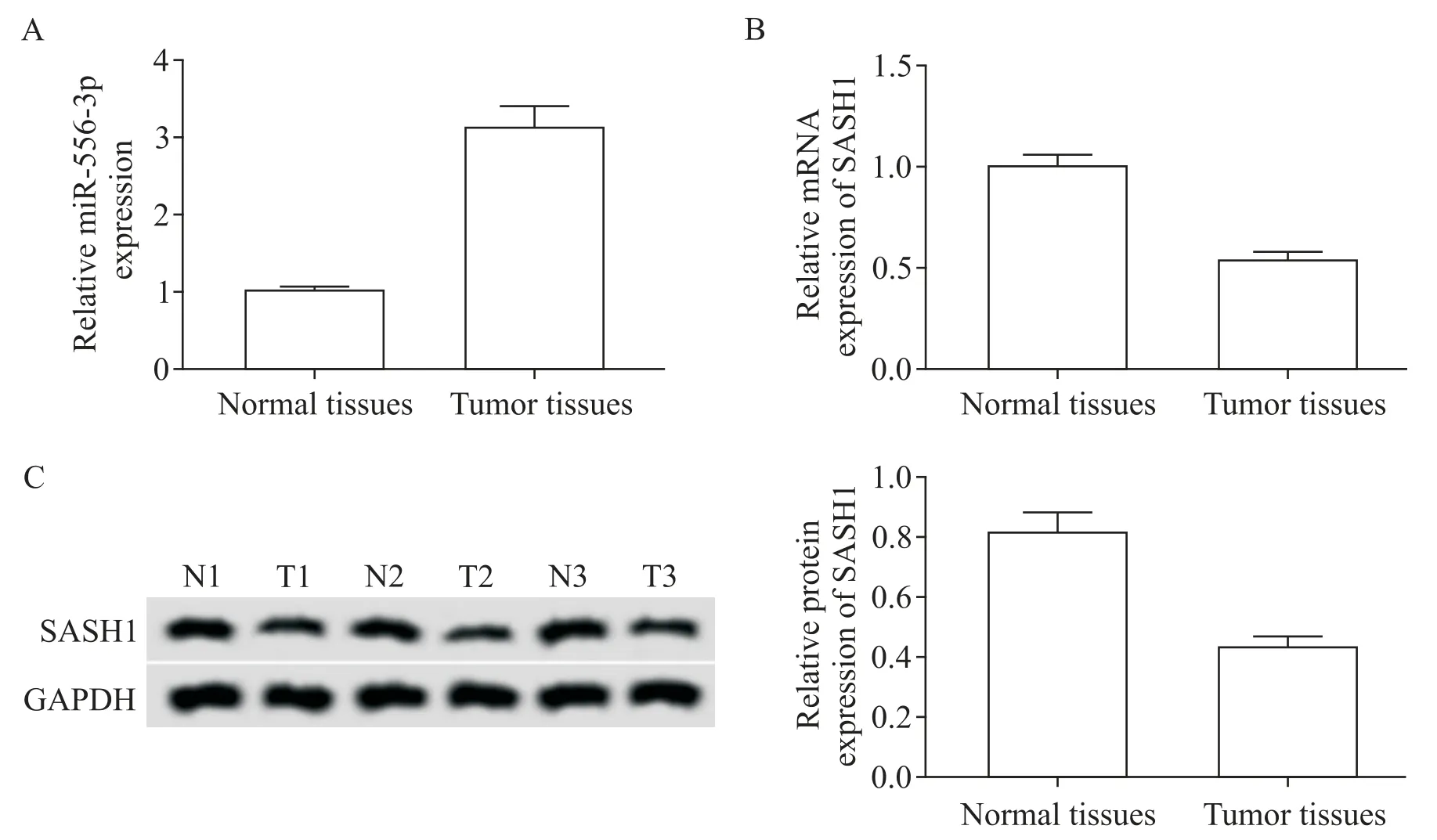
Figure 1.Expression of miR-556-3p and SASH1 in endometrial cancer tissues.A:the expression of miR-556-3p in endometrial can⁃cer tissues;B:the mRNA expression of SASH1 in endometrial cancer tissues;C:the protein expression of SASH1 in endo⁃metrial cancer tissues(N:normal;T:tumor).Mean±SD. n=35.*P<0.05 vs normal tissues.图1 miR-556-3p和SASH1在子宫内膜癌组织中的表达
4 miR-556-3p靶向调控SASH1的表达
StarBase 预测结果显示,SASH1 的3´UTR 部分核苷酸序列可与miR-556-3p 形成互补配对,见图4A。双萤光素酶报告基因实验结果显示,与miRNC 组比较,miR-556-3p 组转染WT-SASH1 的细胞萤光素酶活性显著降低(P<0.05),而转染MUT-SASH1的细胞萤光素酶活性无显著变化(P>0.05),见图4B。Western blot 检测结果显示,与miR-NC 组比较,miR-556-3p组细胞中SASH1蛋白的表达量显著减少(P<0.05);与anti-miR-NC 组比较,anti-miR-556-3p组细胞中SASH1蛋白的表达量显著增加(P<0.05)。
5 敲减SASH1表达逆转了抑制miR-556-3p表达对子宫内膜癌Ishikawa细胞活力、迁移和侵袭的作用
如图5 所示,与anti-miR-NC 组比较,anti-miR-556-3p 组子宫内膜癌Ishikawa 细胞的SASH1 蛋白表达量显著增加,24 h、48 h 和72 h 的细胞活力显著减弱,迁移细胞数和侵袭细胞数显著减少,cyclin D1、MMP-2 和MMP-9 蛋白水平显著降低,p21 蛋白水平显著升高(P<0.05);与anti-miR-556-3p+si-NC 组比较,anti-miR-556-3p+si-SASH1 组细胞中SASH1 蛋白水平显著降低,24 h、48 h、72 h 的细胞活力显著增强,迁移细胞数和侵袭细胞数显著增多,cyclin D1、MMP-2 和MMP-9 蛋白表达量显著增加,p21 蛋白表达量显著减少(P<0.05)。
讨 论
由于发生率高,子宫内膜癌的临床治疗已引起越来越多的关注[11]。现阶段,在治疗该疾病方面已经取得突破,大多数患者在手术、放疗和化疗后获得了可喜的预后。然而,由于不及时或不适当的治疗,某些患者也可能发生肿瘤转移,严重影响了患者的预后[12]。因此,确定子宫内膜癌增殖和转移的关键分子机制将有助于为患者制定更好的治疗策略。癌细胞的增殖、迁移和侵袭是一个多步骤、多因素的生物学过程。越来越多的证据表明,miRNA 表达在肿瘤发生和发展中起着至关重要的作用,miRNA 通过调节肿瘤细胞的增殖、迁移、凋亡和血管生成等影响多种肿瘤的病理演进过程,包括子宫内膜癌[13-15]。本研究鉴定了子宫内膜癌中miR-556-3p水平及其促进细胞活力、迁移和侵袭作用,此外,还将SASH1(子宫内膜癌的一种可能的肿瘤抑制因子)确定为miR-556-3p 的直接功能靶标,这一发现将为子宫内膜癌患者治疗方法的改进提供新的依据。
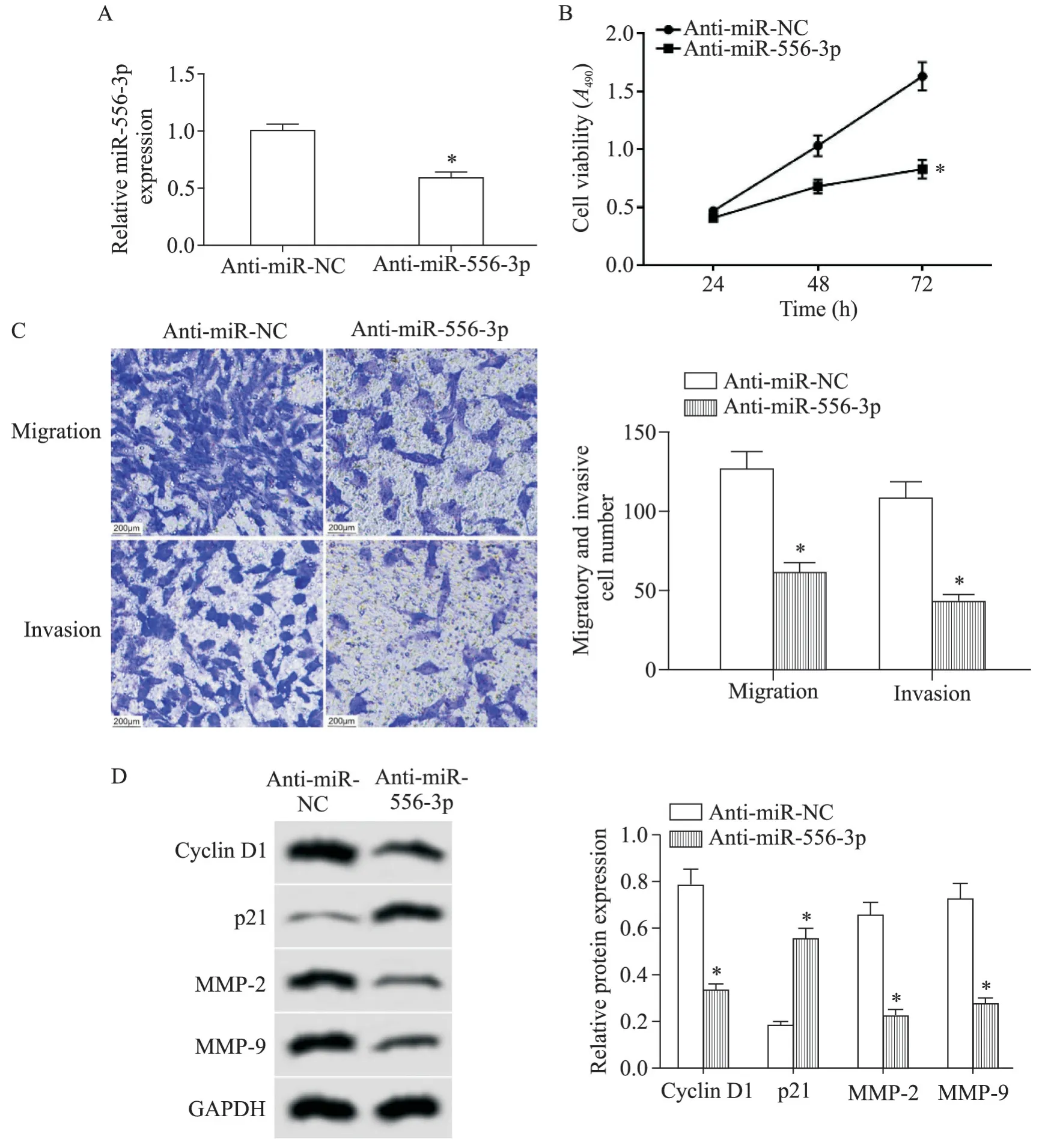
Figure 2.The effect of miR-556-3p expression knock-down on the viability,migration and invasion of endometrial cancer Ishikawa cells.A:the change of miR-556-3p expression level after transfection with anti-miR-556-3p;B:the change of cell viabili⁃ty after transfection with anti-miR-556-3p;C:the changes of migration and invasion abilities after transfection with antimiR-556-3p(scale bar=200 μm);D:the changes of cyclin D1,p21,MMP-2 and MMP-9 protein expression after transfec⁃tion with anti-miR-556-3p.Mean±SD. n=9.*P<0.05 vs anti-miR-NC group.图2 敲减miR-556-3p表达对子宫内膜癌Ishikawa细胞活力、迁移和侵袭的影响
在本研究中,RT-qPCR 检测结果显示,与癌旁组织相比,miR-556-3p 在子宫内膜癌组织中显著上调,表明其参与子宫内膜癌的发生发展过程。已有一些研究报道了miR-556-3p 在肿瘤中的功能和意义。例如,miR-556-3p 是人类食管癌[7]和膀胱癌的促癌基因,在膀胱癌组织和细胞中表达上调,过表达miR-556-3p 促进膀胱癌细胞的增殖、迁移、侵袭和集落形成[16]。然而,关于miR-556-3p 在子宫内膜癌中的功能或分子机制了解甚少。本研究的功能实验结果显示,抑制miR-556-3p 表达显著抑制子宫内膜癌Ishikawa 细胞的活力、迁移、侵袭及cyclin D1、MMP-2和MMP-9 蛋白表达,显著提高p21 蛋白水平。这表明miR-556-3p 在子宫内膜癌中充当致癌因子,抑制miR-556-3p 具有抑制子宫内膜癌细胞活力、迁移和侵袭的功能,与前人研究一致。
SASH1基因包括22 个外显子和21 个内含子,位于染色体位点6q24.3,长度为279 746 个碱基对。SASH1 是信号衔接蛋白SLY 家族的成员,编码包含SAM 和SH3 结构域的蛋白质,是蛋白与蛋白相互作用所必需的,并介导信号复合物的形成[17]。在数种类型的肿瘤中,SASH1 被鉴定为一种有效的肿瘤抑制剂,如宫颈癌[8]、胃癌[9]和食管鳞状细胞癌[17]。SASH1 在肝癌细胞中低表达,过表达SASH1 可以抑制肝癌细胞的增殖、迁移和侵袭[18]。这些研究表明,SASH1 在许多癌症中起着抑癌作用。本研究中,子宫内膜癌组织中SASH1的mRNA 和蛋白表达显著下调,SASH1 过表达后,子宫内膜癌Ishikawa 细胞的活力、迁移、侵袭及cyclin D1、MMP-2 和MMP-9 蛋白表达显著降低,p21 蛋白水平则显著升高,提示SASH1在子宫内膜癌中同样扮演着抑癌基因的角色,发挥一定的抗肿瘤作用,与前述报道[17-18]相同。
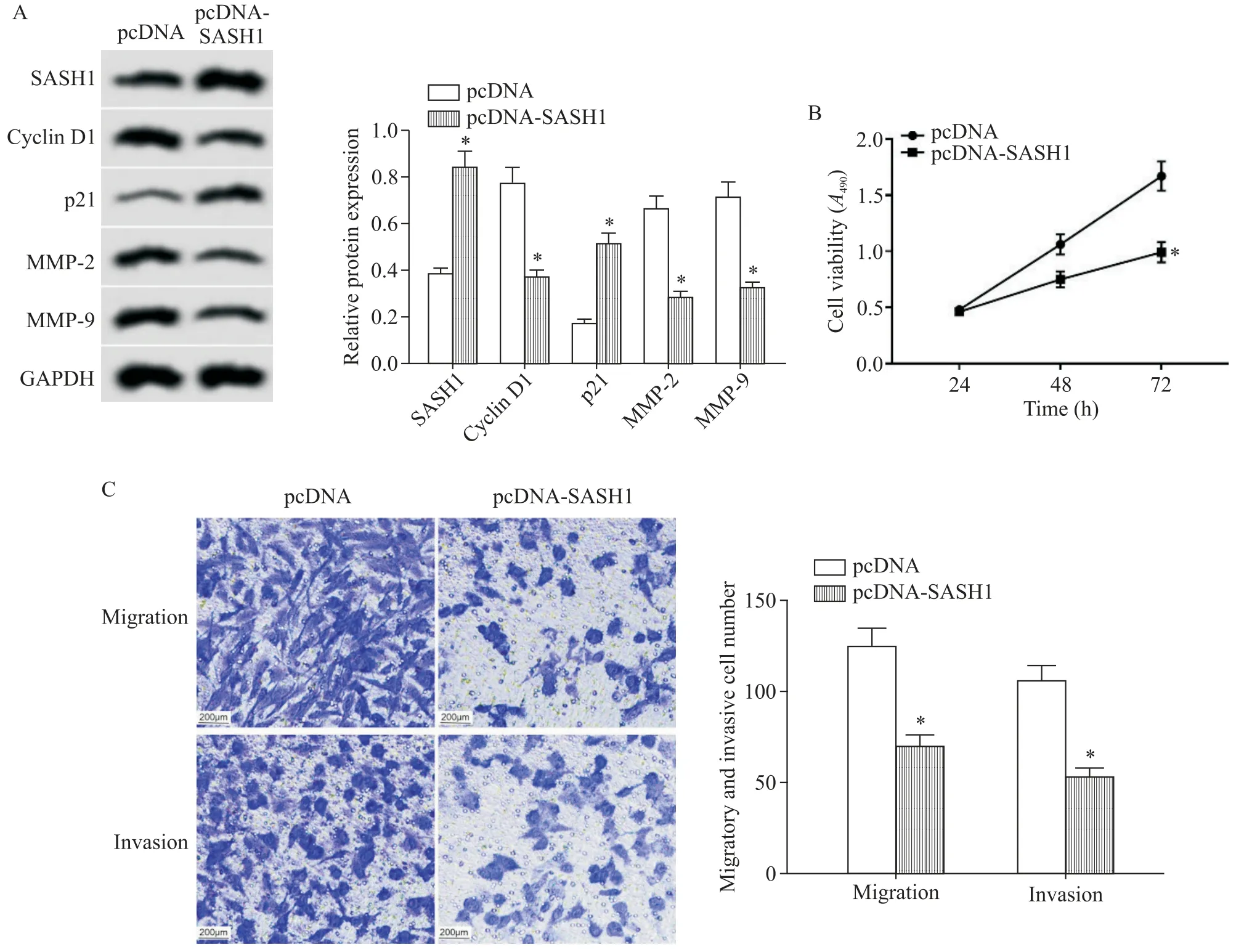
Figure 3.The effect of SASH1 over-expression on the viability,migration and invasion of endometrial cancer Ishikawa cells.A:the protein expression levels of SASH1,cyclin D1,p21,MMP-2 and MMP-9 after transfection with pcDNA-SASH1;B:the change of cell viability after transfection with pcDNA-SASH1;C:the changes of cell migration and invasion abilities after transfection with pcDNA-SASH1(scale bar=200 μm).Mean±SD. n=9.*P<0.05 vs pcDNA group.图3 SASH1过表达对子宫内膜癌Ishikawa细胞活力、迁移和侵袭的影响
miRNA 通过调节特定靶标的表达,在肿瘤的发展和进程中发挥抑癌或致癌作用[19]。资料显示,宫颈鳞状细胞癌中的SASH1 受hsa-miR-21 调控[19];miR-17 通过靶向骨肉瘤细胞中的SASH1,促进细胞增殖和迁移,并抑制细胞凋亡[20]。已有证据表明,miR-556-3p 可以靶向DAB2IP 调控食管癌[7]和膀胱癌[16]的恶性进展;PPP2R2A 是miR-556-5p 促进前列腺癌细胞增殖的直接靶标[21]。由于并未发现miRNA对其下游靶基因的表达调控有细胞特异性,猜想这些靶基因可能在不同类型的细胞中均发挥作用。本研究为了确定miR-556-3p在子宫内膜癌中致癌作用的潜在靶标,利用生物信息学预测和双萤光素酶报告基因实验进行分析,结果显示,SASH1是miR-556-3p 的下游靶基因。此外miR-556-3p 的上调或下调可降低或升高SASH1 的表达水平;抑制miR-556-3p表达对Ishikawa 细胞活力、迁移和侵袭的抑制作用可被干扰SASH1表达所逆转。这些结果说明抑制miR-556-3p 表达通过下调靶基因SASH1的表达水平而发挥抑制子宫内膜癌细胞活力、迁移和侵袭的作用。
总之,miR-556-3p在子宫内膜癌中表达上调,抑制miR-556-3p 通过靶向SASH1抑制子宫内膜癌细胞的活力、侵袭和迁移。这为鉴定子宫内膜癌新的诊断和治疗方法的进一步研究提供了基础。
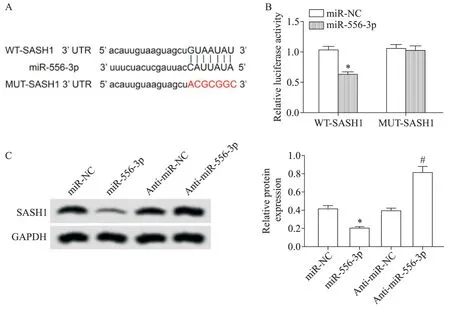
Figure 4.miR-556-3p targeted SASH1 and regulated its expression.A:the 3´UTR of SASH1 contained a nucleotide sequence com⁃plementary to miR-556-3p;B:dual-luciferase reporter experiment;C:miR-556-3p regulated the protein expression of SASH1.Mean±SD. n=9.*P<0.05 vs miR-NC group;#P<0.05 vs anti-miR-NC group.图4 miR-556-3p靶向调控SASH1的表达
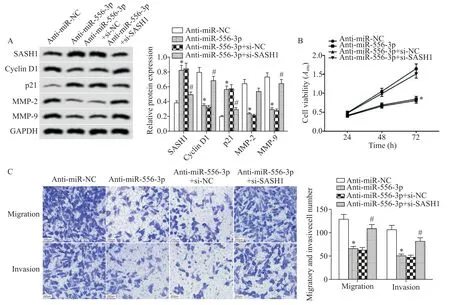
Figure 5.Knock-down of SASH1 expression reversed the effect of miR-556-3p expression inhibition on the viability,migration and in⁃vasion of endometrial cancer Ishikawa cells.A:the protein levels of SASH1,cyclin D1,p21,MMP-2 and MMP-9 after transfection with anti-miR-556-3p and si-SASH1;B:the cell viability after transfection with anti-miR-556-3p and si-SASH1;C:the cell migration and invasion abilities after transfection with anti-miR-556-3p and si-SASH1(scale bar=200 μm).Mean±SD. n=9.*P<0.05 vs anti-miR-NC group;#P<0.05 vs anti-miR-556-3p+si-NC group.图5 敲减SASH1表达逆转了抑制miR-556-3p表达对子宫内膜癌Ishikawa细胞活力、迁移和侵袭的作用
