沉默AQP3基因表达对结直肠癌细胞增殖、凋亡和化疗敏感性的影响
2021-01-05郑斯鑫周春华孔文成尹光
郑斯鑫 周春华 孔文成 尹光
[摘要] 目的 探討沉默水通道蛋白3(AQP3)基因表达对结直肠癌细胞增殖、凋亡和化疗敏感性的影响。 方法 体外培养结直肠癌细胞LoVo,采用梯度浓度诱导法建立紫杉醇耐药细胞株LoVo/Taxol。将LoVo细胞和LoVo/Taxol细胞分别分为空白对照组(细胞不做任何特殊处理)、阴性对照组(转染阴性对照质粒)、shAQP3组(沉默AQP3表达),逆转录-聚合酶链反应(qRT-PCR)和Western blot法检测AQP3 mRNA和蛋白表达。CCK-8实验检测细胞的增殖能力,流式细胞术检测细胞的凋亡情况。四唑化合物(MTS)检测紫杉醇的细胞毒性。结果 人结肠癌细胞LoVo中AQP3 mRNA相对表达量和蛋白表达量均高于人正常结肠上皮细胞NCM460和HCoEpiC,差异有统计学意义(P<0.05)。敲低AQP3表达后,shAQP3组LoVo细胞增殖活性(OD值)较空白对照组和阴性对照组降低,同时凋亡率升高,差异有统计学意义(P<0.05)。成功构建LoVo/Taxol耐药细胞,对紫杉醇、5-Fu、阿霉素的耐药指数分别为(31.97±1.78)、(17.97±2.14)、(104.80±5.53)。而shAQP3组LoVo/Taxol细胞对紫杉醇、5-Fu、阿霉素的耐药指数分别为(6.06±0.25)、(5.57±0.20)、(21.23±0.27),较空白对照组和阴性对照组明显降低,差异有统计学意义(P<0.05)。 结论 沉默AQP3基因表达能够抑制结直肠癌细胞增殖,促进结直肠癌细胞凋亡并增强LoVo/Taxol耐药细胞的化疗敏感性。
[关键词] AQP3;结直肠癌;增殖;凋亡;化疗敏感性
[中图分类号] R735.3 [文献标识码] A [文章编号] 1673-9701(2021)31-0006-06
[Abstract] Objective To explore the effect of silencing aquaporin 3 (AQP3) gene expression on the proliferation, apoptosis, and chemosensitivity of colorectal cancer cells. Methods LoVo colorectal cancer cells were cultured in vitro, and the LoVo/Taxol paclitaxel-resistant cell lines were established by gradient concentration induction method. The LoVo cells and LoVo/Taxol cells were divided into the blank control group (no special treatment), the negative control group (negative control plasmid transfection), and the shAQP3 group (silencing AQP3 expression). Reverse transcription-polymerase chain reaction (qRT-PCR) and Western blot method were used to detect AQP3 mRNA and protein expression. CCK-8 experiment was used to detect cell proliferation ability, and flow cytometry was used to detect cell apoptosis. Tetrazolium compound (MTS) was used to detect the cytotoxicity of paclitaxel. Results The AQP3 mRNA relative expression and protein expression in human colon cancer cells LoVo were higher than those in human normal colonic epithelial cells NCM460 and HCoEpiC,the difference was statistically significant (P<0.05). After knocking down the AQP3 expression, the proliferation activity (OD value) of LoVo cells in the shAQP3 group was lower than those in the blank control group and the negative control group, and the apoptosis rate was higher than those in the blank control group and the negative control group,the difference was statistically significant(P<0.05). The LoVo/Taxol resistant cells were successfully constructed, and the resistance indexes to paclitaxel, 5-Fu and adriamycin were (31.97±1.78), (17.97±2.14), (104.80±5.53), respectively. The resistance indexes of LoVo/Taxol cells to paclitaxel, 5-Fu and adriamycin in the shAQP3 group were (6.06±0.25), (5.57±0.20), (21.23±0.27), respectively, which were significantly lower than those in the blank control group and the negative control group,the difference was statistically significant(P<0.05). Conclusion Silencing AQP3 gene expression can inhibit the proliferation of colorectal cancer cells, promote the apoptosis of colorectal cancer cells, and enhance the chemosensitivity of LoVo/Taxol resistant cells.
[Key words] AQP3; Colorectal cancer; Proliferation; Apoptosis; Chemosensitivity
2018年,中国结直肠癌发病率占世界的24.3%,病死率占世界的22.9%,且逐渐呈现年轻化趋势[1]。为了提高临床治疗效果,有必要更好地了解结直肠癌的发生机制,从而推动精准医学的发展。水通道蛋白(Aquaporins,AQPs)是一种糖基化的膜整合蛋白,能够通过跨质膜的渗透梯度促进跨上皮水分子转运[2]。虽然AQPs存在于多种组织中,但大多具有独特的组织表达模式,如在某些肿瘤细胞中表达非常活跃。研究表明,AQP3在多种肿瘤细胞增殖、生存、转移中起着关键作用[3]。Hong等[4]研究也发现血清AQP-1、AQP-3对年轻结肠癌患者具有重要的预后价值,但是缺乏基础实验证据支持。因此,本研究分别以结直肠癌亲本细胞LoVo和紫杉醇耐药细胞株LoVo/Taxol作为研究对象,探讨沉默AQP3基因表达对结直肠癌细胞增殖、凋亡和化疗敏感性的影响,以期为寻找结肠癌新的靶点提供证据。
1 材料与方法
1.1 细胞来源及培养
人结肠癌细胞系SW620、LoVo、HCT116、SW480、Caco-2、HT-29及人正常结肠上皮细胞NCM460、HCoEpiC,均购自中国科学院(上海)典型培养物保藏委员会细胞库。细胞常规培养于RPMI-1640或DMEM培养液中,辅以10%胎牛血清、50 IU/mL青霉素、50 μg/mL链霉素和2 mmol/L谷氨酰胺,培养在37℃、5%CO2生化培养箱中。
1.2 材料
Dulbecco改良Eagle高糖培养基(DMEM)、RPMI-1640培养基、胰蛋白酶购自美国Sigma公司;兔抗人单克隆抗体Anti-AQP3购自美国Cell Signing公司。紫杉醇(Paclitaxel)购自上海Sigma-Aldrich公司,溶解在二甲基亚砜(DMSO)中,制备20 mmol/L储备液,DMSO终浓度<0.1%(V/V),保存在-80℃,使用前用細胞培养基稀释。5-Fu购自上海Sigma-Aldrich公司,以20 mmol/L浓度储存在DMSO中。阿霉素购自上海Sigma-Aldrich公司,用PBS溶解至1 mmol/L保存在 -20℃。AQP3 shRNA转染质粒购自美国Origene公司;Genjet转染试剂购自美国SignaGen Laboratories;反转录试剂盒与SYBR Premix Ex Taq 试剂盒购自日本TaKaRa公司;CCK-8、MTS试剂盒购自南京建成生物工程研究所;倒置显微镜购自日本Olympus公司;Annexin V-FITC/PI 流式细胞检测试剂盒购自上海朗智生物科技有限公司。
1.3 方法
1.3.1 建立耐药细胞株 采用体外梯度浓度诱导法建立LoVo紫杉醇耐药细胞株,起始浓度为0.05 μmol/L,培养48 h后更换为不含药物的RPMI-1640完全培养液,待细胞状态逐渐正常(约2周)后,以浓度倍增的方式提高药物浓度,待细胞能够在1.5 μmol/L紫杉醇溶液中长期稳定生长时,制备细胞爬片,用2% Giemsa染液染色,并用安装了MacBiophotonics插件的Image J(v. 1.39)系统分析细胞和核周长等形态学参数。收集细胞,用紫杉醇、5-Fu、顺铂验证细胞的耐药指数和半数抑制浓度(50% Concentration inhibition,IC50)[5]。
1.3.2 细胞转染与分组 将LoVo和LoVo/Taxol细胞分别分为空白对照组(细胞不做任何特殊处理)、阴性对照组(转染阴性对照质粒)、shAQP3组(转染AQP3 shRNA质粒序列)。在4个AQP3 shRNA转染质粒序列中,选择下调最明显的质粒作为稳定表达细胞(shAQP3组)的载体用作后续实验。用Genjet体外转染试剂将AQP3 shRNA转染质粒和对照shRNA质粒[包括一个红色荧光蛋白(Red fluorescent protein,RFP)序列和位于SV40启动子下游的嘌呤霉素-N-乙酰基转移酶基因]转染LoVo细胞。用2 μg/mL嘌呤霉素处理细胞2周后,用玻璃菌落筛选柱挑选抗嘌呤霉素细胞集落。然后对细胞进行5倍的连续稀释,最后一次稀释评估RFP表达和传代培养。
1.3.3 qRT-PCR检测AQP3 mRNA的表达 Trizol试剂盒按照说明书提取总RNA,紫外分光光度法定量后,按照逆转录试剂盒说明进行操作。AQP3上游引物:5'-GTC ACT CTG GGC ATC CTC AT-3',下游引物:5'-GCC CAA AAA CTA TTC CAG CA-3'。用SYBR Green PCR Master Mix试剂盒进行PCR,扩增条件为94℃,15 s;55℃,15 s;72℃,20 s;共35个循环。用2-ΔΔCt法以β-actin为内参计算LoVo和LoVo/Taxol各组细胞中AQP3 mRNA的相对表达量。
1.3.4 Western blot法检测细胞AQP3蛋白表达 细胞用RIPA 缓冲液溶解,13 000 RCF离心去除不溶性物质,用Lowry法定量分析裂解产物的蛋白质含量,并在690 nm处进行吸光度测量。取每个样本约60 μg蛋白经12% SDS-PAGE变性分离。随后以100 V电转到PVDF膜上,然后用5%脱脂牛奶加入含0.1% Tween-20(TBST)的1×TBS缓冲液进行封闭。封闭后,在TBST和TBS缓冲液中分别洗涤3次和1次,然后在4℃下与兔抗人AQP3抗体孵育过夜,用山羊抗兔IgG-HRP结合的二级抗体再次孵育。洗膜后暴露于EN-ECL化学发光系统5 min。然后使用GBOX HR 16成像系统和GeneSys软件进行可视化处理。以微管蛋白(Tubulin)作为内参。
1.3.5 CCK-8法检测细胞增殖 对数生长期的LoVo细胞接种于96孔板上,于37℃、5%CO2培养箱中分别培养24、48、72、96 h后每孔加入10 μL CCK-8试剂,37℃孵育2 h后,用酶标仪检测各孔吸光度(OD)值。
1.3.6 流式细胞术检测细胞凋亡 培养48 h后收集各组LoVo细胞,先加入300 μL 1×Binding Buffer 悬浮细胞,然后加入5 μL的Annexin V-FITC混匀、避光、室温孵育15 min。上机前5 min再加入5 μL PI染色,上机前补加200 μL 1×Binding Buffer,用流式细胞仪检测各组细胞的凋亡率。
1.3.7 MTS检测LoVo/Taxol细胞的多药耐药性 取对数生长期的LoVo细胞和LoVo/Taxol细胞,用0.25%胰酶消化,按5000个/100 μL接种于96孔板,次日更换培养基,将紫杉醇、5-Fu、阿霉素分别稀释至8个梯度浓度,加药处理48 h后,每孔加入20 μL的MTS试剂,37℃继续孵育3 h,用酶标仪读取每孔的光密度值(OD=490 nm)。设含紫杉醇组为实验组,0 nM为对照组,细胞存活率=(实验组OD490-空白组OD490)/(对照组OD490-空白组OD490)×100%。
1.4 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料以均数±标准差(x±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
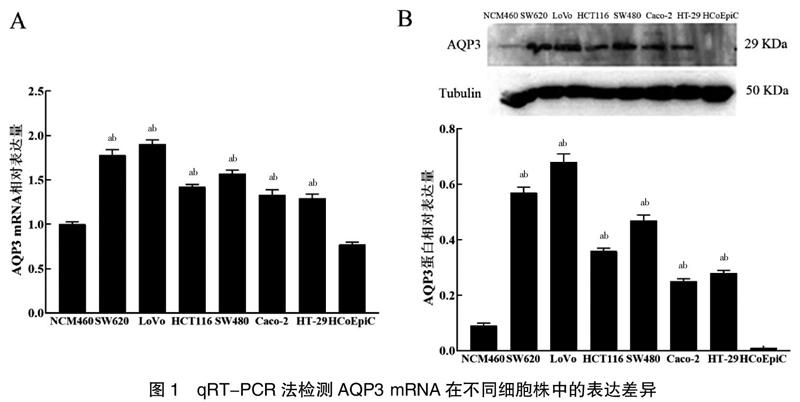
2.1 人结肠癌细胞和正常结肠上皮细胞中AQP3表达差异
经qRT-PCR法和Western blot法检测,人结肠癌细胞系(SW620、LoVo、HCT116、SW480、Caco-2、HT-29)中AQP3 mRNA相对表达量和蛋白表达量均高于人正常结肠上皮细胞NCM460和HCoEpiC,差异有统计学意义(P<0.05)。本研究选择AQP3表达量相对较高的LoVo细胞用于后续研究。见图1。
2.2 沉默AQP3表达对细胞LoVo细胞增殖和凋亡活性的影响
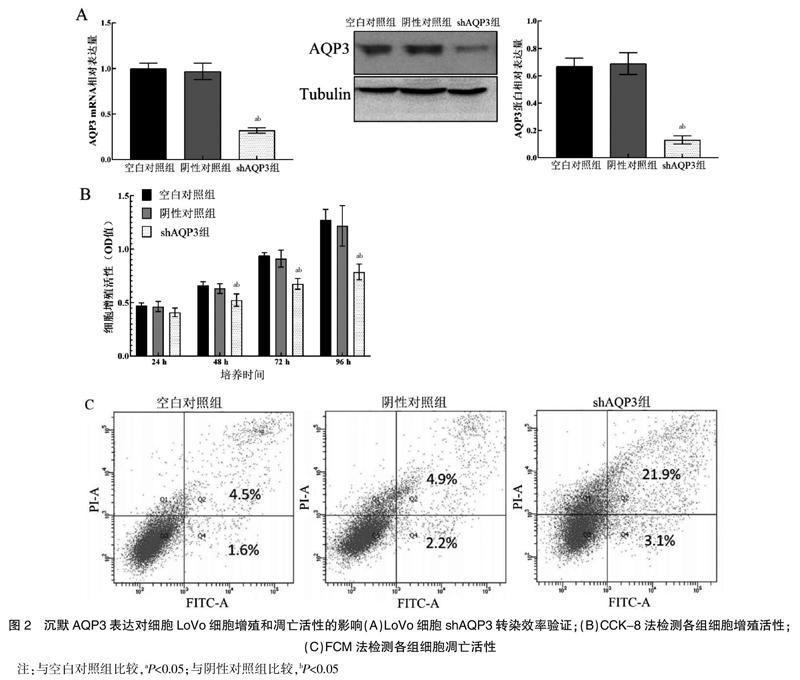
2.2.1 AQP3 mRNA的相对表达量 经qRT-PCR法和Western blot法检测,与空白对照组和阴性对照组比较,shAQP3组LoVo细胞中AQP3 mRNA相对表达量和蛋白表达量均显著降低,差异有统计学意义(P<0.05)。见图2A。
2.2.2 细胞增殖活性 经CCK-8法检测,分别转染24、48、72、96 h时,shAQP3组LoVo细胞增殖活性(OD值)均低于空白对照组和阴性对照组,差异有统计学意义(P<0.05)。见图2B。
2.2.3 细胞凋亡活性 经FCM法检测,shAQP3组LoVo细胞凋亡率为(25.84±3.15)%,高于空白对照组的(5.22±0.37)%和阴性对照组的(6.31±0.75)%,差异有统计学意义(P<0.05)。见图2C。
2.3 LoVo/Taxol耐藥细胞验证
历时8个月,利用体外浓度梯度诱导法成功建立LoVo紫杉醇耐药细胞株LoVo/Taxol。
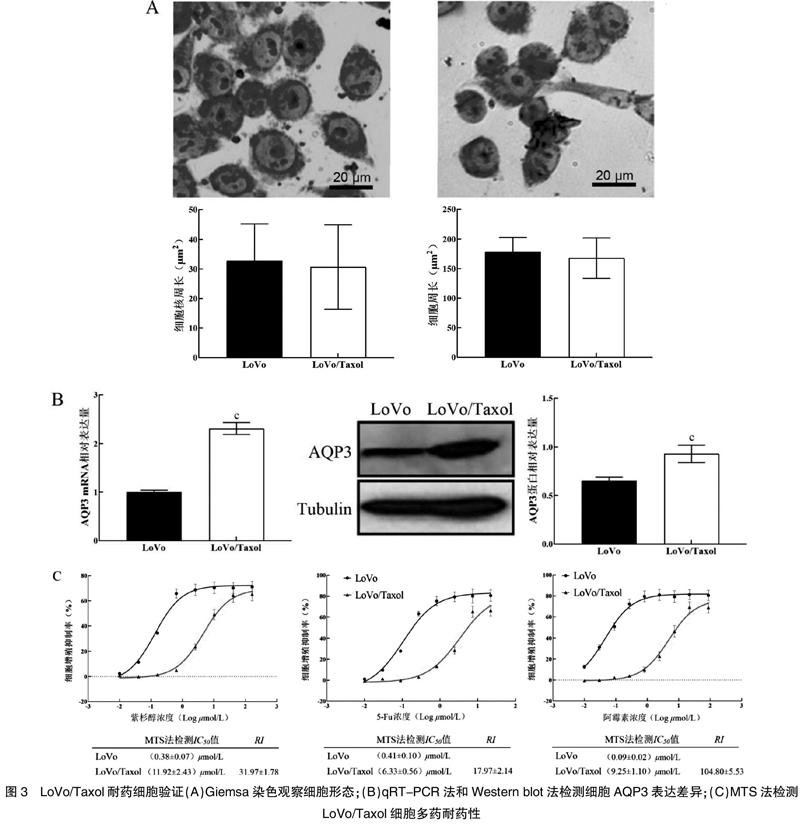
2.3.1 形态学观察 Giemsa染色和影像学分析显示,比较LoVo细胞和LoVo/Taxol耐药细胞的细胞周长和核周长,均差异无统计学意义(P>0.05)。见图3A。
2.3.2 AQP3表达差异 qRT-PCR法和Western blot法检测结果显示,与LoVo细胞比较,LoVo/Taxol耐药细胞中AQP3 mRNA相对表达量和蛋白表达量均显著升高,差异有统计学意义(P<0.05)。见图3B。
2.3.3 LoVo/Taxol细胞多药耐药性验证 经MTS法检测,培养48 h时,LoVo/Taxol细胞对紫杉醇、5-Fu、阿霉素的耐药指数分别为(31.97±1.78)、(17.97±2.14)、(104.80±5.53)。见图3C。
2.4 沉默AQP3表达对细胞LoVo/Taxol细胞多药耐药的影响
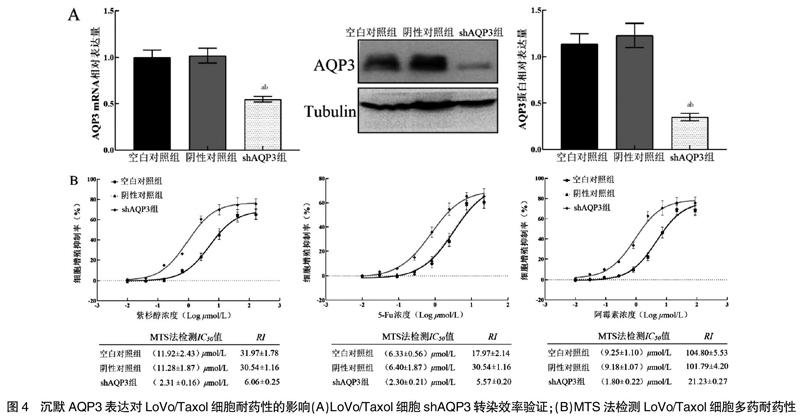
2.4.1 AQP3 mRNA的相对表达量 经qRT-PCR法和Western blot法检测,与空白对照组和阴性对照组比较,shAQP3组LoVo/Taxol细胞中AQP3 mRNA相对表达量和蛋白表达量均显著降低,差异有统计学意义(P<0.05)。见图4A。
2.4.2 化疗药物细胞毒作用 经MTS法检测,培养48 h时,shAQP3组LoVo/Taxol细胞对紫杉醇、5-Fu、阿霉素的耐药指数分别为(6.06±0.25)、(5.57±0.20)、(21.23±0.27),较空白对照组和阴性对照组明显降低,差异有统计学意义(P<0.05)。见图4B。
3 讨论
据最新流行病学数据显示,全世界有超过945 000人患结直肠癌,约492 000人病死[6]。结直肠癌发病率随着年龄的增长而增加,这不仅造成沉重的医疗、经济负担,也导致相当的社会生产力损失[7]。手术、放疗和化疗是直肠癌治疗的重要组成部分,尤其是化疗对于中晚期结直肠癌的治疗必不可少[8]。虽然近年来结直肠癌的治疗取得了很大进展,但是化疗的效率通常受到癌细胞对治疗药物的耐药性的限制。鉴于此,为治疗干预确定新的细胞靶点对于开发临床治疗药物至关重要。本研究发现,敲低LoVo细胞中AQP3的表达可以显著调节结肠癌细胞生物学的多个病理进程,包括细胞增殖、凋亡和化疗耐药。先前的证据表明,AQP3与结肠癌患者预后有关,但是缺少体外证据证明AQP3对结肠癌细胞的作用。针对肿瘤细胞的增殖和凋亡研究是非常重要的,因为肿瘤细胞生长活性与疾病预后有着显著的相关性。结合上述数据,表明通过抑制AQP3的表达可以通过降低细胞增殖活性,同时提高细胞凋亡率,进而功能性地靶向细胞生长,这也更好地解释了AQP3可能与结肠癌患者的临床预后相关。
AQPs家族的膜蛋白通道促进水分在所有细胞膜上的快速运输,从而维持体内水分的稳态[9]。迄今为止,已经确定了13种人类AQPs[10],它们分为两个不同的亚组:经典AQPs(AQP1、2、4、5、6和8),它们只负责运输水分子;水甘油通道蛋白(Aquaglyceroporins)(AQP 3、7、9和10),它们还会额外运输小的不带电荷的分子,如甘油和尿素[11]。AQP3在人体内广泛表达,参与了越来越多的生理和病理过程,包括糖脂代谢、维持皮肤弹性等[12]。动物研究显示,AQP3-null小鼠被证明具有较低的伤口愈合能力,同时皮肤癌的发生风险也较低[13]。此外,在肺癌[14]、乳腺癌[15]和前列腺癌[16]中观察到AQP3的过表达和异位表达,在这些癌症中,AQP3有助于转移、增殖和上皮-间质转化。肿瘤细胞的增殖、迁移和侵袭在肿瘤的发展过程中起着重要作用。癌细胞的特征是细胞增殖加速,肿瘤的进展通常与异常的细胞增殖、迁移和侵袭有关。AQP定位于遷移细胞的前缘有助于吸收水分,从而引起小的肿胀,通过增加肌动蛋白丝的空间来促进向前移动[17]。在本研究中,通过敲除AQP3在LoVo细胞中的表达可减少细胞的增殖活性,同时诱导细胞凋亡,说明AQP3低表达对于抑制肿瘤细胞的生长具有积极作用。最近有研究显示,AQP3可介导细胞内H2O2参与EGF诱导的肿瘤细胞信号转导及其依赖细胞功能的表皮生长因子的表达,而敲除AQP3基因后,免疫缺陷小鼠 A431细胞移植瘤的生长受到明显抑制[18]。因此,AQP3在EGFR细胞信号传导过程中作为第二信使发挥促肿瘤增殖的作用[19],这表明AQP3可能是这些促癌信号通路的关键调节因子。虽然这些不是直接证据,但也间接说明降低AQP3表达导致细胞行为改变的机制。
此外,不受控制的增殖活性为癌细胞抵抗常规化疗药物提供了生存优势。以Taxol为基础的治疗是最常见的结肠癌治疗方案之一。然而,Taxol治疗常常导致化疗耐药的发展,导致复发和治疗失败。AQP3是否参与结肠癌的化疗耐药尚不清楚。Gao等[20]研究证明,AQP3和AQP9过表达抑制了黑色素瘤中亚砷酸盐的治疗效果。本研究发现,AQP3过表达与LoVo/Taxol细胞化疗抵抗有关。敲低AQP3表达后,可以显著增强LoVo/Taxol细胞对Taxol、5-Fu、阿霉素等细胞毒药物的敏感性。这些结果表明,AQP3介导了LoVo/Taxol细胞的多药耐药性,这与AQP3过表达与结肠癌患者预后不良之间的关系一致。
AQP3有望成为结肠癌治疗的一个令人兴奋的靶标,首先它是一种膜蛋白,使用传统的药学手段相对容易获得;其次使用AQP3基因敲除小鼠的研究表明,其主要表型后果仅限于导致皮肤干燥和减少伤口愈合,虽然伤口愈合的延迟可能是术后的一个问题,但是仍然可以通过比较简单的手段来解决。本研究为进一步的工作提供了一个平台,然而仍然需要更深入的机制研究以证实AQP3作为结肠癌治疗靶点的潜力。
综上所述,AQP3高表达可能是促进结肠癌细胞生长和化疗耐药的重要分子机制之一;敲低AQP3表达后,LoVo细胞增殖活性降低,同时凋亡率增加,LoVo/Taxol细胞对多种化疗药物的耐药性也被逆转。此研究结果为AQP3在结直肠癌中的作用提供了实验依据和理论基础,并为结直肠癌的临床治疗提供新的思路。
[参考文献]
[1] 郑莹,王泽洲.全球结直肠癌流行数据解读[J].中华流行病学杂志,2021,42(1):149-152.
[2] Zhang M,Li T,Zhu J,et al. Physiological and pathophysiological role of ion channels and transporters in the colorectum and colorectal cancer[J].J Cell Mol Med,2020, 24(17):9486-9494.
[3] Marlar S,Jensen HH,Login FH,et al.Aquaporin-3 in cancer[J]. Int J Mol Sci,2017,18(10):2106.
[4] Hong Y,Chen Z,Li N,et al. Prognostic value of serum aquaporin-1,aquaporin-3 and galectin-3 for young patients with colon cancer[J]. Ann Clin Biochem,2020,57(6):404-411.
[5] 陈一帆,张燕,王强,等.人结肠癌紫杉醇耐药细胞株的建立及耐药相关基因mRNA表达的研究[J].宁夏医科大学学报,2017,39(5):545-549,582.
[6] 陈万青,李霓,兰平,等.中国结直肠癌筛查与早诊早治指南(2020,北京)[J].中华肿瘤杂志,2021,43(1):16-38.
[7] Wu C.Systemic Therapy for colon cancer[J].Surg Oncol Clin N Am,2018,27(2):235-242.
[8] Chen EX,Jonker DJ,Loree JM,et al.Effect of combined immune checkpoint inhibition vs. best supportive care alone in patients with advanced colorectal cancer:The canadian cancer trials group CO.26 study[J].JAMA Oncol,2020, 6(6):831-838.
[9] Mariajoseph-Antony LF,Kannan A,Panneerselvam A,et al.Role of aquaporins in inflammation-a scientific curation[J].Inflammation,2020,43(5):1599-1610.
[10] Dajani S,Saripalli A,Sharma-Walia N.Water transport proteins-aquaporins(AQPs)in cancer biology[J].Oncotarget,2018,9(91):36 392-36 405.
[11] Kordowitzki P,Kranc W,Bryl R,et al.The relevance of aquaporins for the physiology,pathology,and aging of the female reproductive system in mammals[J].Cells,2020,9(12):2570.
[12] 朱燁柯,李玉红,祝贵州,等.水通道蛋白3与胃肠道疾病相关性研究进展[J].中华全科医学,2020,18(1):109-112.
[13] Hara-Chikuma M,Verkman AS.Prevention of skin tumorigenesis and impairment of epidermal cell proliferation by targeted aquaporin-3 gene disruption[J]. Mol Cell Biol,2008,28(1):326-332.
[14] Liu C,Liu L,Zhang Y,et al.Molecular mechanism of AQP3 in regulating differentiation and apoptosis of lung cancer stem cells through Wnt/GSK-3beta/beta-Catenin pathway[J].J BUON,2020,25(4):1714-1720.
[15] Satooka H,Hara-Chikuma M.Aquaporin-3 controls breast cancer cell migration by regulating hydrogen peroxide transport and its downstream cell signaling[J]. Mol Cell Biol,2016,36(7):1206-1218.
[16] Bründl J,Wallinger S,Breyer J,et al. Expression,localisation and potential significance of aquaporins in benign and malignant human prostate tissue[J]. BMC Urol,2018, 18(1):75.
[17] 付雪岩,王雅玮,王文青,等. RNA干扰沉默水通道蛋白3基因对人肝癌细胞SMMC-7721增殖和凋亡的影响[J]. 中国医科大学学报,2019,43(7):596-600.
[18] Hara-Chikuma M,Watanabe S,Satooka H,et al.Involvement of aquaporin-3 in epidermal growth factor receptor signaling via hydrogen peroxide transport in cancer cells[J].Biochem Biophys Res Commun,2016,471(4):603-609.
[19] Bollag WB,Aitkens L,White J,et al. Aquaporin-3 in the epidermis:More than skin deep[J].Am J Physiol Cell Physiol,2020,318(6):C1144-C1153.
[20] Gao L,Gao Y,Li X,et al.Aquaporins mediate the chemoresistance of human melanoma cells to arsenite[J]. Mol Oncol,2012,6(1):81-87.
(收稿日期:2021-04-10)
