UPLC-QTOF-MS法分析沙棘果实、叶和枝的成分
2020-12-13郑文惠白海英王丽瑶杨志刚
郑文惠,白海英,王丽瑶,包 芳,杨志刚
(兰州大学药学院,甘肃兰州 730000)
沙棘Hippophae rhamnoidesL.为胡颓子科沙棘属的落叶灌木或小乔木,含有鞣质类[1]、黄酮类[2]、萜类[3]、甾体类[4]、有机酸[5]和挥发油[5]等多种活性成分,具有较高的药用价值。此外,沙棘在治理水土流失、改善生态环境和促进农民增收等方面发挥积极作用。
2015年版《中国药典》 中沙棘以果实入药,具有健脾消食、止咳祛痰、活血散瘀的功效。沙棘叶虽未被药典收载,但具有抗氧化[1,6-7]、抗菌[7]、抗病毒[8]、抗炎[9]、抗癌[8]、抗肥胖[4]等生物活性,也是提取沙棘黄酮的重要原料。沙棘枝中含有三萜类化合物,具有抗炎和抗氧化活性[10]。目前,利用液质联用技术(LC-MS)对沙棘果实和叶中酚类成分的研究较多[1,11-14],课题组尚未发现采用LC-MS对沙棘枝进行化学成分研究的报道。为了促进沙棘不同部位的综合开发利用,本研究对新疆产沙棘的果实中的化合物进行分离鉴定,并对沙棘果实、叶和枝的化学成分进行UPLC-QTOF-MS对比分析。
1 材料
Prep EasySep-1050半制备型高效液相色谱仪(中国上海通微分析技术有限公司);半制备型色谱柱 Cosmosil 5C18-MS-Ⅱ、Cosmosil 5C18-PAQ、Cosmosil 5C18π NAP (10 mm×250 mm,5 μm,日本Nacalai tesque公司);AVANCEⅢ-400型核磁共振波谱仪(德国Bruker公司);薄层色谱用硅胶G和柱色谱硅胶(青岛海洋化工有限公司);D101型大孔吸附树脂(北京Solarbio公司);ODS (日本Nacalai tesque公司);MCI Gel CHP-20 (日本三菱公司);Sephadex LH-20葡聚糖凝胶(美国Ge公司);Agilent 1290超高效液相色谱仪、Agilent 6560离子淌度飞行时间质谱仪(美国Agilent公司);CORTECS UHPLC C18色谱柱 (2.1 mm ×100 mm,1.6 μm,美国Waters公司);Ultrafree离心管(0.22 μm,美国Millipore公司);质谱纯甲醇和乙腈(美国Merda公司);质谱纯甲酸和水(德国Merck公司);其余试剂均为分析纯。
对照品pedunculagin、stachyurin、hippophaenin B、1,2,6-三-O-没食子酰基-β-D-吡喃型葡萄糖、木麻黄鞣亭、鞣花酸、槲皮素、异鼠李素、异鼠李素-3-O-槐糖-7-O-葡萄糖苷、异鼠李素-3-O-葡萄糖-7-O-鼠李糖苷、槲皮素-3-O-芸香糖苷、异鼠李素-3-O-葡萄糖苷由课题组从沙棘中分离得到;异槲皮苷(批号RP170508,纯度≥98%)、水仙苷(批号RP180814,纯度≥98%)均购于成都麦德生科技有限公司。
本实验所用沙棘于2017年9月采自新疆喀什,经兰州大学杨志刚副教授鉴定为胡颓子科植物沙棘Hippophae rhamnoidesL.,标本保存于兰州大学药学院。
2 方法
2.1 提取与分离 新鲜沙棘果2.0 kg粉碎,石油醚脱脂,然后用3倍量80%乙醇浸泡提取,反复4次,每次2 h。纱布滤过并合并提取液,减压浓缩至无乙醇味,得总浸膏470 g。总浸膏通过D101型大孔树脂柱粗分,以水-乙醇(100 ∶1~0 ∶100)梯度洗脱,得到9个部分(Fr.A~Fr.I)。
Fr.D (39.9 g)经过硅胶柱分离,以氯仿-甲醇-水(100 ∶1 ∶1~0 ∶100 ∶10)梯度洗脱,得到12个组分(Fr.D1~D12)。Fr.D9 (1.6 g)经开放ODS柱和半制备HPLC进行分离纯化,得化合物1(10.0 mg)、2 (5.2 mg)。Fr.D10 (2.9 g)经开放ODS柱、硅胶柱、MCI柱、Sephadex LH-20柱和半制备HPLC进行分离纯化,得化合物3(4.1 mg)、4 (10.6 mg)、5 (7.2 mg)。Fr.E(13.1 g)经过硅胶柱分离,用氯仿-甲醇(100 ∶1~0 ∶100)梯度洗脱,得化合物6 (23.3 mg)。
2.2 UPLC-QTOF-MS分析
2.2.1 对照品溶液制备 精密称取对照品pedunculagin、stachyurin、hippophaenin B、1,2,6-三-O-没食子酰基-β-D-吡喃型葡萄糖、异鼠李素-3-O-槐糖-7-O-葡萄糖苷、木麻黄鞣亭、鞣花酸、异鼠李素-3-O-葡萄糖-7-O-鼠李糖苷、槲皮素-3-O-芸香糖苷、异槲皮苷、水仙苷、异鼠李素-3-O-葡萄糖苷、槲皮素、异鼠李素各1.00 mg,用甲醇水溶液溶解配成10 μg/mL的溶液,即得。
2.2.2 供试品溶液制备 将沙棘枝、叶和果实粉碎后过50目筛,分别称取粉末0.2 g,置具塞锥形瓶中,加入20 mL 70%甲醇,超声提取60 min。提取液静置30 min,取上清液用离心过滤管3 000 r/min离心2 min,即得。
2.2.3 LC-MS条件 CORTECS UHPLC C18色谱柱(2.1 mm×100 mm,1.6 μm);流动相0.1%甲酸水(A)-0.1%甲酸乙腈溶液(B);梯度洗脱(0~2 min,7% B;2~3 min,7%~12% B;3~8 min,12%~18% B;8~12 min,18%~60% B;12~13 min,60%~100% B;13~14 min,100%B);体积流量0.3 mL/min;柱温36 ℃;进样量2 μL。
质谱系统采用电喷雾离子源(ESI);负离子检测模式;扫描范围m/z100~1 700。ESI源参数为干燥气(N2)体积流量5 mL/min;干燥气温度300 ℃;雾化气压力35 psi (1 psi=6.895 kPa);毛细管电压3 500 V;喷嘴电压1 000 V;毛细管出口电压400 V;碰撞能20 eV。
3 结果
3.1 结构鉴定
化合物 1:黄色粉末,HR-ESI-MS m/z:623.161 9 [M-H]-。1H-NMR (DMSO-d6,400 MHz) δ:12.57 (1H,s,5-OH),7.84 (1H,d,J=1.6 Hz,H-2′),6.90 (1H,d,J=8.4 Hz,H-5′),7.51 (1H,dd,J=2.0,8.4 Hz,H-6′),6.19 (1H,d,J=2.0 Hz,H-6),6.41 (1H,d,J=2.0 Hz,H-8),5.43 (1H,d,J=7.2 Hz,H-1″),5.40 (1H,s,H-1‴),0.97 (3H,d,J=6.4 Hz,H-6‴),3.83 (3H,s,-OCH3);13C-NMR(DMSO-d6,100 MHz) δ:156.5 (C-2),133.0 (C-3),177.3 (C-4),161.2 (C-5),98.8 (C-6),164.4 (C-7),93.9 (C-8),156.5 (C-9),104.0(C-10),122.3 (C-1′),115.3 (C-2′),146.9 (C-3′),56.2 (3′-OCH3),149.4 (C-4′),113.3 (C-5′),121.1 (C-6′),100.9 (Glc-C-1″),74.3 (C-2″),76.4 (C-3″),68.3 (C-4″),76.0 (C-5″),66.9 (C-6″),101.2 (Rha-C-1‴),70.3 (C-2‴),70.6 (C-3‴),71.8 (C-4‴),70.1 (C-5‴),17.7(C-6‴)。以上数据与文献[15]一致,故鉴定为柽柳黄素-3-O-β-D-葡萄糖-7-O-α-L-鼠李糖苷。
化合物 2:黄色粉末,HR-ESI-MS m/z:623.162 2 [M-H]-。1H-NMR (DMSO-d6,400 MHz) δ:12.60 (1H,s,5-OH),7.95 (1H,d,J=2.0 Hz,H-2′),6.92 (1H,d,J=8.4 Hz,H-5′),7.56 (1H,dd,J=2.0,8.8 Hz,H-6′),6.45 (1H,d,J=2.0 Hz,H-6),6.84 (1H,d,J=2.0 Hz,H-8),5.57 (1H,d,J=7.6 Hz,H-1″),5.56 (1H,s,H-1‴),1.11 (3H,d,J=6.0 Hz,H-6‴),3.84 (3H,s,-OCH3);13C-NMR(DMSO-d6,100 MHz) δ:156.9 (C-2),133.3 (C-3),177.6 (C-4),160.9 (C-5),99.4 (C-6),161.6 (C-7),94.6 (C-8),156.0 (C-9),105.7(C-10),120.9 (C-1′),113.5 (C-2′),147.0 (C-3′),55.7 (3′-OCH3),149.7 (C-4′),115.3 (C-5′),122.3 (C-6′),100.7 (Glc-C-1″),74.3 (C-2″),77.5 (C-3″),71.6 (C-4″),76.4 (C-5″),60.7 (C-6″),98.3 (Rha-C-1‴),70.3 (C-2‴),70.1 (C-3‴),71.6 (C-4‴),69.9 (C-5‴),17.9(C-6‴)。以上数据与文献[16]一致,故鉴定为异鼠李素-3-O-β-D-葡萄糖-7-O-α-L-鼠李糖苷。
化合物 3:白色粉末,HR-ESI-MS m/z:229.097 0 [M-H]-。1H-NMR (DMSO-d6,400 MHz) δ:11.04 (1H,s,9-NH),7.44 (1H,d,J=8.0 Hz,H-5),7.33 (1H,d,J=8.0 Hz,H-8),7.10 (1H,t,J=7.2,7.6 Hz,H-7),7.01(1H,t,J=7.2,7.6 Hz,H-6),4.56 (1H,d,J=6.4 Hz,H-1),3.24 (1H,dd,J=4.4,16 Hz,H-4a),3.15 (1H,s,H-3),2.80 (1H,t,J=14 Hz,H-4b),1.61 (3H,d,J=6.4 Hz,-CH3);13C-NMR (DMSO-d6,100 MHz) δ:50.0(C-1),58.4 (C-3),23.5 (C-4),118.9 (C-5),120.0 (C-6),122.6 (C-7),112.1 (C-8),131.8(C-10),107.2 (C-4a),126.6 (C-5a),137.2(C-8a),171.4 (-COOH),17.34 (-CH3)。以上数据与文献[17]一致,故鉴定为1-甲基-1,2,3,4-四氢咔啉-3-羧酸。
化合物 4:黄色粉末,HR-ESI-MS m/z:785.216 5 [M-H]-。1H-NMR (DMSO-d6,400 MHz) δ:12.62 (1H,s,5-OH),7.81 (1H,s,H-2′),6.92 (1H,d,J=8.4 Hz,H-5′),7.68(1H,d,J=7.6 Hz,H-6′),6.44 (1H,s,H-6),6.85 (1H,s,H-8),5.74 (1H,d,J=5.2 Hz,H-1″),4.62 (1H,d,J=7.6 Hz,H-1‴),5.56 (1H,s,H-1″″),1.11 (3H,d,J=6.0 Hz,H-6‴),3.85 (3H,s,-OCH3);13C-NMR (DMSOd6,100 MHz) δ:156.6 (C-2),133.3 (C-3),177.7 (C-4),161.0 (C-5),99.5 (C-6),161.7(C-7),94.7 (C-8),156.0 (C-9),105.7 (C-10),120.8 (C-1′),113.1 (C-2′),147.3 (C-3′),55.9 (3′-OCH3),150.2 (C-4′),115.5 (C-5′),123.2 (C-6′),98.4 (Glc-C-1″),82.1 (C-2″),76.6 (C-3″),69.6 (C-4″),76.7 (C-5″),60.6 (C-6″),103.6 (Glc-C-1‴),74.4 (C-2‴),76.9 (C-3‴),70.2 (C-4‴),77.5 (C-5‴),60.9(C-6‴),98.3 (Rha-C-1″″),69.9 (C-2″″),70.4(C-3″″),71.7 (C-4″″),69.9 (C-5″″),18.0 (C-6″″)。以上数据与文献[16]一致,故鉴定为异鼠李素-3-O-β-D-槐二糖-7-O-α-L-鼠李糖苷。
化合物 5:黄色粉末,HR-ESI-MS m/z:609.146 8 [M-H]-。1H-NMR (DMSO-d6,400 MHz) δ:12.59 (1H,s,5-OH),7.53 (1H,s,H-2′),6.84 (1H,d,J=8.0 Hz,H-5′),7.55(1H,m,H-6′),6.19 (1H,d,J=2.0 Hz,H-6),6.38 (1H,d,J=1.6 Hz,H-8),5.34 (1H,d,J=6.8 Hz,H-1″),4.38 (1H,s,H-1‴),0.99 (3H,d,J=6.4 Hz,H-6‴);13C-NMR(DMSO-d6,100 MHz) δ:156.4 (C-2),133.3 (C-3),177.4 (C-4),161.2 (C-5),98.7 (C-6),164.1 (C-7),93.6 (C-8),156.6 (C-9),104.0(C-10),121.6 (C-1′),115.2 (C-2′),144.8 (C-3′),148.4 (C-4′),116.3 (C-5′),121.2 (C-6′),100.8 (Rha-C-1″),74.1 (C-2″),76.5 (C-3″),70.6 (C-4″),75.9 (C-5″),68.3 (C-6″),101.2 (Glc-C-1‴),70.0 (C-2‴),70.4 (C-3‴),71.9 (C-4‴),67.0 (C-5‴),17.8 (C-6‴)。以上数据与文献[18]一致,故鉴定为芦丁。
化合物 6:黄色粉末,HR-ESI-MS m/z:477.104 3 [M-H]-。1H-NMR (DMSO-d6,400 MHz) δ:7.95 (1H,d,J=2.0 Hz,H-2′),7.49(1H,dd,J=2.0,8.8 Hz,H-6′),6.92 (1H,d,J=8.0 Hz,H-5′),6.45 (1H,d,J=2.4 Hz,H-8),6.21 (1H,d,J=2.0 Hz,H-6),5.58(1H,d,J=7.2 Hz,H-1‴),3.84 (3H,s,-OCH3);13C-NMR (DMSO-d6,100 MHz) δ:156.4(C-2),133.0 (C-3),177.4 (C-4),161.2 (C-5),98.7 (C-6),164.2 (C-7),93.7 (C-8),156.3 (C-9),104.0 (C-10),121.1 (C-1′),113.5 (C-2′),146.9 (C-3′),55.7 (3′-OCH3),149.4 (C-4′),115.2 (C-5′),122.0 (C-6′),100.8 (Glc-C-1″),74.3 (C-2″),77.5 (C-3″),69.8 (C-4″),76.4 (C-5″),60.6 (C-6″)。以上数据与文献[19]一致,故鉴定为异鼠李素-3-O-β-D-葡萄糖苷。
3.2 沙棘不同部位成分分析 利用UPLC-QTOFMS对新疆产沙棘枝、叶和果实进行化学成分分析,通过与对照品以及相关文献报道的质谱数据进行分析对比,得到38个峰的保留时间和质谱信息,鉴定出30个化合物,见表1。新疆产沙棘枝、叶和果实提取物的总离子流图,见图1。
峰1、6、9、14、17、18、21、22、24、26、28、29、32、35,与对照品的保留时间和离子碎片信息相同,分别被鉴定为pedunculagin、stachyurin、hippophaenin B、1,2,6-三-O-没食子酰基-β-D-吡喃型葡萄糖、异鼠李素-3-O-槐糖-7-O-鼠李糖苷、木麻黄鞣亭、鞣花酸、异鼠李素-3-O-葡萄糖-7-O-鼠李糖苷、槲皮素-3-O-芸香糖苷、异槲皮苷、水仙苷、异鼠李素-3-O-葡萄糖苷、槲皮素、异鼠李素。
峰2为B型二聚体原花青素。由准分子离子峰m/z577.137 4 [M-H]-,推断其分子式为C30H26O12,MS/MS谱图中有明显的Retro-Diels-Alder (RDA)重排产生的m/z289 [M-H-289]-,407 [M-H-170]-,425 [M-H-152]-碎片离子信息,与文献[19-20]报道的B型二聚体原花青素的特征性离子碎片一致。
峰3为儿茶酸。由准分子离子峰m/z289.072 3[M-H]-,推断其分子式为C15H14O6,以m/z289.072 3作为母离子进行二级质谱分析,谱图中有明显的m/z125,179,203,245碎片离子信息,故鉴定为儿茶酸[20-21]。
峰5是没食子酰基-六羟基联苯甲酰基-葡萄糖。由准分子离子峰m/z633.074 8 [M-H]-,推断其分子式为C27H22O18。MS/MS谱图中有明显的m/z275,301,463碎片离子信息,与文献所报道的没食子酰基-六羟基联苯甲酰基-葡萄糖的特征性离子碎片一致[22]。

表1 沙棘不同部位化合物UPLC-QTOF-MS检测结果Tab.1 Detection results of compounds in different parts of H.rhamnoidesby UPLC-QTOF-MS
峰7为槲皮素-3,7-二-O-葡萄糖苷。由准分子离子峰m/z625.143 7 [M-H]-,推断其分子式为C27H30O17。在其二级质谱谱图中,发现进一步产生的m/z301,463碎片离子,其中碎片463 [MH-162]-是母离子丢失1分子葡萄糖,丢失2分子葡萄糖得到碎片301 [M-H-162-162]-,故鉴定为槲皮素-3,7-二-O-葡萄糖苷[23]。
峰10为槲皮素-3-O-槐糖-7-O-鼠李糖苷。由准分子离子峰m/z771.201 5 [M-H]-,推断其分子式为C33H40O21。在MS/MS谱图中,有明显的m/z179,301,447,625碎片离子。由母离子丢失1分子鼠李糖产生碎片离子625 [M-H-146]-,母离子丢失1分子槐糖产生碎片离子447 [M-H-324]-,苷元槲皮素的碎片离子301 [M-H-146-324]-经过RDA重排产生碎片179,故推测其为槲皮素-3-O-槐糖-7-O-鼠李糖苷[24]。
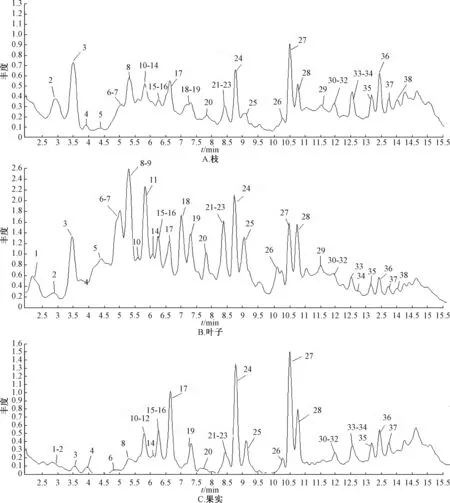
图1 图1沙棘不同部位总离子流图Fig.1 Total ion current chromatogram of different parts of H.rhamnoides
峰12是表儿茶酸。由准分子离子峰m/z289.072 1 [M-H]-,推断其分子式为C15H14O6,与峰3互为同分异构体。以m/z289.072 1作为母离子进行二级质谱分析,谱图中有明显的m/z125,179,203,245碎片离子信息,与文献[20]报道的表儿茶酸的特征性离子碎片一致。
峰15为山柰酚-3-O-槐糖-7-O-鼠李糖苷。由准分子离子峰m/z755.207 6 [M-H]-,推断其分子式为C33H40O20。在二级质谱谱图中,其进一步产生m/z285,431,609碎片离子。碎片离子609[M-H-146]-由母离子丢失1分子鼠李糖,碎片离子431 [M-H-324]-由母离子丢失1分子槐糖,碎片离子285 [M-H-146-324]-为母离子丢失1分子鼠李糖和1分子槐糖,与文献[24]报道的山柰酚-3-O-槐糖-7-O-鼠李糖的特征性离子碎片一致。
峰16是槲皮素-7-O-葡萄糖苷。由准分子离子峰m/z463.053 8 [M-H]-,推断其分子式为C21H20O12,MS/MS谱图中有明显的由母离子丢失1分子葡萄糖形成m/z301 [M-H-162]-碎片离子,故推测其为槲皮素-7-O-葡萄糖苷[24]。
峰19为槲皮素-3-O-葡萄糖-7-O-鼠李糖苷。由准分子离子峰m/z609.149 6 [M-H]-,推断其分子式为C27H30O16,在随后的二级质谱裂解过程中,发现其进一步产生m/z151,301,447,463碎片离子。 m/z463 [M-H-146]-是母离子丢失1分子鼠李糖,m/z447 [M-H-162]-为母离子丢失1分子葡萄糖,m/z301 [M-H-146-162]-经过经RDA重排产生碎片离子151,与文献[23]报道的槲皮素-3-O-葡萄糖-7-O-鼠李糖苷的特征性离子碎片一致。
峰20为鞣花酸-戊糖苷。由准分子离子峰m/z433.043 [M-H]-,推断其分子式为C19H14O12,MS/MS谱图中m/z301 [M-H-132]-由母离子丢失1分子戊糖形成,推测为鞣花酸-戊糖苷[22]。
峰23是异鼠李素-芸香糖-鼠李糖苷。由准分子离子峰m/z769.222 6 [M-H]-,推断其分子式为C34H42O20,以m/z769.222 6作为母离子进行二级质谱分析,发现母离子丢失1分子鼠李糖的碎片离子623 [M-H-146]-,以及继而丢失1分子芸香糖得碎片离子315 [M-H-146-308]-。
峰26为山柰酚-3-O-芸香糖苷。由准分子离子峰m/z593.153 7 [M-H]-,推断其分子式为C27H30O15,在二级质谱谱图中可见由母离子丢失1分子芸香糖形成的m/z285 [M-H-308]-,故推测为山柰酚-3-O-芸香糖苷[2]。
峰29为槲皮素-7-O-鼠李糖苷。由准分子离子峰m/z447.095 3 [M-H]-,推断其分子式为C21H20O11,以m/z447.095 3作为母离子进行二级质谱分析,谱图中有明显的m/z151,301碎片离子信息。碎片离子301 [M-H-146]-为母离子丢失1分子鼠李糖,再经过RDA重排后产生碎片151。与文献[24]所报道的槲皮素-7-O-鼠李糖苷的特征性离子碎片一致。
峰30是山柰酚-3-O-葡萄糖鼠李糖苷。由准分子离子峰m/z593.131 7 [M-H]-,推断其分子式为C27H30O15,在二级质谱谱图中有明显的m/z151,285,447碎片离子信息。碎片离子447 [MH-146]-由母离子丢失1分子鼠李糖得到,继而丢失1分子葡萄糖得到285 [M-H-146-162]-,碎片离子285经过RDA重排产生m/z151。与文献[24]所报道的山柰酚-3-O-葡萄糖鼠李糖苷的特征性离子碎片一致。
峰32为异鼠李素-鼠李糖苷。由准分子离子峰m/z461.110 7 [M-H]-,推断其分子式为C33H22O11,以m/z461.110 7作为母离子进行二级质谱分析,谱图中有明显的m/z107,151,300,315碎片离子信息。母离子丢失1分子鼠李糖得到碎片离子315 [M-H-146]-,继而丢失-CH3得到碎片离子300,碎片离子151和107为苷元异鼠李素m/z315经过RDA重排产生。
4 讨论
本研究从新疆产沙棘果实中分离鉴定了6个化合物,其中化合物3为首次从沙棘属植物中分离得到。此外,采用UPLC-QTOF-MS对新疆产沙棘枝、叶和果实的化学成分进行快速分析,共鉴定或推断出30个化合物,包括8个鞣质类和22个黄酮类,其中在枝中未检出hippophaenin B,表儿茶酸则在叶中未被检出,没食子酰基-六羟基联苯甲酰基-葡萄糖、槲皮素-二葡萄糖苷、hippophaenin B、木麻黄鞣亭在果实中未被检出。以期本研究为进一步对新疆沙棘进行活性化学成分开发和利用提供参考。
