槲皮素在Caco-2单层细胞模型上的跨膜吸收和甲基化代谢
2019-08-12李素云王立芹高蔚娜张振清郭长江
李素云,李 峥,王立芹,高蔚娜,张振清,郭长江
(1.首都医科大学附属北京世纪坛医院,北京100038;2.军事科学院军事医学研究院环境医学和作业医学研究所,天津300050;3.军事科学院军事医学研究院毒物药物研究所,北京100850;4.河北医科大学公共卫生学院流行病学与统计教研室,河北石家庄050011)
槲皮素(quercetin)及其糖苷衍生物是膳食成分中最常见的类黄酮之一,广泛存在于包括蔬菜、水果和中草药等植物中,在机体内能产生多种有益的作用[1-2]。已有较多的研究报道,槲皮素是类黄酮家族中最有力的抗氧化剂之一,特别是清除高活性自由基,如清除过氧化亚硝酸和羟基的能力。另外,体外实验表明,其具有抗凝血、抗肝纤维化、抗菌、抗动脉粥样硬化和抗增殖等作用[3]。槲皮素可直接调节某些生物转化酶的基因表达,通过与雌激素结合位点结合抑制细胞增殖[4-5]。近年来一些研究表明,槲皮素在肠道中可非竞争性地抑制葡萄糖和果糖的易化扩散,具有调节糖的肠道吸收、预防肥胖和控制血糖的作用[6],同时具有刺激实验动物胰岛素分泌、改善胰岛素敏感性和胰岛素抵抗状态、促进外周组织对葡萄糖利用、抑制氧化应激反应、下调炎症因子基因表达等作用[7-8]。由于槲皮素在自然界广泛的分布和多样的生物学作用,其在疾病预防和治疗中的潜力开始被关注,近年来成为诸多领域的研究热点。
但是,槲皮素在体外条件下极不稳定,见光易分解、氧化。同时大量体内和体外实验表明,槲皮素在肠黏膜细胞中即发生广泛的代谢转化,门静脉中几乎检测不到槲皮素原型,循环中的槲皮素苷元含量甚微[8-9]。因此,有关其在肠道内的吸收规律及可能的影响因素仍无定论[10-11],而口服生物利用度低一直被认为是其作为功能性食品使用的主要障碍[13],这成为限制深入了解和有效利用槲皮素的瓶颈之一。本研究利用小肠吸收模型Caco-2细胞单层和外排蛋白P-糖蛋白(P-glycoprotein,P-gp)和多药耐药蛋白2(multi-drug resistance protein 2,MRP2)的特效抑制剂环胞菌素A(cyclosporin,CysA)和MK571,对槲皮素的跨膜转运进行了动态考察和分析,为进一步揭示槲皮素在肠道的吸收过程及可能的影响因素奠定基础。
1 材料与方法
1.1 细胞、主要试剂和仪器
Caco-2细胞,40~50代,美国模式培养物集存库。槲皮素、柽柳黄素(tamarixetin)、异鼠李亭(isorhamnetin)、L-谷氨酰胺和胰蛋白酶,美国Sigma 公司;甲醇(色谱纯),美国Fisher 公司;DMEM 培养基,美国Gibico公司;胎牛血清和非必需氨基酸,美国Hyclone 公司;丁螺环酮(批号0803021),北京华素制药股份有限公司;其他试剂均为分析纯。Millicell 12 孔板,美国Millipore 公司;高效液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)(Agilent 1100 LC/MS DVL,DE),美国Agilent公司。
1.2 细胞培养
Caco-2 细胞用DMEM 培养基(含10%胎牛血清、1%非必需氨基酸、1% L-谷氨酰胺和青霉素-链霉素双抗液)培养,孵育条件为37℃,5%CO2。
1.3 槲皮素跨膜转运实验[3]
实验前,将接种有细胞的12 孔Millicell 板以37℃PBS(pH 7.2)浸泡15 min,轻微冲洗Millicell板,除去细胞表面附着物。
腔侧→基底侧的跨膜转运:在腔侧加入含槲皮素的PBS 600 μL,槲皮素终浓度为9.0或18.0 mg·L-1;基底侧加入PBS(pH 7.2)1200 μL;每浓度设3复孔,置37℃,5%CO2条件下孵育,分别于30,60,90,120 和150 min 于基底侧和腔侧分别取样50 μL,-4℃冷藏备用,并各补充等体积PBS。空白对照组腔侧和基底侧均只加PBS,其他操作相同。取出的样品精确加入等体积内标溶液后充分混匀,进样20 μL,应用LC-MS 测定槲皮素、异鼠李亭和柽柳黄素。
基底侧→腔侧的跨膜转运:将含槲皮素的PBS 1200 μL 加入基底侧,槲皮素终浓度为9.0 或18.0 mg·L-1;腔侧加入PBS600 μL;其他操作同上。
P-gp和MRP2抑制实验:先于腔侧加入300 μL CysA 10 mmol·L-1或MK571 1 mmol·L-1(pH=7.2),孵育15 min 后,再加入300 μL含槲皮素的PBS 溶液,终浓度为9.0和18.0 mg·L-1,其余操作同上。
1.4 槲皮素及其甲基代谢产物的LC-MS检测[4]
液相条件:色谱柱为Agient-C18 柱,2.1 mm×100 mm,3.5 μm,柱温为室温,流动相A为水(含0.1%甲酸);流动相B为甲醇+乙腈(含0.1%甲酸),A∶B=65∶35(V/V)。流速:0.2 mL·min-1;进样量:20 μL。
质谱条件:采用电喷雾离子源,雾化气压力30 psi,干燥气流速8 L·min-1,干燥气温度35℃,毛细管压力3000 V,四极杆温度保持在99℃,增益为1,峰宽为0.10 min,选择正离子模式,采用选择离子监测(SIM)测定以提高灵敏度。
应用流动注射方式(FIA)、以全扫描模式优化各化合物的Fragmentor 值及分子离子峰的质荷比(m/z)。槲皮素、异鼠李亭和柽柳黄素的m/z 分别为303,317和317,内标丁螺环酮m/z为386.2。
1.5 统计学分析
2 结果
2.1 槲皮素双向转运中槲皮素及其甲基化代谢产物在加载侧和透过侧含量的动态变化
2.1.1 槲皮素含量的动态变化
由图1可见,槲皮素9.0和18.0 mg·L-1在Caco-2单层细胞模型上双向的跨膜转运过程中,透过侧槲皮素的动态变化均呈先升后降的趋势,120 min 达峰值,随后下降(P<0.01);加载侧剩余量在150 min内呈持续下降趋势(P<0.01)。
2.1.2 异鼠李亭含量的动态变化
由图2可见,在Caco-2单层细胞模型上双向跨膜转运过程中,槲皮素9.0和18.0 mg·L-1组不同时间点,于加载侧和透过侧均能检测到异鼠李亭,其双侧含量呈现与母体化合物槲皮素相似的趋势特征,120 min 达峰,150 min 下降,且18 mg·L-1组异鼠李亭的含量均高于同侧的9 mg·L-1组。另外发现,两侧异鼠李亭的含量在双向转运之间有差别:腔侧→基底侧转运中,从30~150 min 腔侧的含量始终高于基底侧(P<0.01);而基底侧→腔侧转运中,30 min 时基底侧的含量高于腔侧,60 min 后腔侧含量高于基底侧,直至150 min孵育终点。

Fig.1 Dynamic changes of quercetin amount on receiver side(A1 and B1)and loading side(A2 and B2)during bidirectional transport. A:apical→basolateral transport;B:basolateral→apical transport. s,n=3. *P<0.05,**P<0.01,compared with the previous time group of the same concentration;#P<0.05,##P<0.01,compared with quercetin group at the same time
2.1.3 柽柳黄素含量的动态变化
由图3可见,槲皮素在Caco-2单层细胞在双向跨膜转运过程中,9.0和18.0 mg·L-1组不同时间点,于加载侧和透过侧均能检测到柽柳黄素。双侧柽柳黄素的含量变化和分布趋势与异鼠李亭相似,18 mg·L-1组柽柳黄素的含量均高于同侧的9 mg·L-1组(P<0.01)。柽柳黄素在两侧的分布特点亦与异鼠李亭相似,在腔侧→基底侧转运中,腔侧的含量始终高于基底侧(P<0.01);基底侧→腔侧转运中,30~60 min时基底侧的含量高于腔侧,60 min后腔侧含量高于基底侧(P<0.01),直至150 min孵育终点。

Fig.2 Dynamic changes of isorhamnetin on both sides after bi-directional transport of quercetin. A1 and B1:apical side→basolateral side;A2 and B2:basolateral side→apical side;A:quercetin 18 mg·L-1;B:quercetin 9 mg·L-1.s,n=3.*P<0.05,**P<0.01,compared with the previous time group of the same concentration;#P<0.05,##P<0.01,compared with quercetin group at the same time.
2.2 槲皮素双向转运中槲皮素及其甲基化代谢产物在加载侧和透过侧相对含量的分析比较
由表1 和表2 可见,在30~150 min 孵育时间内,透过侧槲皮素在120 min达到峰值时,仍不及加载量的7%~10%,150 min 时减至6%~7%;而加载侧剩余量在30 min 时已不足加载量20%~25%,且随孵育时间持续减少,150 min 时不足加载量的10%,表明在跨膜转运过程中,加载侧减少的槲皮素>90%未检测到。槲皮素的甲基化代谢产物异鼠李亭和柽柳黄素在两侧的检出量亦仅为槲皮素加载量的0.1%~0.3%。

Fig.3 Dynamic changes of tamarixetin on both side after bi-directional transport of quercetin. A1 and B1:apical side→basolateral side;A2 and B2:basolateral side→apical side;A:quercetin 18 mg·L-1;B:quercetin 9 mg·L-1. s,n=3. *P<0.05,**P<0.01,compared with the previous time group of the same concentration;#P<0.05,##P<0.01,compared with quercetin group at the same time.
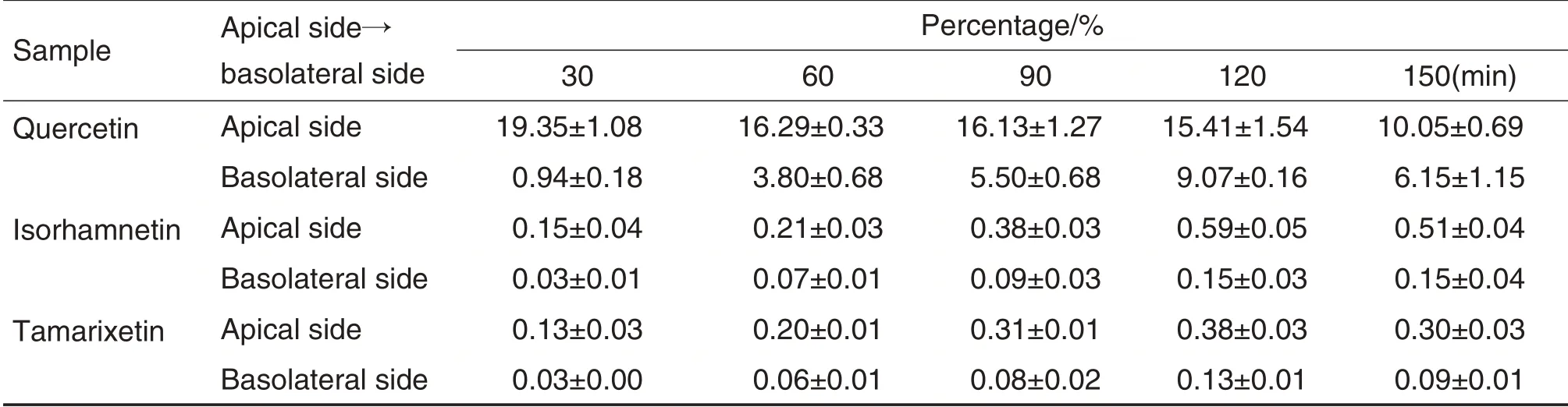
Tab.1 Dynamic changes of percentage of quercetin and methyl quercetin on both sides after apical side→basolateral side transport of quercetin 18 mg·L-1loaded

Tab.2 Dynamic changes of percentage of quercetin and methyl quercetin on both sides after basolateral side→apical side transport of quercetin 18 mg·L-1 loaded
2.3 P-糖蛋白和MRP2 对槲皮素跨膜转运的影响
由图4可知,槲皮素在Caco-2单层细胞腔侧→基底侧跨膜转运过程中,在槲皮素、CysA+槲皮素和MK571+槲皮素孵育条件下,槲皮素9.0和18.0 mg·L-1透过侧槲皮素含量的动态变化均呈现随孵育时间先升后降的趋势,120 min达峰,随后下降(P<0.01)。与槲皮素组比较,CysA+槲皮素和MK571+槲皮素组透过侧槲皮素均显著高于槲皮素组(P<0.01)。
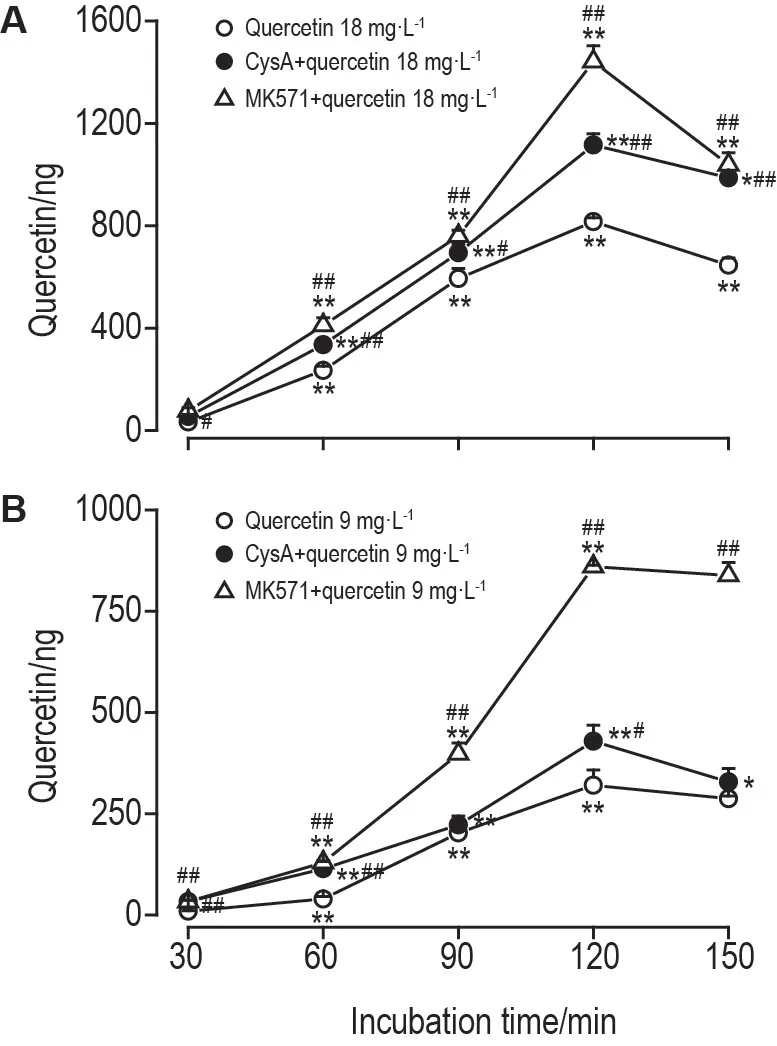
Fig.4 Dynamic changes of quercetin amount on basolateral side during transmembrane transport of apical side→basolateral side.,n=3.*P<0.05,**P<0.01,compared with the previous time group of the same concentration;#P<0.05,##P<0.01,compared with quercetin group at the same time.
3 讨论
肠道吸收和排泄是决定口服黄酮类化合物生物利用度的两个主要因素,不良的口服生物利用度已被认为是其作为药物和营养剂使用的一个主要障碍[14-15]。已往研究发现,槲皮素口服后,血液中几乎检测不到槲皮素原型的存在,由于槲皮素分子量大、极性强,因此在很长一段时间内被认为很难在肠道吸收,口服后的吸收可以忽略不计[16-18]。近年来的大量研究证实,槲皮素可以在小肠各段被吸收,并且在肠道黏膜细胞内即发生广泛的代谢[17-18]。Walgren等[19]采用Caco-2细胞研究发现,槲皮素可通过结肠上皮细胞吸收。Hollman等[20]通过回肠造口术的志愿者口服槲皮素,发现实际上人的肠道可吸收相当量的槲皮素,但在吸收过程中首过代谢严重,因此口服给药槲皮素后原型成分的血浆浓度水平极低,其中被吸收的槲皮素仅有不到1.5%以原型通过尿液排出。本课题组前期研究也表明,槲皮素在Caco-2单层细胞模型上,可以完整的分子形式被Caco-2 细胞摄取并分泌到基底侧[21],同时还检测到槲皮素的甲基化代谢产物。槲皮素在Caco-2 细胞上的跨膜转运特征与其糖苷不同,槲皮素在跨膜转运过程中随孵育时间呈现先升后降的动态特征,而其糖苷则呈现出随孵育时间持续升高的动态表现,150 min 孵育时间内没有观察到平台期,透过侧的甲基代谢产物具有和其原型化合物相似的动态表现[22-23]。对槲皮素的稳定性考察表明,在37℃,5%CO2细胞孵育条件下,180 min时间内槲皮素的稳定性好[24],从而可以排除槲皮素在细胞实验中的稳定性不佳对其动态特征产生的影响。由此推测,槲皮素独特的动态特征可能与其跨膜转运过程中的代谢有关,同时也不能排除外排蛋白对其跨膜吸收的影响[25-26]。但即便如此,仍有研究认为槲皮素作为膳食和中草药中普遍存在的黄酮类物质,生物利用度较差,且不同的研究结果差异也较大[27]。
本研究结果表明,在Caco-2 单层细胞模型上的双向转运过程中,当加载侧槲皮素呈现随孵育时间持续下降的趋势时,透过侧测到的槲皮素呈现出先升后降的特征表现,120 min 达峰,随后下降,但120 min 达峰时,透过侧槲皮素的量也才相当于加载量的7%~10%。而加载侧槲皮素在孵育30 min时即已剩余不足加载量的20%~25%,150 min时仅为加载量的约10%。即加载侧减少的槲皮素与透过侧测定到的槲皮素之间相差悬殊,在跨膜转运过程中,加载侧减少的槲皮素的近90%未在透过侧检测到。槲皮素的甲基化产物异鼠李亭和柽柳黄素在两侧的量也仅为相对于槲皮素加载量的0.1%~0.3%。由此表明,在150 min 时间内,加载量的约90%已经被吸收,而透过侧检测到的量却不足加载量的10%,二者相差在10倍左右。
进一步对槲皮素甲基代谢产物进行分析,显示槲皮素在双向转运过程中,150 min时间内,加载侧和透过侧均能测定到异鼠李亭和柽柳黄素,且在两侧的动态分布均呈现出与透过侧母体化合物槲皮素相似的动态特征,即在孵育的前120 min 内呈逐渐升高的动态变化趋势,120 min 达峰,随后下降。研究还发现,在由腔侧→基底转运过程中,异鼠李亭和柽柳黄素在任一时间点腔侧的含量均显著高于基底侧;而在基底侧→腔侧转运中,30 min时基底侧异鼠李亭和柽柳黄素的量高于腔侧,60~90 min 时腔侧面的含量超过基底侧,且这一趋势一直持续到150 min 孵育终点。也就是说,无论腔侧还是基底侧加载槲皮素,30~60 min 后腔侧的甲基槲皮素的量总是高于基底侧,其原因待深入研究。
本研究同时观察了P-pg 和MRP2 对槲皮素跨膜转运的影响。结果发现,P-gp 特效抑制剂CysA和MRP2 特效抑制剂MK571 均显著增加了槲皮素的透过量,提示P-gp和MRP2对槲皮素跨膜转运可能具有一定的影响。
综上所述,槲皮素在跨膜转运过程中的代谢转化有可能是影响其吸收和生物利用度的影响因素之一,外排蛋白P-pg和MRP2对其跨膜转运亦有一定的影响。在此基础上,深入研究槲皮素在肠道吸收过程中的代谢转化,以及这些代谢转化对槲皮素生物活性及跨膜吸收产生的影响具有重要意义。
