BimS过表达联合顺铂对体外培养人腺样囊性癌细胞系ACC-2增殖和凋亡的影响
2020-12-10吴海艳饶国洲李旭奎西安交通大学口腔医院口腔颌面外科西安70004西安交通大学口腔医院陕西省颅颌面精准医学研究重点实验室陕西省汉中市口腔医院通信作者maillixukuimailxjtueducn
吴海艳,姚 佳,饶国洲,李旭奎(西安交通大学口腔医院口腔颌面外科,西安 70004;西安交通大学口腔医院陕西省颅颌面精准医学研究重点实验室;陕西省汉中市口腔医院;通信作者,E-mail:lixukui@mail.xjtu.edu.cn)
涎腺腺样囊性癌(salivary adenoid cystic carcinoma,SACC)是涎腺第二常见恶性肿瘤,以持续的临床病程和不良的长期预后为主要特征[1]。尽管采用包括手术和放疗的多种治疗方法,约16%-85%患者仍出现局部复发或远处转移,而对这部分患者尚无有效的标准治疗方案[2]。据报道,姑息性化疗目前仅用于有症状或迅速进展的复发和/或转移性疾病的患者,对控制局部症状有改善,但总体应答率较低且远期疗效不明确[3,4]。Bim是Bcl-2家族中仅含一个BH3结构域的促凋亡蛋白,其BH3结构决定了Bim的促凋亡活性;Bim除了在调节机体正常稳态中发挥作用,还是调控肿瘤发生的的关键蛋白[5]。目前发现其有三种异构体即BimHL、BimL和BimS,其中BimS的促凋亡活性最高[6]。我们前期的实验通过构建转染BimS真核质粒,在ACC-2细胞中过表达BimS蛋白,观察到其对肿瘤细胞具有诱导凋亡作用[7]。为增强ACC-2细胞对化疗药物的敏感性、减少药物毒副作用,本研究进一步利用分子生物学技术BimS过表达联合常规化疗药物顺铂(DDP),探讨其对人涎腺腺样囊性癌细胞ACC-2抑制增殖和诱导凋亡的影响,为BimS协同化疗药物作为SACC的治疗靶点提供实验依据。
1 材料和方法
1.1 主要试剂与仪器
RPMI-1640、FBS、胰蛋白酶(美国Gibco公司);MTT、DMSO(美国Sigma公司);细胞凋亡检测试剂盒(美国Thermo Fisher公司);ACC-2细胞株(购于空军军医大学);BimS过表达的ACC-2细胞株(前期研究[7]通过构建人BimS基因GV230真核过表达质粒pGV-BimS,稳定转染ACC-2细胞、验证BimS过表达后冻存于本实验室);顺铂(江苏豪森公司);鼠抗人Bax、caspase-3、Bcl-2单抗(美国Santa Cruz公司),辣根酶标记的兔抗鼠IgG二抗(美国博士德公司),生物安全柜(海尔公司);台式离心机(美国Sigma公司);CO2培养箱、酶标分析仪(美国Thermo公司);倒置显微镜(日本Nikon公司);流式细胞仪(美国BD公司);蛋白电泳仪、自动凝胶成像分析仪(美国伯乐公司)。
1.2 方法
1.2.1 细胞培养 复苏ACC-2细胞和BimS过表达的ACC-2细胞于含有10%胎牛血清、1%青、链霉素的RPMI-1640完全培养基中,置于5% CO2、37 ℃培养箱中培养,待细胞生长至80%-90%时经胰蛋白酶消化传代培养。
1.2.2 细胞处理及分组 实验一:选取ACC-2对数生长期细胞,分别添加0,2.5,5,10,20 μg/ml顺铂处理,继续置于5% CO2、37 ℃培养箱中培养48 h。
实验二:分别选取ACC-2和BimS过表达的ACC-2对数生长期细胞(稳定转染pGV-BimS质粒48 h后),分为对照组(control组)、顺铂(DDP)组、BimS过表达组(BimS)和顺铂+BimS过表达(BimS+DDP)组。control组ACC-2细胞不作任何处理,DDP组、DDP+BimS组细胞中添加20 μg/ml顺铂处理,四组细胞置于5% CO2、37 ℃培养箱中继续培养48 h。
1.2.3 MTT检测各组细胞增殖能力 收集1.2.2中实验一及实验二细胞,消化后制备细胞悬液,调整细胞密度为1×104个/ml接种96孔板,每组设3个平行孔,各组细胞分别培养12,24,48 h,在避光条件下向每孔加入20 μl MTT溶液继续培养4 h,吸弃上清,每孔加入150 μl DMSO,振荡器混匀15 min,利用酶标仪检测各孔570 nm处吸光度A值。生长抑制率(%)=(1-实验组A值/对照组A值)×100%。
1.2.4 Western blot检测Bcl-2、Bax和caspase-3蛋白 收集1.2.2中实验二细胞用试剂盒提取总蛋白,经蛋白定量后做蛋白电泳,将蛋白转至PVDF膜,室温封闭1 h,洗膜,加入1 ∶500稀释的Bcl-2、Bax和caspase-3鼠抗人抗体,4 ℃过夜,洗膜后加1 ∶500稀释的带辣根过氧化物酶标记的兔抗鼠IgG二抗,室温孵育4 h,PBST洗膜,ECL发光检测,全自动凝胶成像系统分析。
1.2.5 流式细胞术检测各组细胞凋亡情况 收集1.2.2中实验二细胞,按5×103/孔将每组细胞接种到96孔培养板上培养,分别于12,24,48 h用0.25%胰酶消化离心收集各组细胞,调细胞数为1×106个/孔,PBS洗涤2次,加入100 μl Binding Buffer和10 μl Annexin Ⅴ-FITC(20 μg/ml),室温避光30 min,再将5 μl碘化丙啶(PI 50 μg/ml)加入各孔,避光反应5 min,加入400 μl Binding Buffer。同时以不加Annexin Ⅴ-FITC及PI的一管作阴性对照,立即上流式细胞仪检测。
2 结果
2.1 BimS过表达联合顺铂对细胞抑制率的影响
不同浓度顺铂显著抑制ACC-2细胞的增殖,呈现出剂量依赖性。不同浓度顺铂处理12,24,48 h细胞抑制率差异有统计学意义(P<0.01)。与12 h比较,不同浓度顺铂在24 h对细胞增值抑制率均明显提高(P<0.05),10 μg/ml组和20 μg/ml组在48 h对细胞抑制率显著提高(P<0.01),但不同浓度顺铂组24 h与48 h的细胞增殖抑制率比较,差异无统计学意义(P>0.05,见表1)。
本实验选用20 μg/ml顺铂药物浓度作为DDP组、BimS+DDP组的顺铂干预浓度。结果显示,与DDP组、BimS组比较,BimS+DDP组12,24,48 h细胞增殖抑制率均明显提高(P<0.01,见表2)。
2.2 BimS过表达联合顺铂对蛋白表达的影响
Western blot结果显示,与control组相比,DDP组和BimS组细胞的Bcl-2、Bax和caspase-3蛋白相对表达水平具有明显差异(P<0.05),BimS+DDP组蛋白表达差异也具有统计学意义(P<0.01)。与DDP组和BimS组相比,BimS+DDP组细胞中Bcl-2蛋白相对表达显著降低,Bax和caspase-3蛋白相对表达显著增高,差异有统计学意义(P<0.05,见图1,2)。
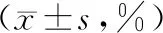
表1 不同浓度顺铂、作用时间对ACC-2细胞增殖抑制率的影响
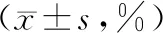
表2 BimS过表达联合顺铂对ACC-2细胞抑制率的影响
2.3 BimS过表达联合顺铂对细胞凋亡的影响
与control组相比,DDP组和BimS组处理细胞12,24,48 h细胞凋亡率均显著升高(P<0.01)。与DDP组和BimS组相比,BimS+DDP组处理细胞12,24,48 h细胞凋亡率均显著升高(P<0.01);且与12 h和24 h相比,在48 h细胞凋亡率达最高(P<0.05,见表3)。
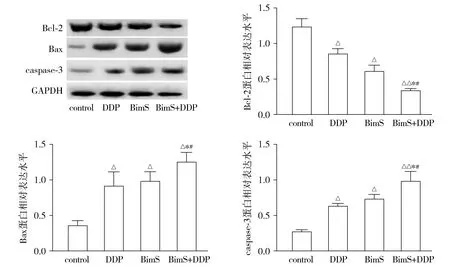
与control组相比,△P<0.05,△△P<0.01;与DDP组比较,*P<0.05;与BimS组比较,#P<0.05图1 Western blot检测各组Bcl-2、Bax、caspase-3蛋白相对表达水平Figure 1 Relative expression of Bcl-2, Bax and Caspase-3 protein in each group by Western blot
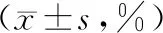
表3 各组细胞凋亡率比较
3 讨论
SACC是最常见的涎腺恶性肿瘤之一,也是口腔颌面部最具有特征的恶性肿瘤,虽然生长缓慢,却具有较强的浸润性和远处转移力[1]。对晚期复发转移且不能手术的患者,缺乏有效治疗手段,常规化疗药物的疗效也不尽理想[2,8]。因此,开发新的化疗药物、探索新的药物作用靶点、提高SACC对化疗药物的敏感性、提高远期疗效非常重要。
在生理和病理条件下,只有BH3结构域的Bim蛋白是启动内在凋亡通路的主要决定因素,它能够直接激活多域促凋亡蛋白Bax/Bak,或者通过BH3结构域竞争性与Bcl-2结合,从而释放Bax蛋白、激活线粒体途径的细胞凋亡[9]。Bim缺失或表达降低与肿瘤发生和免疫疾病有关[10];而Bim过表达能够抑制肿瘤生长及耐药性[11,12]。研究已发现Bcl-2和Bcl-xl蛋白在SACC中过表达[13],而与BimS共享BH3结构域的NOXA显著下调,并与更侵袭性表型和较差的总生存率显著相关[14]。近年来,大量的BH3模拟药物在多种肿瘤中显示出良好的前景,Acasigua等[15]则报道了BH3小分子拟合物能够抑制腺样囊性癌发生和复发。以上研究提示BimS可作为增强SACC细胞对化疗敏感性的靶点。本研究探讨BimS过表达蛋白是否能增强顺铂对ACC-2细胞的抗肿瘤活性,结果显示:虽然BimS过表达和顺铂对ACC-2细胞均有一定的抑制增殖和诱导凋亡作用,但BimS过表达蛋白联合顺铂对ACC-2细胞的生长抑制作用及诱导凋亡作用均明显高于两者的单一作用(P<0.01),BimS过表达蛋白联合顺铂48 h细胞凋亡率可最高达(32.31±0.58)%。
此外,BimS过表达联合顺铂组Bcl-2蛋白表达显著降低,同时Bax和caspase-3蛋白表达增加,与顺铂组和BimS过表达两组比较均有统计学差异(P<0.05)。大量研究表明,当Bcl-2蛋白表达增高与Bax形成二聚体抑制Bax活性时阻断cyt-C的释放抑制下游caspase-3的激活从而抑制细胞凋亡的发生[16,17]。因此,我们推测通过BimS过表达活化Bax蛋白或拮抗Bcl-2活性促进Bim信号通路启动细胞凋亡线粒体途径从而使ACC-2诱导发生凋亡。提示诱导BimS蛋白表达药物能够提高SACC对化疗药物顺铂的敏感性。因此,深入探讨BimS在SACC中的表达变化及其协同现有抗癌药物和化疗药物的作用关系和分子机制,有望为SACC的临床治疗提供新的作用靶点。
