外源性膜联蛋白A5对胃癌细胞增殖、凋亡和迁移的影响
2020-12-10代雅蕊张佳璐王小杰赵依纳承德医学院基础医学研究所承德067000河北生殖妇产医院生殖医学科承德医学院组织学与胚胎学教研室通信作者mailhbcdlxcdmceducn
代雅蕊,张佳璐,王小杰,赵依纳,王 欢,李 欣(承德医学院基础医学研究所,承德 067000;河北生殖妇产医院生殖医学科;承德医学院组织学与胚胎学教研室;通信作者,E-mail:hbcdlx@cdmc.edu.cn)
胃癌是世界范围内最常见的恶性肿瘤之一[1],在中国,尽管发生率和死亡率一直在稳步下降,但胃癌仍是仅次于肺癌的第二大新诊断癌症病例和因癌症死亡的主要原因[2]。目前,胃癌的治疗主要以外科手术为主,辅以化疗、靶向治疗、支持治疗的综合治疗[3],但由于大多数患者晚期发现有广泛浸润和淋巴转移,胃癌的治疗效果仍然较差[1]。寻找能够影响胃癌细胞增殖、凋亡和迁移的生物制剂成为亟需解决的问题。
ANXA5属于膜联蛋白基因超家族[4],能钙依赖性地对磷脂酰丝氨酸产生极高的亲和力,同时有膜修复、抗凝血、抗炎症等多种生物学功能[5],对药物研制表现出了较大的临床潜力。大量研究表明ANXA5在多种肿瘤中表达改变并影响了肿瘤细胞的恶性行为,Zhang等[6]报道ANXA5可抑制小鼠黑色素瘤的生长。本课题组研究发现膜联蛋白A5(annexin A5,ANXA5)对胃癌的发生发展有一定影响[7-9]。但ANXA5蛋白是否可通过外源性添加的方式来影响胃癌细胞,目前还鲜有报道。
本研究中,我们将ANXA5蛋白外源性作用于人胃癌细胞系MGC-803细胞,检测其增殖、凋亡和迁移性能,并对与肿瘤转移密切相关的钙黏蛋白E-cadherin和基质金属蛋白酶MMP-9的表达进行了检测,可望为临床治疗胃癌提供新思路、新方法。
1 材料与方法
1.1 材料
人胃癌细胞系MGC-803细胞购自中国科学院上海细胞库,细胞培养基(RPMI-1640)及胎牛血清购自美国Gibco公司。ANXA5蛋白冻干粉、MTT增殖及细胞毒性检测试剂盒、RIPA裂解液与5×蛋白上样缓冲液(loading buffer)分别购自武汉云克隆科技股份有限公司、碧云天公司、上海Bebo Biotech公司。BCA蛋白定量试剂盒、PI染液购自北京索莱宝科技有限公司。E-cadherin、MMP-9、β-actin兔抗人单克隆抗体购自美国Abcam公司,PCNA鼠抗人单克隆抗体购自武汉三鹰生物科技有限公司。
1.2 方法
1.2.1 细胞培养 将MGC-803细胞在含有10%胎牛血清的RPMI-1640培养基中进行培养,并置于5%CO2、37 ℃的HER Aceu150细胞培养箱(购自德国贺利公司)内孵育。第2天更换培养基,当细胞密度达到80%-90%,将其用0.25%的胰蛋白酶消化后传代,实验取对数生长期细胞,并在实验处理前1 d对细胞进行换液。
1.2.2 ANXA5蛋白培养液的制备 将1 ml经高压过的超纯水加入ANXA5蛋白冻干粉试剂瓶中,制备成0.1 mg/ml的贮存液,通过0.22 μm微孔滤膜过滤除菌并分装,储存在-80 ℃中以供使用。使用时将贮存液加入含10%胎牛血清的培养基中配制所需浓度的ANXA5蛋白培养液。
1.2.3 ANXA5蛋白应用浓度测定及分组 将MGC-803细胞制备成浓度为2×104/ml的细胞悬液,每孔100 μl接种于96孔板中。培养24 h利用0,20,40,80,160 nmol/L浓度梯度的ANXA5蛋白培养液对细胞进行处理,每个浓度设置3个复孔,作用24 h检测细胞在不同ANXA5蛋白浓度下的细胞活力,测量其OD值并应用SPSS计算IC50的方法[10]求得IC50值为42 nmol/L,以此为ANXA5蛋白应用浓度。实验分为两组:外源ANXA5组应用42 nmol/L ANXA5蛋白培养液进行培养,空白对照组应用含有10%胎牛血清的RPMI-1640培养基进行培养。两组细胞分别通过形态学观察、MTT实验、PI荧光染色法、细胞划痕实验,以及PCNA、MMP-9、E-cadherin蛋白表达情况检测ANXA5对MGC-803细胞增殖、凋亡和迁移的影响。
1.2.4 形态学观察 以每孔3×105个细胞数量将MGC-803细胞接种于6孔板中,2 ml培养基进行培养。待24 h细胞贴壁后用2 ml ANXA5蛋白培养液和等量培养基分别对两组细胞进行处理,培养24 h将两组细胞置于倒置显微镜下观察细胞的形态学变化,并进行拍照。
1.2.5 MTT实验检测细胞增殖 收集MGC-803细胞,将细胞密度调整为2×104/ml,每孔100 μl接种于96孔板中。实验分为外源ANXA5组和空白对照组,每个时间点设5个复孔,边缘孔用RPMI-1640培养基进行填充。置于培养箱约24 h待细胞贴壁后将原培养基弃掉,将100 μl ANXA5蛋白培养液添加到外源ANXA5组中,将等量培养基添加到空白对照组中,处理后将细胞置于细胞培养箱中培养0,24,48,72 h时,每孔加入MTT(5 mg/ml)溶液10 μl,进一步培养4 h,将上清培养基弃掉并取150 μl DMSO加入到每孔中。待作用10 min后,使用MK3酶联免疫检测仪(购自美国Thermo公司)测定每孔在波长490 nm下的吸光度值(OD值)。
1.2.6 PI荧光染色法检测细胞凋亡 在96孔板中每孔接种2×103个细胞并于100 μl培养基中培养24 h,将外源ANXA5组培养基更换为100 μl ANXA5蛋白培养液,并为空白对照组更换等量新的培养基,继续培养24 h,行PI荧光染色法[11]。将PI染液加入培养基中进行染色,在37 ℃下避光孵育10 min,用PBS溶液洗涤2次,然后在配备有紫外滤光片的Nikon 80i荧光显微镜(购自日本东京尼康公司)下观察细胞,每组随机选择5个视野进行图像采集并计数凋亡细胞。
1.2.7 细胞划痕实验检测细胞迁移 取MGC-803细胞接种于6孔板(3×105/孔)中,于2 ml培养基中培养24 h,细胞贴壁状态良好且细胞数量达60%时,弃掉原来培养基,用无菌1 ml枪头尖端在6孔板上进行划痕,无菌PBS溶液轻轻冲洗2次。将2 ml ANXA5蛋白培养液添加到外源ANXA5组中,将等量培养基添加到空白对照组中,继续培养0,12,24,48,72 h,分别观察细胞的迁移情况并拍照记录。
1.2.8 Western blot法检测PCNA、MMP-9、E-cadherin蛋白表达 取MGC-803细胞以4×105/皿细胞数量分别接种于2个6 cm的细胞培养皿中,24 h待细胞长到60%-70%时,外源ANXA5组、空白对照组分别用ANXA5蛋白培养液和含10%胎牛血清的RPMI-1640培养基进行培养,每皿各3 ml。处理后将细胞置于细胞培养箱中培养24 h,每皿加入210 μl裂解液,对总蛋白进行提取并通过BCA法定量蛋白。将蛋白与5×上样缓冲液混合,在沸水中煮沸10 min,室温放置待冷却后放入-20 ℃冰箱储存。配置15% SDS-PAGE凝胶进行上样电泳(电压80-120 V,2 h),湿转法转膜(电压80 V,70 min)后,用5%脱脂奶粉封闭3 h,加入E-cadherin、MMP-9兔抗人单克隆一抗(1 ∶500),β-actin兔抗人单克隆一抗(1 ∶1 000),及PCNA鼠抗人单克隆一抗(1 ∶10 000)后孵育2 h,放入4 ℃冰箱过夜。第2天均以15,10,5 min时间间隔TBST洗膜后加入一抗所对应羊抗兔、羊抗鼠二抗(1 ∶5 000)孵育80 min,之后均以10,10,10 min时间间隔TBST洗膜,并使用Tanon 6100化学发光仪(购自上海天能公司)进行显影。
1.3 统计学方法
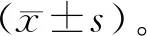
2 结果
2.1 形态学变化
外源ANXA5组将ANXA5蛋白外源性作用于MGC-803细胞24 h,细胞数量减少、贴壁不牢,细胞培养液中悬浮细胞明显增多,倒置显微镜下观察细胞明显变圆,细胞间隙变大,胞浆呈空泡状,细胞碎片增多(见图1)。
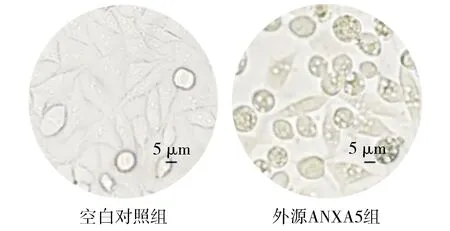
图1 ANXA5蛋白对MGC-803细胞的形态学影响(×1 000)Figure 1 Effect of ANXA5 protein on the morphology of MGC-803 cells (×1 000)
2.2 ANXA5蛋白对MGC-803细胞增殖的影响
将ANXA5蛋白外源性作用于MGC-803细胞后,经MTT法测定,对两组OD值进行比较,结果见图2。与空白对照组相比,外源ANXA5组24,48,72 h均表现出增殖抑制作用,差异有统计学意义(24 h:P<0.05;48 h和72 h:P<0.001)。
与空白对照组相比,*P<0.05,***P<0.001图2 ANXA5蛋白抑制MGC-803细胞的增殖Figure 2 Exogenous ANXA5 protein inhibits proliferation of MGC-803 cells
2.3 ANXA5蛋白对MGC-803细胞凋亡的影响
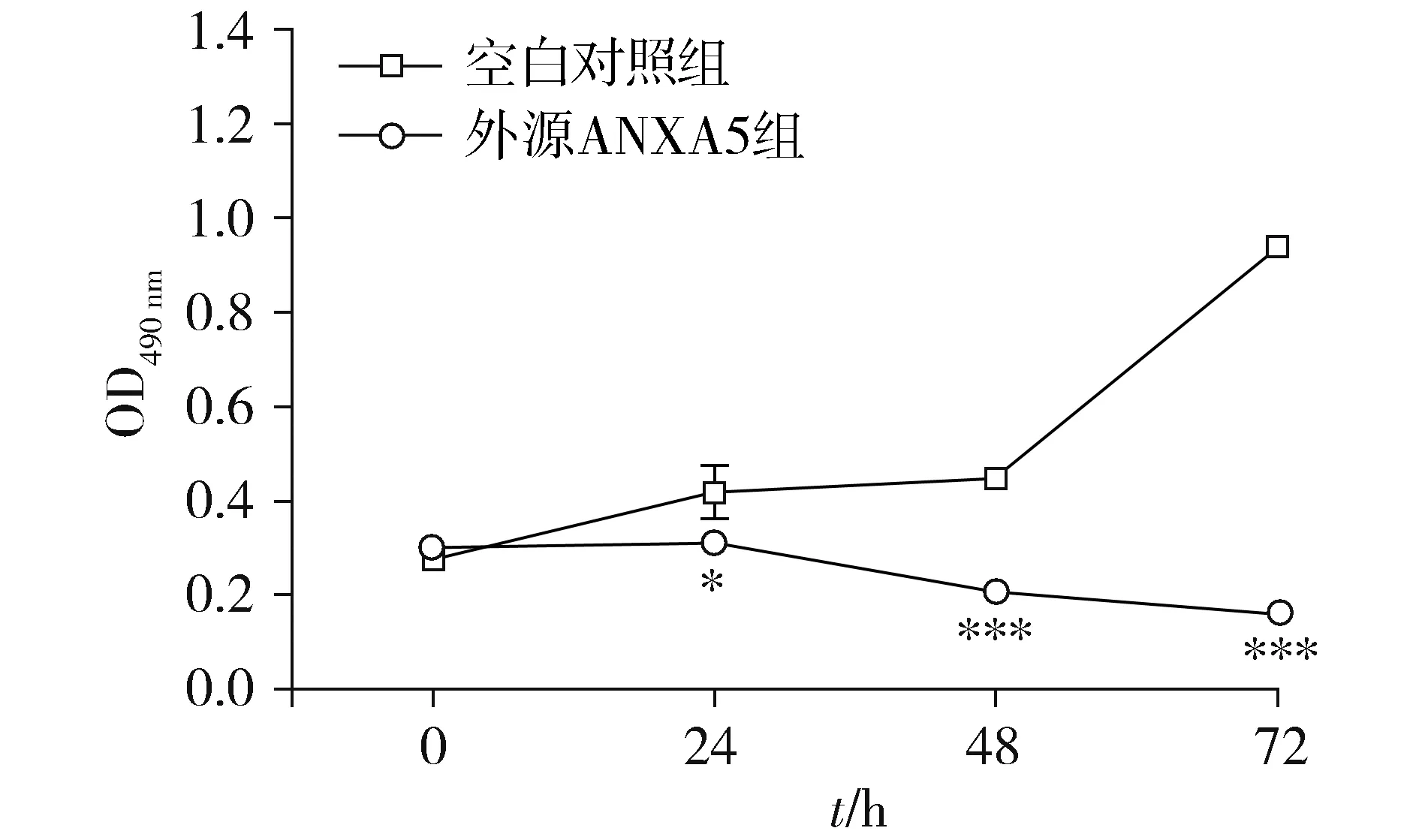
在荧光显微镜下对两组经PI染料染色的细胞进行观察可以得出:外源ANXA5组有红色荧光着色的细胞明显多于空白对照组,将ANXA5蛋白外源性作用于MGC-803细胞24 h,凋亡细胞的数量与空白对照组比较明显增加(P<0.001,见图3)。
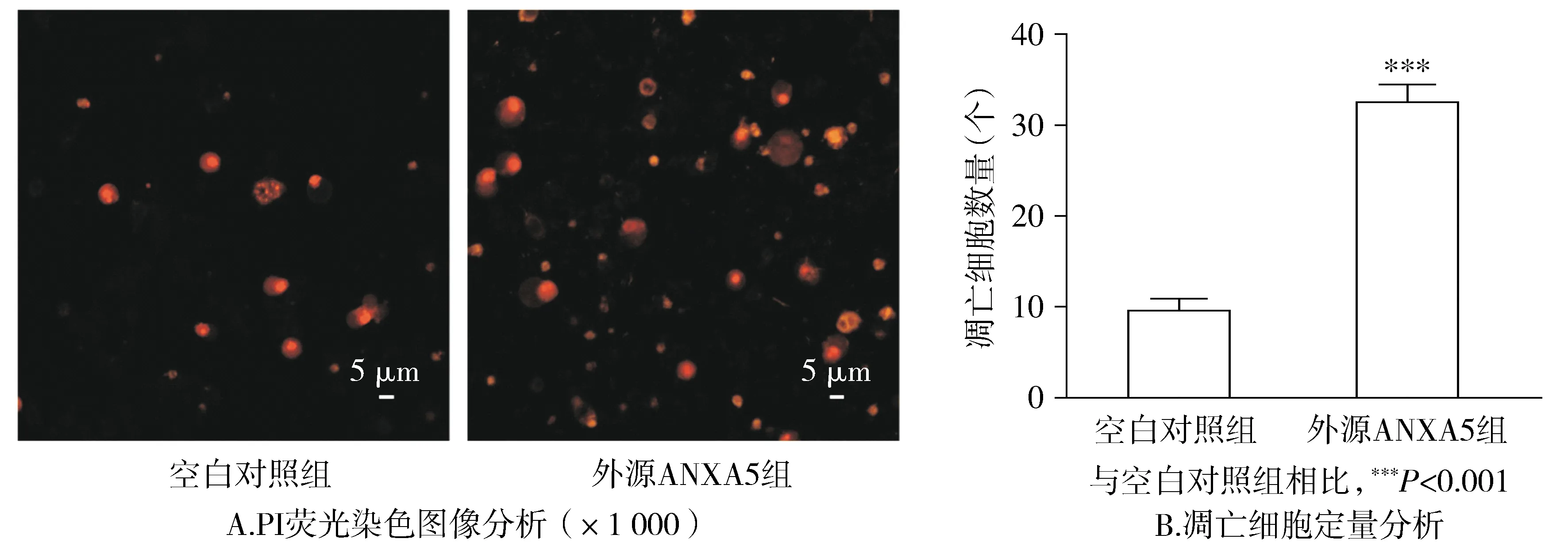
图3 PI荧光染色法检测ANXA5蛋白对MGC-803细胞凋亡的影响Figure 3 Effect of ANXA5 protein on apoptosis of MGC-803 cells by PI staining
2.4 ANXA5蛋白对MGC-803细胞迁移的影响
ANXA5蛋白外源性作用于外源ANXA5组MGC-803细胞0,12,24,48,72 h拍照记录细胞的迁移情况,结果见图4。划痕两侧细胞的距离为愈合距离,通过计算愈合率,两组进行比较可知,0 h和12 h两组愈合率差异无统计学意义(P>0.05),24,48,72 h两组愈合率差异有统计学意义(P<0.05)。结果表明,ANXA5蛋白抑制了胃癌MGC-803细胞的迁移能力。
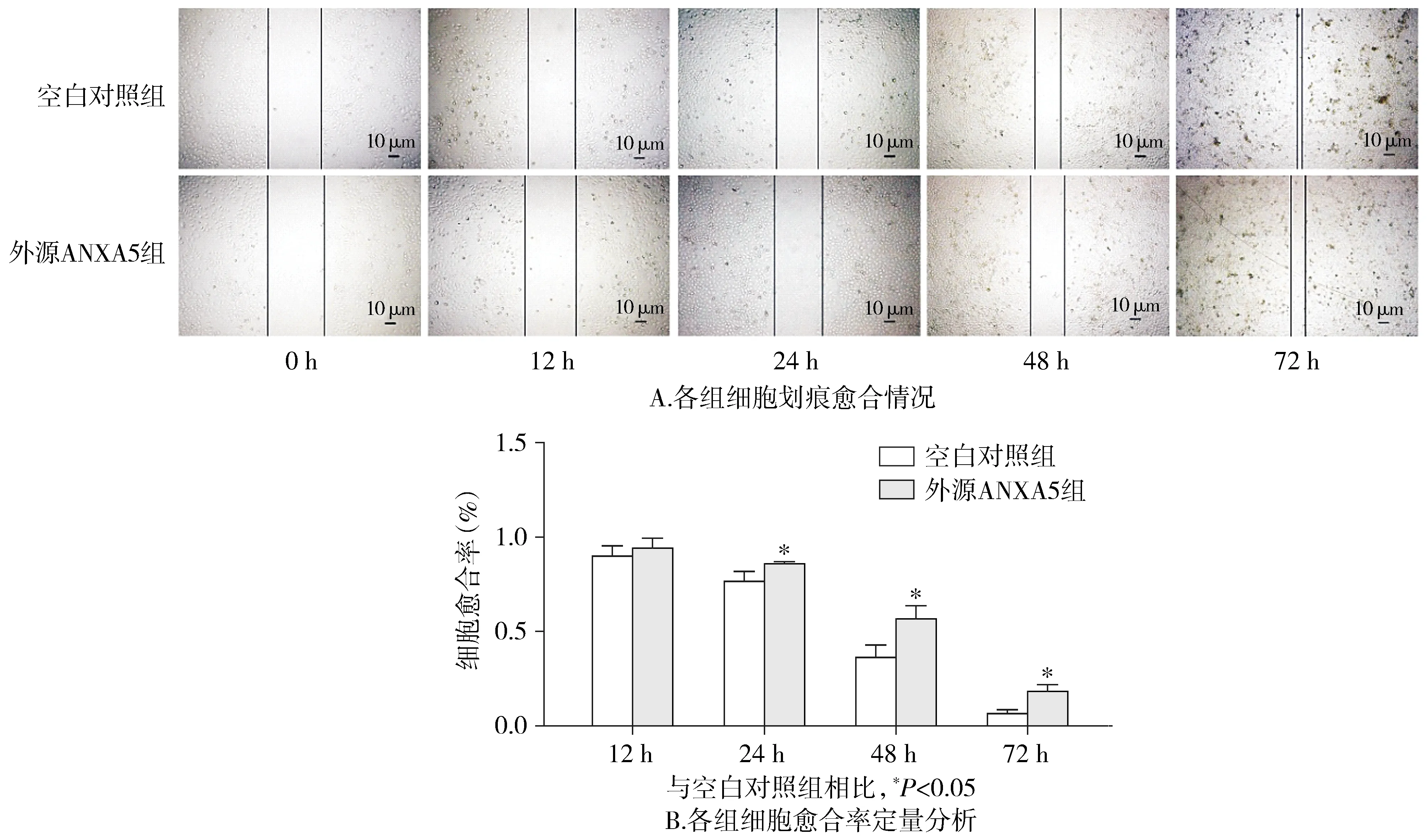
图4 ANXA5蛋白抑制MGC-803细胞的迁移Figure 4 Exogenous ANXA5 protein inhibits migration of MGC-803 cells
2.5 ANXA5蛋白对MGC-803细胞PCNA、MMP-9、E-cadherin表达的影响
ANXA5蛋白外源性作用于MGC-803细胞后,PCNA、MMP-9和E-cadherin蛋白表达见图5。经灰度值分析显示,外源ANXA5组增殖相关蛋白PCNA的蛋白表达量比空白对照组低(0.315±0.049vs0.498±0.061,P<0.05)。EMT相关蛋白MMP-9蛋白表达量较空白对照组降低(0.556±0.645vs0.722±0.080,P<0.05);EMT相关蛋白E-cadherin蛋白表达量比空白对照组高(0.826±0.093vs0.417±0.103,P<0.01)。结果说明ANXA5蛋白抑制了胃癌MGC-803细胞PCNA和MMP-9的表达,促进了E-cadherin的表达。
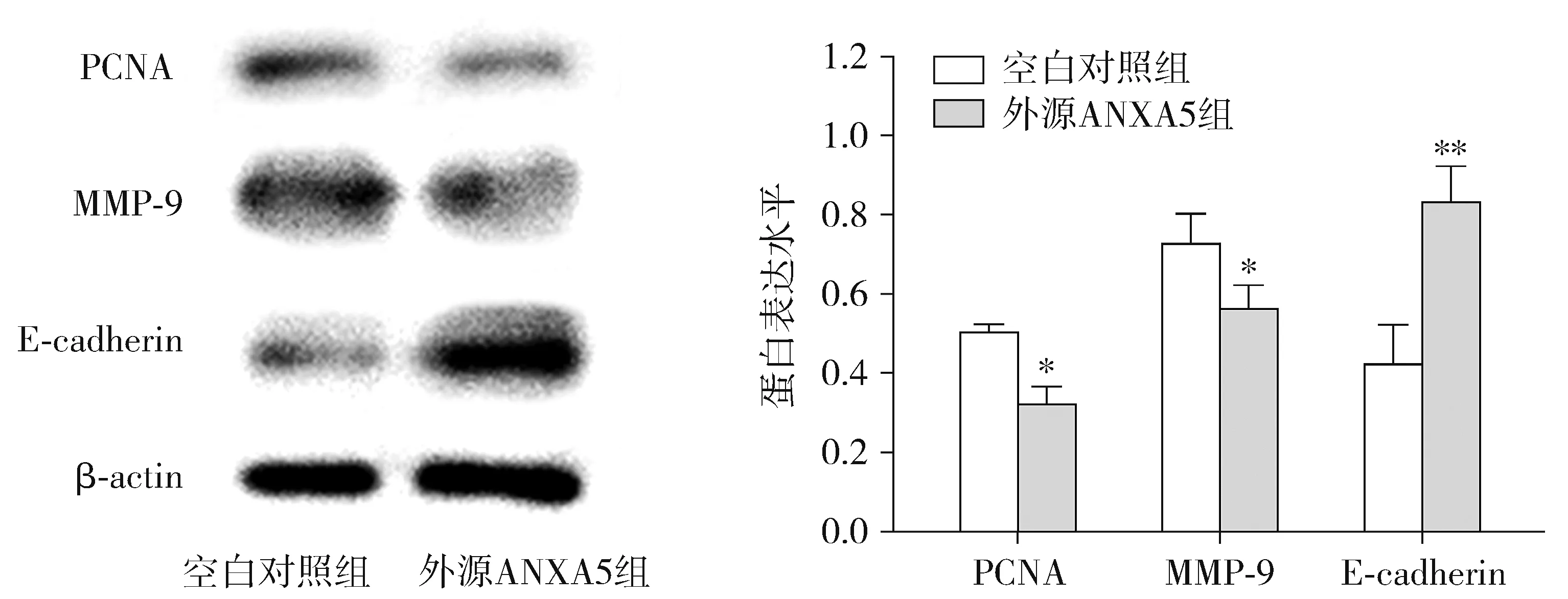
与空白对照组相比,*P<0.05,**P<0.01图5 Western blot检测PCNA,MMP-9,E-cadherin蛋白的表达改变Figure 5 Expression of PCNA, MMP-9, E-cadherin protein by Western blot
3 讨论
膜联蛋白A5(ANXA5),也被称为胎盘抗凝蛋白Ⅰ、凝血活酶抑制剂Ⅴ、内联蛋白Ⅱ、钙磷脂结合蛋白Ⅰ和脂皮素Ⅴ,是膜联蛋白家族的成员。其基因位于人类染色体4q26-q28上,编码具有319个氨基酸的非糖基化单链蛋白,ANXA5的分子量为35.7 kD[4,12]。越来越多的证据证实其异常表达与多种恶性肿瘤的生物学行为关系密切[13],参与了肿瘤细胞增殖、凋亡、迁移和侵袭过程中的多个环节。Ding等[14]研究发现,抑制ANXA5的表达可显著降低人胆管癌QBC-939细胞的增殖、迁移和侵袭能力,并增加其凋亡。但Li等[15]研究发现,ANXA5过表达可能抑制了人宫颈癌细胞的增殖和转移,Liu等[16]的研究发现,ANXA5促进了人喉表皮样癌Hep-2细胞的凋亡。ANXA5兼具的促瘤和抑瘤作用,引起课题组对ANXA5研究的很大兴趣。
那么ANXA5在胃癌细胞中扮演了什么样的角色?在现有的研究中,敲低ANXA5的表达水平后,促进了人胃癌细胞系MKN-45细胞的增殖[7],并可能通过调控人胃癌细胞系HGC-27细胞中Galectin-3的表达抑制细胞增殖[8],这些提示ANXA5表达的增加可能会抑制胃癌的发生发展。基于此,我们猜想ANXA5蛋白是否可通过外源性添加的方式来影响胃癌细胞呢?
本研究将ANXA5蛋白外源性作用于人胃癌细胞系MGC-803细胞后,细胞数量减少、贴壁不牢,细胞培养液中悬浮细胞明显增多,同时发生了明显的形态学变化,细胞明显变圆,细胞间隙变大,胞浆呈空泡状,细胞碎片增多,我们猜测ANXA5蛋白可能抑制了MGC-803细胞的增殖并诱导其凋亡。通过MTT实验和与细胞增殖有关的增殖细胞核抗原(PCNA)蛋白表达结果我们得知,ANXA5蛋白对MGC-803细胞的增殖有明显的抑制作用。ANXA5蛋白虽因与磷脂酰丝氨酸结合的特性被广泛用作细胞凋亡的测定方法,但很少有关于其在细胞凋亡中潜在作用的信息[17]。故我们采用PI荧光染色法检测了ANXA5蛋白对MGC-803细胞凋亡的影响。当细胞处于坏死或晚期凋亡时,PI染料可以通过被破坏的细胞膜与核DNA结合,使细胞在荧光显微镜下发出红色荧光,而PI染料无法通过正常的细胞膜使细胞核着色[18],染色结果显示,外源ANXA5组较空白对照组细胞呈现了更明显的凋亡现象,经ANXA5蛋白培养液处理的细胞,凋亡细胞数量明显增多,提示其对胃癌细胞凋亡产生了积极影响。
在初步探讨了ANXA5蛋白对MGC-803细胞的增殖和凋亡作用后,探索其是否会限制癌细胞的迁移显得十分重要。细胞划痕实验结果表明,外源ANXA5组细胞的迁移能力明显降低,在蛋白水平上也得到证实。E-cadherin是一种钙依赖性跨膜蛋白,在上皮组织中主要介导细胞间以及细胞-基质的黏附反应,在维持组织结构完整性方面发挥重要作用[19],其是上皮间质转化(EMT)发生的一种标志物和影响肿瘤细胞转移的关键因子[20]。EMT是肿瘤细胞迁移和侵袭的关键调控机制,在肿瘤进展期间EMT被重新激活[21],部分上皮细胞间连接丧失,失去游离面-基底面极性,从而获得迁移性和侵袭性[22]。ANXA5蛋白可能通过上调E-cadherin的表达从而抑制EMT,进而抑制肿瘤细胞的迁移能力。而MMP-9表达水平的降低也佐证了这一实验结果,基质金属蛋白酶(MMPs)能降解和重塑细胞外基质(ECM)[23],在肿瘤的发生发展过程中发挥着重要作用,其中MMP-9对EMT有辅助作用[24],MMP-9表达降低可减少肿瘤细胞的迁移。这些结果表明,ANXA5蛋白可抑制MGC-803细胞的迁移性能,从而影响胃癌的发生发展。
本实验一方面为进一步研究ANXA5在人胃癌中的作用提供了实验依据,另一方面证实ANXA5蛋白可以抑制人胃癌细胞的增殖和迁移,对细胞凋亡具有促进作用,可望促进胃癌药物的开发并改善胃癌患者的治疗。虽初步探讨了ANXA5蛋白可能是通过对E-cadherin和MMP-9的调控作用进而影响细胞的迁移,但其在信号通路中的详细作用机制尚未完全阐明。接下来我们将着重研究ANXA5对细胞侵袭性能的影响及探讨其影响胃癌细胞增殖、凋亡、迁移和侵袭的确切机制。
