RyhB-cysE基因对禽致病性大肠杆菌生物表型的影响
2020-12-09涂健阮苑蔡伟真宋祥军邵颖祁克宗
涂健 阮苑 蔡伟真 宋祥军 邵颖 祁克宗


摘要:在禽致病性大肠杆菌(APEC)AE17及AE17△RyhB的基础上利用Red同源重组技术构建基因缺失株AE17△cysE、AE17△RyhB△cysE, 对野生株和基因缺失株的生长、生物被膜形成和运动特性进行分析,并采用qRT-PCR技术比较野生株和缺失株中与运动性、生物被膜形成相关基因的转录水平。结果显示,各菌株生长曲线无显著差异;AE17△RyhB、AE17△cysE、AE17△RyhB△cysE生物被膜形成能力较AE17显著下降;AE17△cysE 、AE17△RyhB△cysE运动能力与AE17相比下降;AE17△cysE、AE17△RyhB△cysE与AE17相比flhB 、flgD、fliF和 cheY转录水平均降低,而AE17△RyhB△cysE与AE17△cysE相比基因转录水平均有所增强;AE17△RyhB、AE17△cysE、AE17△RyhB△cysE与AE17相比,flhD 、flgC、sidA转录水平均显著降低。表明cysE基因缺失降低了APEC生物被膜形成能力及运动能力,且RyhB基因缺失对cysE基因的运动能力调控作用有代偿作用,RyhB、cysE基因均通过调节与生物被膜形成相关的基因(flhD 、flgC、sidA)转录水平调控APEC生物被膜形成能力,本研究结果为研究RyhB-cysE基因对APEC的调控作用奠定了基础。
关键词:禽致病性大肠杆菌;RyhB基因;cysE基因;生物被膜;运动性
中图分类号:S851.3文献标识码:A文章编号:1000-4440(2020)05-1247-08
Abstract:Based on avian pathogenic Escherichia coli (APEC) AE17 and AE17△RyhB, gene-deleted strains AE17△cysE and AE17△RyhB△cysE were constructed using Red homologous recombination technology. The growth, biofilm formation and motion characteristics of wild and gene-deleted strains were analyzeds and qRT-PCR technology was used to compare the transcription levels of genes related to motility and biofilm formation in wild and gene-deleted strains. The results showed that there was no significant difference in the growth curve of each strain. The biofilm formation ability of AE17△RyhB, AE17△cysE, AE17△RyhB△cysE was significantly lower than that of AE17. Compared with AE17, the transcription levels of flhB, flgD, fliF and cheY in AE17△cysE and AE17△RyhB△cysE were reduced, while AE17△RyhB△cysE had enhanced gene transcription levels compared with AE17△cysE. The AE17△RyhB, AE17△cysE, AE17△RyhB△cysE and AE17 flhD, flgC and sidA were significantly reduced. The results indicated that the deletion of cysE gene reduced the ability of APEC biofilm formation and exercise, and RyhB gene had a compensatory effect on the regulation of cysE gene's exercise capacity. RyhB and cysE genes regulated the biofilm formation ability of APEC by regulating transcription level of genes(flhD, flgC and sidA) related to biofilm formation. These results of this study lay a foundation for studying the regulatory effect of RyhB-cysE gene on APEC.
Key words:avian pathogenic Escherichia coli;RyhB gene;cysE gene;biofilm;motility
禽致病性大腸杆菌(Avian pathogenic Escherichiacoli,APEC)是肠外致病性大肠杆菌,可以导致禽类出现全身性感染,严重影响全球养禽业。同时APEC 可以通过食源性途径传播给人类,是人源肠外致病性大肠杆菌毒力基因的潜在贮存宿主。加强对APEC研究,不仅有助于养禽业的发展,也具有较大的公共卫生学意义[1]。在大肠杆菌研究中,已经证明小分子RNA参与了诸多生命过程,其中包括转录翻译调控、铁代谢途径、糖代谢途径、膜蛋白生物合成、群体感应系统以及致病菌的致病力调节等。而RyhB作为小分子RNA,是目前已知调控的靶mRNA数目最多,其作为关键组成部分参与大肠杆菌诸多调控网络,在细菌的致病过程中发挥着重要作用[2]。本试验前期已构建AE17 △RyhB并进行Label-free蛋白组学测序及生物信息学预测,筛选出RyhB基因与RNA 伴侣 Hfq共同靶基因cysE[2]。
CysE(Serine acetyltransferase)蛋白属于转移酶家族的酰基转移酶,在微生物中参与合成半胱氨酸。在代谢调控系统中,半胱氨酸主要参与抵制细胞代谢中硫化物的进入,同时半胱氨酸是一些生物元件合成途径所必需的元素,例如甲硫氨酸、一些维生素和金属簇等均由半胱氨酸参与合成。这个蛋白质不仅参与半胱氨酸合成反应,同时也参与蛋氨酸代谢、硫代谢等[3],对微生物的生长至关重要。
本研究利用 Red 重组技术在AE17、 AE17△RyhB的基础上,进一步构建了基因缺失株AE17△cysE、AE17△RyhB△cysE,并比较它们的生长曲线、运动性、生物被膜形成能力等生物学特性差异,并采用qRT-PCR技术比较野生株和缺失株中与运动性、生物被膜形成相关基因的转录水平,为研究RyhB-cysE基因对APEC的调控作用以及揭示APEC的致病机理奠定基础。
1材料与方法
1.1主要试验材料
1.1.1菌种、质粒及试剂APEC AE17,为本实验室保存的O2血清型临床分离株;AE17△RyhB由本实验室前期构建[4]。Red同源重组辅助质粒:pKD46(氨苄青霉素抗性)、pKD3(携带可被FLP重组酶识别的FRT位点,氯霉素抗性)、pCP20(42 ℃可表达FLP重组酶,用于消除FLP位点间的氯霉素抗性基因)均由安徽农业大学兽医病理生物学与疫病防控安徽省重点实验室保存。氯霉素、氨苄青霉素、酵母提取物、胰蛋白胨、氯化钠、琼脂糖、质粒小量提取纯化试剂盒均购自生工生物工程(上海)股份有限公司;高保真酶Phanta Super-Fidelity DNA Polymerase、 AceQ qPCR SYBR Green Master Mix购自诺唯赞生物科技有限公司。
1.1.2引物的设计与合成根据 GenBan登录的APEC cysE基因序列(ID:4493517),分别设计用于扩增cysE基因上游、下游序列2对引物cysE-U-F/cysE-U-R和cysE-D-F/cysE-D-R。用于扩增抗性基因的引物:cysE-cm-F/cysE-cm-R;设计的用于鉴定RyhB、cysE基因缺失株的2对引物:cysE-IN-F/cysE-IN-R、cysE-OUT-F/cysE-OUT-R、RyhB-IN-F/RyhB-IN-R、RyhB-OUT-F/RyhB-OUT-R。以上引物(表1)均由合肥通用生物科技有限公司合成。
1.2试验方法
1.2.1AE17△cysE、AE17△RyhB△cysE构建与鉴定以AE17、AE17△RyhB为亲本株,使用改良的Red重组方法[5-6]构建cysE基因缺失菌株。以提取的AE17、AE17△RyhB基因组为模板,分别使用引物cysE-U-F/cysE-U-R和cysE-D-F/cysE-D-R,通過PCR扩增cysE基因的上游和下游片段。以pKD3为模板,用引物cysE-cm-F/cysE-cm-R通过PCR扩增氯霉素抗性(Cm+)片段。以上述纯化的PCR产物为模板,以cysE-U-F/cysE-D-R为引物,采用Overlap-PCR技术,PCR扩增用于cysE基因缺失的打靶片段。将构建的打靶片段电转化至含有pKD46质粒的AE17、AE17△RyhB感受态细胞中,重组细菌在37 ℃培养1 h后涂布于含有30 μg/ml Cm+的LB平板上,孵育24 h后,挑取单克隆,用cysE-IN-F/cysE-IN-R、cysE-OUT-F/cysE-OUT-R引物PCR鉴定cysE基因缺失株,利用pCP20质粒将cysE基因缺失株氯霉素抗性消除并测序,鉴定成功的阳性重组子菌株为AE17△cysE、AE17△RyhB△cysE。
1.2.2各菌株生长曲线测定将AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE 4 株菌分别接种到LB平板,从平板上挑取单菌落接种到LB液体培养基中振荡培养,每隔1 h测其600 nm吸光度OD600值,根据OD600值绘制上述菌株的生长曲线。上述试验重复3次。
1.2.3各菌株生物被膜形成能力测定将AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE菌株分别培养至OD600=1.0,用LB液体按照1∶50(体积比)稀释菌液,加入到96孔聚丙烯板中,每孔200 μl,以无菌培养基作为空白对照组,每组3个重复。28 ℃培养48 h,每孔加入200 μl PBS洗涤3遍,晾干后每孔加入200 μl 0.1%结晶紫溶液,37 ℃染色20 min,PBS 洗涤3遍,晾干,每孔加入200 μl 33%乙酸,充分溶解后,酶标仪测定每孔样本620 nm处的吸光度 OD620值,并通过 GraphPad Prism 6 paired t检验分析数据。
1.2.4扫描电镜观察各菌株生物被膜在6孔细胞板中放入细胞爬片,分别加入2 ml含量为108CFU/ml的AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE菌液,在37 ℃培养箱中静置培养48 h。将培养的细胞爬片取出,PBS清洗3遍,晾干,细胞爬片经过固定、脱水、干燥、黏台、喷金处理后用扫描电镜观察。
1.2.5各菌株运动性测定将AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE菌株分别培养至OD600=1.0,4 000 r/min离心10 min,弃去培养基用无菌PBS缓冲液调整OD600=2.0,配制新鲜运动性培养基(每100 ml含有1.00 g蛋白胨、0.50 g氯化钠、0.80 g葡萄糖、0.25 g琼脂粉),待冷却后在板的中央加入2 μl菌体,置于37 ℃培养箱静置培养6~8 h,观察细菌运动情况并测量菌圈大小。
1.2.6透射电镜观察各菌株鞭毛形态将上述4株菌分别培养至OD600=1.0,2 000 r/min离心10 min,弃去培养基并用无菌PBS缓冲液洗3次,最后用PBS重悬,吸取200 μl重悬液经负染处理后用透射电镜观察。
1.2.7各菌株运动性、生物被膜相关基因转录水平检测参照文献[7],选取与细菌运动性、生物被膜相关基因 fliY、 flhB、flgD、fliF、fliM、 cheY、 flhD、 flhC、sidA,16S作为内参基因,分别设计引物(表2),进行qRT-PCR检测缺失株与野生株基因的转录水平差异。参照文献[8]的方法,将上述4株菌培养至对数中前期,各取1 ml 菌液提取mRNA,利用反转录试剂盒反转录为cDNA,并以相应的cDNA为模板。反应条件为:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,40 个循环。采用2-△△Ct (Livak)法分析并计算各目的基因转录水平[9]。
2结果与分析
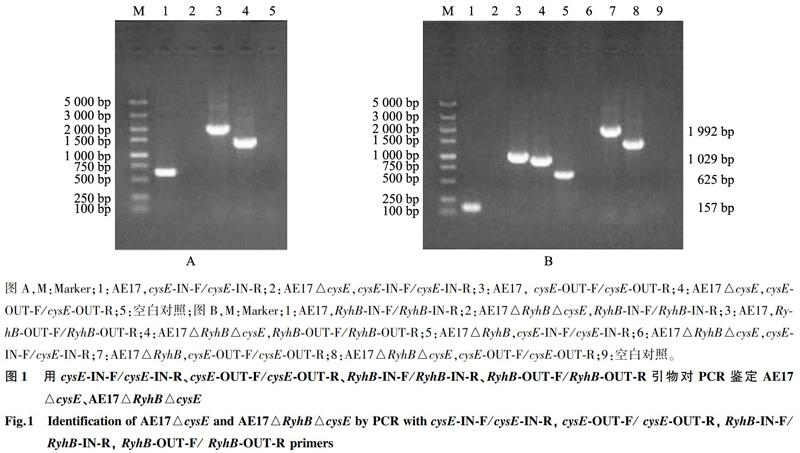
2.1AE17△cysE、AE17△RyhB△cysE的鉴定
采用Red同源重组的方法构建cysE基因缺失株,通过特异性引物进行PCR鉴定。以cysE-IN-F/cysE-IN-R为引物,AE17、AE17△RyhB扩增出625 bp的cysE基因片段,cysE基因缺失株(AE17△cysE、AE17△RyhB△cysE)扩增不出目的片段(图 1)。以cysE-OUT-F/cysE-OUT-R为引物,AE17、AE17△RyhB扩增出1 992 bp目的片段,AE17△cysE、AE17△RyhB△cysE扩增出1 303 bp目的片段(图 1),测序结果表明AE17△cysE、AE17△RyhB△cysE构建成功。
2.2各菌株的生长曲线
各菌株生长曲线显示,AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE均经历0~3 h 的延滞期,在第3 h进入对数生长期,第12 h 进入稳定期。4株菌株在2 h之前没有明显区别;在2~3 h,AE17△RyhB、AE17△RyhB△cysE与AE17相比没有明显区别,AE17△cysE与AE17相比生长缓慢;在3~12 h,AE17△RyhB与AE17相比没有明显变化,AE17△cysE与AE17相比生长缓慢,AE17△RyhB△cysE与AE17相比在9 h后生长缓慢;在13~16 h 4株菌株之间无明显区别(图2)。表明RyhB基因缺失对APEC的生长速度无影响,cysE基因缺失APEC的对数期生长速度有所降低,RyhB、cysE基因共同缺失对APEC的生长速度无显著影响。
2.3各菌株生物被膜的形成能力
用改良结晶紫半定量法检测AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE生物被膜形成能力,结果显示AE17△RyhB、AE17△cysE、AE17△RyhB△cysE生物被膜形成能力极显著低于AE17(P<0.01),表明 RyhB、cysE基因缺失APEC生物被膜形成能力下降(图3)。
扫描电镜观察各菌株生物被膜,结果显示,AE17在堆状的微菌落中,菌与菌之间丝状物较多,而AE17△RyhB、AE17△cysE、AE17△RyhB△cysE菌與菌之间丝状物较少;4株菌株的生物被膜的片状结构均不明显,但AE17依稀可见有大片片状结构,而AE17△RyhB、AE17△cysE、AE17△RyhB△cysE几乎看不到片状结构的存在(图4)。表明 RyhB、cysE基因缺失APEC导致生物被膜形成能力下降。
2.4各菌株的运动能力
各菌株运动能力的测定结果显示:AE17△RyhB运动圈直径与AE17相比无明显差异,AE17△cysE运动圈直径极显著小于AE17(P<0.01),AE17△RyhB△cysE运动圈直径显著小于AE17(P<0.05),但比AE17△cysE大(图5)。表明cysE基因缺失降低了APEC运动能力,RyhB基因缺失对cysE基因运动能力调控有代偿作用。
透视电镜观察各细菌鞭毛数,结果显示,AE17△cysE鞭毛数与AE17相比显著减少,AE17△RyhB、AE17△RyhB△cysE鞭毛数与AE17相比有所减少,但比AE17△cysE多(图6)。表明RyhB、cysE基因缺失APEC鞭毛数均有所下降,但cysE基因对APEC鞭毛数的影响大于RyhB基因,且RyhB基因缺失对cysE基因的鞭毛调节作用有代偿作用。
2.5各菌株运动性、生物被膜形成相关基因的转录水平检测
采用qRT-PCR对AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE 运动性相关基因转录水平检测,结果显示,AE17△cysE较AE17 fliY、 flhB 、flgD、fliF、fliM和 cheY基因转录水平均显著下降,AE17△RyhB较AE17 flhB、fliF、fliY、fliD、cheY基因转录水平有下降趋势,而fliM基因转录水平有上调趋势;AE17△RyhB△cysE与AE17相比,其flhB 、flgD、fliF和 cheY基因转录水平均下降,但与AE17△cysE相比均有所增强(图7)。表明cysE基因缺失APEC运动性相关基因转录水平下降,且RyhB基因缺失对cysE基因的转录水平有代偿作用。AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE 生物被膜相关基因转录水平检测结果显示,AE17△RyhB、AE17△cysE、AE17△RyhB△cysE与AE17相比,flhD 、flhC、sidA转录水平均显著降低,且转录水平降低幅度相近,表明RyhB、cysE基因均通过调节与生物被膜形成的相关基因flhD 、flhC、sidA转录水平来调控APEC生物被膜形成能力。
3讨论
大肠杆菌是人及动物肠道的常在菌群,但是致病性大肠杆菌却可以引起人及动物诸多疾病[10-12]。病原菌的致病过程体现在病原和宿主细胞相互作用的过程,对病原来说要经历黏附、侵入、生长繁殖、抵抗宿主免疫反应、产生毒素等过程,大肠杆菌亦是如此。细菌的生物被膜状态被认为是一种细菌适应不良环境而形成的保护模式,与浮游细胞相比,生活在生物被膜内的细菌抵抗抗生素和免疫系统的能力更强[13-14]。生物被膜通过增强细菌抗宿主免疫系统和提高在环境中的生存能力,进而能增强细菌的致病性[15]。细菌鞭毛介导的运动性和黏附性在细菌致病性中发挥重要作用[16]。研究RyhB、cysE基因对禽致病性大肠杆菌的生物被膜形成及运动性影响,可为揭示其致病机理奠定基础。
RyhB基因缺失株AE17△RyhB与野生菌株AE17相比生长曲线无明显变化,但cysE基因缺失APEC的对数期生长速度有所降低,而cysE、RyhB基因共同缺失时对APEC的生长速率无显著影响,仅在生长对数期后期生长速率稍微缓慢。cysE基因单缺失时会影响APEC生长对数期的生长速率,猜测是由于基因影响细菌的代谢系统产生的,而cysE、RyhB基因共同缺失时无显著影响,仅在生长对数期后期生长速率较慢,猜测是RyhB基因缺失对cysE基因调控的细菌代谢作用具有补偿机制且该机制具有时效性,具体机制仍有待进一步研究。
用改良结晶紫半定量法检测AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE生物被膜形成能力,结果显示,AE17△RyhB、AE17△cysE、AE17△RyhB△cysE生物被膜形成能力极显著低于AE17,且AE17△RyhB、AE17△cysE、AE17△RyhB△cysE生物被膜形成能力相似。qRT-PCR测定结果显示,AE17△RyhB、AE17△cysE、AE17△RyhB△cysE与AE17 flhD 、flhC、sidA均显著降低,且转录水平降低幅度相近。推测RyhB基因通过cysE基因调控APEC fhlD 、flhC、sidA基因的生物被膜形成能力,APEC cysE基因是RyhB基因调控生物被膜形成能力的调节靶点。flhD 、flhC、sidA均为DNA结合转录双重调节因子,推测其结合下游基因的启动子区域,从而调控细菌的生物被膜形成能力。flhD 、flhC的突变可对生物被膜形成产生促进或抑制的影响,具体取决于突变位点[17]。本试验结果显示,缺失cysE、RyhB基因的APEC菌株中的flhD 、flhC基因转录水平下调,说明APEC cysE、RyhB基因缺失菌株通过调节fhlD 、flhC基因转录水平从而抑制生物被膜的形成。研究结果表明,在肠致病性大肠杆菌中缺失 sdiA后,其生物被膜形成和运动性相关基因(如纤维素合成亚基 bcsA基因、鞭毛结构蛋白fliC基因及Curlin菌毛合成亚基 csgA基因)转录水平上调,生物被膜的形成及运动能力增强,说明sdiA对细菌的生物被膜形成具有负调控作用[18]。本试验APEC缺失cysE、RyhB基因后sdiA基因转录水平下调,可能通过抑制生物被膜形成相关基因的转录而降低其生物被膜的形成。具体机制仍有待进一步研究。
运动性能力测定以及透射电镜观察细菌鞭毛结果显示,cysE基因缺失APEC运动性显著下降;RyhB基因缺失APEC运动性无显著变化;RyhB、cysE双基因缺失APEC运动性较cysE基因缺失APEC运动性增强,与野生菌株相比降低。qRT-PCR测定结果显示,cysE基因缺失株与AE17相比,APEC运动性相关基因 fliY、 flhB 、flgD、fliF、fliM和cheY转录水平均显著下降;但AE17△RyhB△cysE flhB、flgD、fliF、fliM和cheY基因的转录水平较AE17△cysE均有所增强,flhB是鞭毛生物合成蛋白质[19],是Ⅲ型分泌系统中与鞭毛蛋白转运有关的蛋白质;cheY是扩散性反应调节蛋白质,可以被cheA磷酸化,能改变鞭毛的运动方向[20];fliY 是细菌鞭毛马达开关蛋白质,在病原菌侵袭相关鞭毛运动中发挥关键作用[21];fliF是鞭毛基体的MS环的主要成分,将鞭毛固定在细胞质膜上;flgD与fliM构成鞭毛基体的C环,参与改变鞭毛旋转方向[22]。推测cysE基因缺失通过下调flgD、fliF、flhB、cheY、 fliM基因转录水平控制鞭毛的合成及运动能力,使APEC运动性下降,RyhB基因缺失影响flgD、fliF、flhB、cheY、 fliM基因转录水平,对cysE基因调控菌株運动能力具有代偿作用。具体机制仍有待进一步研究。
参考文献:
[1]JOHNSON T J, WANNEMUEHLER Y, KARIYAWASAM S, et al. Prevalence of avian-pathogenic Escherichia coli strain O1 genomic islands among extraintestinal and commensal E. coli isolates[J]. J Bacteriol, 2012, 194(11): 2846-2853.
[2]张煜. 非编码小RNA(RyhB)调控禽致病性大肠杆菌生物学表型分析及靶蛋白的筛选[D]. 合肥:安徽农业大学, 2017.
[3]NAKAMORI S, KOBAYASHI S, KOBAYASHI C, et al. Overproduction of l-Cysteine and l-Cystine by Escherichia coli Strains with a Genetically Altered Serine Acetyltransferase[J]. Appl Environ Microb,1998,64(5): 1607-1611.
[4]尹磊,祁克宗,涂健,等. 非编码小RNA(RyhB)调控禽致病性大肠杆菌毒力相关基因的分析[J]. 畜牧兽医学报, 2015, 46(8): 1409-1416.
[5]DATSENKO K A . One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J]. Proc Natl Acad Sci USA, 2000, 97(12):6640-6645.
[6]王栋,王少辉,孟庆美,等. 禽致病性大肠杆菌Ⅵ型分泌系统2 evfC 基因缺失株的构建及其生物学特性分析[J]. 中国动物传染病学报, 2016, 24(3): 21-26.
[7]NI B, GHOSH B, PALDY F S, COLIN R, et al. Evolutionary remodeling of bacterial motility checkpoint control[J]. Cell Rep, 2017, 18(4): 866–877.
[8]O′NEILL J, ROUJEINIKOVA A. Cloning, purification and crystallization of MotB, a stator component of the proton-driven bacterial flagellar motor[J]. Acta Crystallogr F, 2008, 64(6): 561-563.
[9] SCHMITTGEN T D, LIVAK K J. Analyzing real-time PCR data by the comparative C(T) method[J]. Nat Protoc, 2008, 3(6): 1101-1108.
[10]张 谦,刘一尘,徐进,等. 加味白头翁散发酵产物对肉仔鸡大肠杆菌病的防治效果及对其肠道菌群的影响[J].江苏农业科学,2018,46(21):177-180.
[11]李军,冯世文,曾芸,等. 大肠杆菌O157∶H7氟苯尼考耐药菌株与敏感菌株的蛋白组学差异[J].南方农业学报,2019,50(4):875-882.
[12]毕志香,朱亚露,赵阳,等. 山东省某地区肉鸡H9亚型禽流感与大肠杆菌混合感染的诊治[J].江苏农业科学,2018,46(3):163-165.
[13]HIBY N, BJARNSHOLT T, GIVSKOV M, et al. Antibiotic resistance of bacterial biofilms[J]. Int J Antimicro Agents, 2010, 35(4): 322-332.
[14]COSTERTON J W, STEWART P S, GREENBERG E P. Bacterial biofilms: a common cause of persistent infections[J]. Science, 1999, 284(5418): 1318-1322.
[15]WOOD T K, GONZLEZ BARRIOS A F, HERZBERG M, et al. Motility influences biofilm architecture in Escherichia coli[J]. Applied Microbiology and Biotechnology, 2006, 72(2): 361-367.
[16]HAIKO J, WESTERLUND-WIKSTRM Z B. The role of the bacterial flagellum in adhesion and virulence[J]. Biol, 2013, 2(4): 1242-1267.
[17]SHELLEY M H, JOSEPH S, NICHOLAS S, et al. Spontaneous mutations in the flhD operon generate motility heterogeneity in Escherichia coli biofilm[J]. BioMed Central, 2016, 16(1):1-13.
[18]HEBERT C, SAMUEL C, JULIANA H, et al. Role of SdiA on Biofilm Formation by Atypical Enteropathogenic Escherichia coli[J]. Pubmed, 2018, 9(5): 253.
[19]MINAMINO T, INOUE Y, KINOSHITA Miki, et al. FliK-Driven conformational rearrangements of FlhA and FlhB are required for export switching of the flagellar protein export apparatus[J]. Pubmed, 2020, 202(3): e00637.
[20]QUAX TESSA E F, ALTEGORR F, ROSSI F, et al. Structure and function of the archaeal response regulator CheY[J]. Proc Natl Acad Sci USA, 2018, 115(6): 1259-1268.
[21]LAM K H, CHAOLUN X, KAILEI S, et al. Three SpoA-domain proteins interact in the creation of the flagellar type III secretion system in Helicobacter pylori[J]. J Biol Chem, 2018, 293(36): 13961-13973.
[22]田延,丁雪燕,岑雪,等. 大腸杆菌鞭毛研究进展[J]. 中国预防兽医学报, 2019, 41(6): 649-653.
(责任编辑:陈海霞)
