生防细菌MS82中GGDEF结构域基因对生物被膜形成及运动性的影响
2022-06-24陈先意曲绍轩骆昕李辉平林金盛蒋宁侯立娟马林刘慧芹
陈先意 曲绍轩 骆昕 李辉平 林金盛 蒋宁 侯立娟 马林 刘慧芹




摘要:为探究荧光假单胞菌MS82中GGDEF结构域基因对c-di-GMP调控细菌生物被膜形成及运动能力的影响,通过抑菌圈法、小试管法、96微孔板法以及运动性平板分别检测GGDEF缺失突变体MT5092、MT0189、MT19和MS82野生型菌株之间的相关生命活动能力的差异。结果显示,GGDEF缺失突变型菌株MT5092、MT0189、MT19的抑菌活性、生物被膜形成能力、运动能力(游泳运动、集群运动及抽搐运动)皆低于突变前的MS82野生型菌株,且突变株与野生株的抑菌活性存在极显著差异(P<0.01);36 h的生物被膜形成能力存在极显著差异;运动行为存在不一致的显著(P<0.05)或极显著差异。最终得出结论:缺失GGDEF结构域基因会降低胞内c-di-GMP浓度水平,进而影响MS82菌株的生物膜及运动行为。
关键词:生防细菌MS82;GGDEF结构域基因;生物被膜;运动性
中图分类号:S942.3;S182 文献标志码:A
文章编号:1002-1302(2022)11-0104-04
收稿日期:2021-09-09
基金项目:国家自然科学基金青年科学基金(编号:31901933);天津市科技计划(编号:20YDTPJC01330);天津农学院研究生科研创新项目(编号:2020XY005);天津市高校中青年骨干创新人才培养计划(编号:J01009030709)。
作者简介:陈先意(1997—),女,上海人,硕士研究生,从事植物病理学研究。E-mail:1156561293@qq.com。
通信作者:刘慧芹,博士,教授,从事植物病害生防研究及生防菌剂研发,E-mail:wjxlhq@126.com;马 林,博士,研究员,从事食用菌栽培和病虫防控研究,E-mail:malin1590@sina.com。
环二鸟苷酸(c-di-GMP)是一种广泛存在于细菌中的保守第二信使,作为关键因素调控着菌落形态、细胞周期、细胞分化、生物被膜的形成与扩散、鞭毛与菌毛介导的细胞运动行为、细胞毒力、抗性分泌等重要生命活动。大量试验证明,假单胞菌属菌株胞内c-di-GMP的浓度水平,受到DGCs(二鸟苷酸环化酶)的催化核心,同时也是DGCs与2分子GTP结合形成c-di-GMP的重要结合位点——GGDEF结构域的调控。对c-di-GMP调控生物膜的研究中发现,高浓度的c-di-GMP会促进胞外多糖产生和生物膜形成量的增加,同时抑制细菌运动行为;而低水平的c-di-GMP有利于鞭毛介导的细菌运动却不利于生物被膜的形成。在探索荧光假单胞菌(Pseudomonas fluorescens)是否符合此结论时,选取的试验对象 Pf0-1 菌株相关数据显示,缺失了含有GGDEF结构域的RapA基因后,细胞内 c-di-GMP 水平降低并对生物膜形成具有抑制作用,却没有发现影响胞外多糖产生或鞭毛介导的运动性的证据。
MS82菌株是一株从土壤中发现的荧光假单胞菌,对引起食用菌菌种菌料污染、继而引发寄生性病害的绿色木霉(Trichoderma viride)具有良好的抑菌作用。突变体MT19是通过随机突变方式获得的一株GGDEF结构域基因破坏菌株,并导致其抑菌活性完全丧失。然而,该基因的突变是否对生物被膜形成能力和运动性方面的具体调控造成影响尚不清楚。
为探索GGDEF结构域基因在MS82菌株中对 c-di-GMP 调控生物被膜及运动行为的影响,本研究对荧光假单胞菌MS82菌株中3个与c-di-GMP代谢相关的GGDEF结构域基因进行研究,检测MS82野生株与3株不同GGDEF结构域突变株(MT5092、MT0189:基因重组菌株、MT19:随机突变菌株)之间的抑菌活性、生物被膜形成量、运动行为等表型差异,进一步探究荧光假单胞菌中c-di-GMP调控生物被膜及运动性之间的关联。
1 材料与方法
1.1 材料
1.1.1 菌株和供试菌株
生防菌:MS82野生型菌株(P. fluorescens),突变型菌株MT5092、MT0189、MT19;病原菌:绿色木霉。所有菌株均由江苏省农业科学院蔬菜研究所提供。试验于2020年10月至2021年8月在江苏省农业科学院蔬菜研究所食用菌研究课题组研究室内开展。
1.1.2 相关培养基制备
LB培养基(1 L):10 g胰蛋白胨、5 g酵母提取物、10 g NaCl;
LB固体培养基(1 L):10 g胰蛋白胨、5 g酵母提取物、10 g NaCl、15 g琼脂;
氨苄液体培养基:在LB培养基成分中加入0.1% 50 μg/mL 氨苄青霉素(Amp);
氨苄固体培养基:在LB固体培养基成分中加入0.1% 50 μg/mL Amp;
游泳运动(swimming motility)培养基:在LB培养基成分中加入0.3 %琼脂粉;
集群运动(swaming motility)培养基:在LB培养基成分中加入0.7%琼脂粉、0.5%葡萄糖;
抽搐运动(twitching motility)培养基:在LB培养基成分中加入3%瓊脂粉。
1.2 方法
1.2.1 菌液制备
MS82、MT5092、MT0189、MT19菌株在氨苄固体培养基上活化,28℃倒置培养 16 h。选择单菌落重新划线,28℃倒置培养16 h。将各菌株单菌落接入5 mL LB培养基中,28℃、220 r/min 振荡培养16 h,4℃、4 000 r/min离心 3 min,弃上清,用无菌水将菌体重悬并稀释至吸光度D=0.05,备用。
1.2.2 突变体抑菌能力测定
采用抑菌圈法测定:分别取10 μL制备好的菌液置于LB固体培养基中心,待菌液晾干后,用小喷壶喷适量用无菌水稀释的绿色木霉孢子悬浮液(孢子浓度2亿CFU/mL),28℃倒置培养2 d,测量各菌株抑菌圈直径。
1.2.3 c-di-GMP相关基因生物膜形成测定
采用小试管法与96微孔板法测定c-di-GMP对生物膜形成的影响。
(1)小试管法:分别在含有 5 mL LB培养基的灭菌试管中加入5 μL各菌株菌液,28℃、100 r/min振荡培养16 h后,静置36 h。1%结晶紫染色后,观察管内形成染色环状物的颜色深浅。
(2)96微孔板法:96孔板中每孔加入100 μL的LB培养基及各菌株备用菌液10 μL,28℃静置孵育,分别于12、24、36 h取出。1%结晶紫染色后,加入 100 μL 33%乙酸溶解30 min。以LB培养基为参比,用紫外分光光度计在荧光假单胞菌最大吸光波长590 nm处测定菌液吸光度D。
1.2.4 c-di-GMP相关基因运动能力测定
本研究运动能力检测方法对谢杰鹏等的方法进行改进。
(1)游泳运动能力测定:各菌株分别取10.0、2.5 μL 菌液,接种在泳动培养基表面正中间,28℃培养 24 h 后,观察以接种中心蔓延的云雾状区域,测量该区域的直径。
(2)集群运动能力测定:分别吸取10.0、2.5 μL 菌液接种在集群运动培养基表面中心,28℃恒温培养 24 h 后,观察以接种中心生长蔓延的区域,测量该区域的直径。
(3)抽搐运动能力测定:用无菌牙签蘸取各菌株菌液,接种在抽搐运动培养基底部,28℃恒温培养 48 h 后,轻轻揭去培养基,用0.9%生理盐水冲洗培养皿底部未黏附的细菌,1%结晶紫溶液染色后,观察以细菌接种点为中心形成的区域,测量该区域的直径。
1.2.5 统计学方法
每组处理设置3个重复,测量数据采用SPSS 17.0统软件进行单因素方差分析计(ANOVA),采用LSD-Tamhane's T2 进行两两比较。数据结果用“平均数±标准差(x±s)”表示。
2 结果与分析
2.1 抑菌能力分析
抑菌圈法产生的透明抑菌圈直径越大,则表明该菌株的抑菌活性越强,反之越弱。MS82野生型菌株和3个GGDEF结构域基因突变体菌株对绿色木霉的抑菌活性如图1所示,可以看出,3个突变体菌株的抑菌活性均有不同程度的降低。其中MT19完全丧失抑菌能力,无抑菌圈产生;MT5092与M0189产生的抑菌圈均极显著小于MS82野生型(P<0.01)。4个菌株的抑菌活性依次为MS82>MT0189>MT5092>MT19。
2.2 生物被膜形成能力差异分析
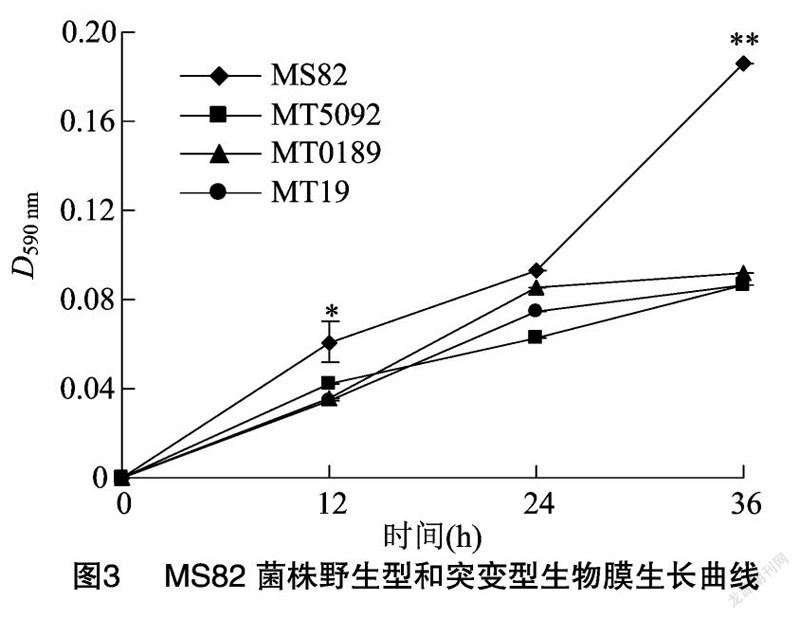
MS82菌株中3个含有GGDEF结构域的基因分别被突变后,生物被膜的形成能力表现出了明显的变化。从小试管法的试验结果(图2)可以看出,MS82菌株的菌体生物膜经过染色后颜色比3个突变菌株深,且环状完整,表明生成的细菌数量多,生物被膜形成量多,生物被膜形成能力强。96微孔板法试验结果(图3)与图2一致,即3个基因突变后的生物被膜形成能力明显变弱,且随着时间的延长,差异逐渐增大;同时3个突变菌株的生物被膜形成能力随时间延长,逐渐趋于一致。
2.3 运动性能力差异分析
2.3.1 游泳运动
具有鞭毛的细菌在液体中借助鞭毛的旋转,使菌体能定向泳动,在培养基表面表现为类圆形云雾状扩散。图4试验结果表明,点样10.0 μL时各菌株的游泳圈直径大于点样2.5 μL时,3株缺失GGDEF结构域基因的突变型菌株扩散直径小于野生型,表现出游泳运动缺陷。不同点样量下,MS82野生型菌株与3株突变型菌株之间均表现为极显著差异。MS82、MT5092、MT0189、MT19 这4个菌株的泳动能力强弱呈现依次下降的趋势。
2.3.2 集群运动
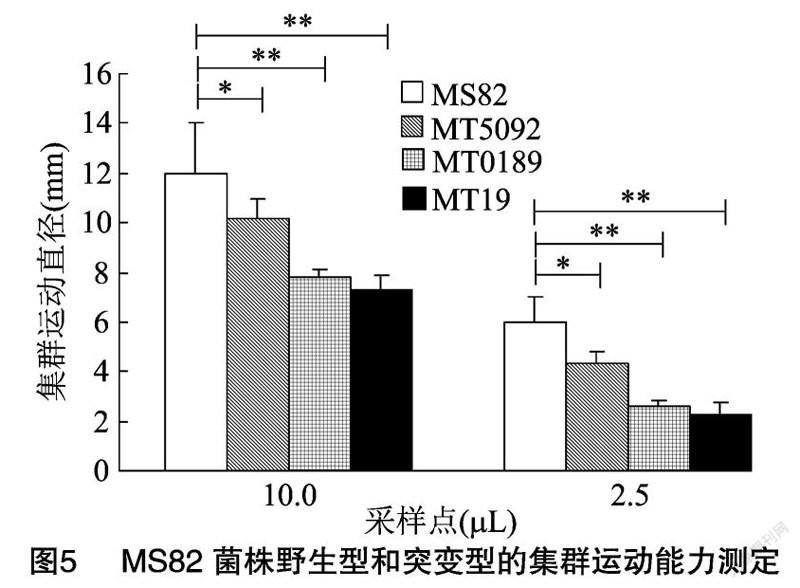
细菌在高密度下會发生集群运动,在相应培养基上出现以接种点为中心向外蔓延的生长区域,生长区域直径越大,表明细菌的集群运动能力越强。对比数据(图5)发现,点样10.0、2.5 μL 时各菌株之间的差异性一致。野生型MS82菌株的生长区域直径显著或极显著大于基因突变后的3个突变菌株。说明含有GGDEF结构域基因的缺失影响了MS82菌株的集群运动能力。
2.3.3 抽搐运动
通过刺伤试验检测细菌的抽搐运动能力时,会在培养基与底部培养皿之间形成浅白色的位移区域。观察试验结果发现,相较于突变型菌株,野生型菌株MS82向四周发生的位移距离更大,且位移边缘不平整,表明有继续向外发生位移的趋势,而突变型菌株发生的位移距离小,边缘光滑呈类圆形。进一步分析数据(图6)可知,突变株MT0189位移距离虽然变小但与野生株之间无显著性差异;突变株MT5092位移区域显著减小,约为野生株的1/2;突变株MT19位移区域极显著减小,几乎不发生位移。
3 討论
c-di-GMP作为细菌内调节多细胞行为的调节因子,胞内浓度水平由该系统的上下游信号分别调节,并影响细菌不同的生命活动。浓度低时,上游合成信号DGCs与2分子GTP在GGDEF结构域的活性部位结合形成c-di-GMP,提高胞内c-di-GMP浓度水平,促进生物被膜的形成;浓度高时,多余的c-di-GMP会与GGDEF结构域的抑制位点相结合,或被特异性磷酸二酯酶(PDEs)感知并分解,抑制生物被膜的形成。同时,细胞的运动行为的表达在生物被膜形成过程中是相互联系、共同参与的。c-di-GMP在高水平下限制细胞的运动行为,进而有利于形成生物被膜;相反c-di-GMP在低水平下,有利于鞭毛介导的运动行为,不利于生物被膜的形成。
c-di-GMP信号系统接收到环境信号会使荧光假单胞菌产生包括2,4-二乙酰基间苯三酚、藤黄绿脓菌素、硝吡咯菌素、氢氰酸等多种能够防治病原微生物的抑菌物质。此前在对荧光假单胞菌丧失GGDEF结构域的突变体MT19进行抑菌活性测定时,MT19表现出明显的抑菌活性缺陷。本试验在此基础上进一步探究对比同源重组突变株MT5092、MT0189的抑菌活性,试验结果显示,抑菌活性同样有所降低,符合此前得到的结论,说明缺失GGDEF结构域会降低c-di-GMP浓度,进而抑制抑菌活性物质的产生。与此同时,发现2株同源重组菌株的抑菌活性比MT19强,推测可能是不同突变方式及位点导致的基因型存在内在差异,因此在抑菌活性表型上也存在一定的差异。
另外,通过诱变荧光假单胞菌F113获得缺失GGDEF结构域的WspR蛋白突变体,该突变体的运动能力强于野生型菌株,生物膜形成能力受到抑制。但在本次试验中,同源重组突变菌株MT5092、MT0189以及随机突变株MT19的游泳运动、集群运动、抽搐运动等运动行为及生物被膜形成能力都有所下降,与其他菌株如鲍曼不动杆菌(Acinetobacter baumannii)ATCC17978、嗜酸乳杆菌(Lactobacillus acidophilus)ATCC4356、普城沙雷氏菌(Serratia puccinia)G3、天蓝色链霉菌(Streptomyces coelicolor)等菌株相关试验中所得到的结果相符,却与F113菌株的试验结论略有不同。同时,发现2株同源重组菌株的运动能力比随机突变株MT19强,且两者同源重组菌株MT5092与MT0189之间也存在一定差异,推测同样可能是基因位点不同导致的表达存在差异。
本试验主要通过对比3个缺失GGDEF结构域基因的突变株MT5092、MT0189、MT19与MS82野生型菌株对绿色木霉的抑菌能力、生物被膜形成能力、运动行为能力,发现缺失GGDEF结构域对c-di-GMP信号系统调控细菌抑菌物质合成、生物被膜形成及运动能力存在抑制作用。为更深入地探索GGDEF结构域对c-di-GMP调控生物被膜与运动性能力之间的关系,下一步将通过基因互补试验验证突变菌株的抑菌活性、生物被膜形成及运动能力的变化验证其基因功能。
参考文献:
[1]艾连中,范艺周,熊智强. 第二信使分子调控细菌胞外多糖生物合成研究进展[J]. 中国食品学报,2021,21(4):1-8.
[2]全 旭,王鹤龄,张慧彦,等. c-di-GMP及其对细菌生物膜调控作用的研究进展[J]. 现代口腔医学杂志,2018,32(6):352-356.
[3]秦文韬,王守现,荣成博,等. 我国食用菌病害发生与防控概况[J]. 中国食用菌,2020,39(12):1-7.
[4]杨 毅,李 治,高玲霞,等. 荧光假单胞菌抗生性代谢产物合成相关基因的研究现状[J]. 中国生物工程杂志,2012,32(8):100-106.
[5]詹学良,姚严翔,芦晓红,等. 铜绿假单胞菌PAO1中c-di-GMP代谢相关基因PA0575对表型的影响[J]. 微生物学通报,2020,47(6):1927-1934.
[6]肖玉杰. 恶臭假单胞菌KT2440中c-di-GMP及其代谢酶BifA,GcbA在调控生物被膜形成和游动性中的作用[D]. 武汉:华中农业大学,2017.
[7]卢佳思. 固氮施氏假单胞菌环二鸟苷酸(c-di-GMP)代谢相关基因的功能鉴定[D]. 合肥:安徽农业大学,2016:3-6.
[8]Simm R,Morr M,Kader A,et al. GGDEF and EAL domains inversely regulate cyclic di-GMP levels and transition from sessility to motility[J]. Molecular Microbiology,2004,53(4):1123-1134.
[9]Monds R D,Newell P D,Gross R H,et al. Phosphate-dependent modulationOf c-di-GMP levels regulates Pseudomonas fluorescens Pf0-1 biofilm formation by controlling secretionOf the adhesin LapA[J]. Molecular Microbiology,2007,63(3):656-679.
[10]Nie H L,Xiao Y J,He J Z,et al. Phenotypic-genotypic analysisOf GGDEF/EAL/HD-GYP domain-encoding genes in Pseudomonas putida[J]. Environmental Microbiology Reports,2020,12(1):38-48.
[11]刘正慧,李 丹,Leo S Frederick,等. 食用菌主要病原真菌和细菌[J]. 菌物研究,2018,16(3):158-163.
[12]马 林,曲绍轩,王晓强,等. 食用菌木霉的生防细菌鉴定及相关基因功能预测[J]. 江苏农业学报,2016,32(3):528-533.
[13]萨姆布鲁克 D J,拉塞爾 D W. 分子克隆实验指南[M]. 黄培堂,译. 3版. 北京:科学出版社,2016:1595.
[14]谭才邓,朱美娟,杜淑霞,等. 抑菌试验中抑菌圈法的比较研究[J]. 食品工业,2016,37(11):122-125.
[15]陈朝喜. 细菌生物被膜定性和定量研究方法[J]. 湖北农业科学,2016,55(9):2177-2180.
[16]Gu G Y,Smith L,Liu A X,et al. Genetic and biochemical map for the biosynthesisOfOccidiofungin,an antifungal produced by Burkholderia contaminans strain MS14[J]. Applied and Environmental Microbiology,2011,77(17):6189-6198.
[17]谢杰鹏,孔晋亮,陈一强,等. 美罗培南对胞内不同c-di-GMP浓度表型铜绿假单胞菌生物被膜形成的影响[J]. 广西医科大学学报,2020,37(6):1001-1006.
[18]郑贤惠,汪钰鸿,张玥涛,等. 生物被膜与环二鸟苷酸信号系统[J]. 生命的化学,2020,40(12):2162-2169.
[19]谷维璇. c-di-GMP对铜绿假单胞菌生物被膜调控的研究进展[J]. 中国细胞生物学学报,2020,42(12):2289-2296.
[20]Berendsen R L,Kalkhove S I C,Lugones L G,et al. GerminationOf Lecanicillium fungicola in the mycosphereOf Agaricus bisporus[J]. Environmental Microbiology Reports,2012,4(2):227-233.
[21]Navazo A,Barahona E,Redondo-Nieto M,et al. Three independent signalling pathways repress motility in Pseudomonas fluorescens F113[J]. Microbial Biotechnology,2009,2(4):489-498.
[22]乔 霞,苏雅静,魏 军,等. 鲍曼不动杆菌ATCC17978中第二信使c-di-GMP相关代谢蛋白的生物信息学分析[J]. 中国病原生物学杂志,2020,15(9):1005-1009,1014.
[23]何嘉辉,孙洁丽,闫文娟,等. 嗜酸乳杆菌GGDEF和EAL结构域相关蛋白的表达结构域相关蛋白的表达、纯化及活性分分析[J]. 南方医科大学学报,2017,37(5):633-639.
[24]吴 岩. 普城沙雷氏菌G3菌株GGDEF/EAL结构域蛋白PigX的功能研究[D]. 镇江:江苏大学,2016:41-42.
[25]Liu X C,Zheng G S,Wang G,et al.OverexpressionOf the diguanylate cyclase CdgD blocks developmental transitions and antibiotic biosynthesis in Streptomyces coelicolor[J]. Science China(Life Sciences),2019,62(11):1492-1505.
