基于CRISPR/Cas13的RNA编辑系统及其在核酸检测中的应用
2020-11-21张爱霞朱庆锋魏文康晏石娟刘文华
张爱霞,朱庆锋,陈 沛,于 洋,魏文康,晏石娟,刘文华
(广东省农业科学院农业生物基因研究中心,广东 广州 510640)
核酸检测技术在传染病病原检测、食品安全检疫和环境生态监测等方面发挥重要作用。快速核酸检测对于诊断和监测感染性病原体并提供最新的疾病信息以控制传播和及时治疗必不可少,即时检测(Point-of-care testing,POCT)有助于提高效率,及时优化决策,降低成本,尤其对资源受限的地区更为重要。根据世界卫生组织的标准,理想的病原体诊断检测应是廉价、灵敏、特异、易用、快速、无需大型设备即可实现[1]。目前常用的核酸检测技术主要有聚合酶链反应(Polymerase chain reaction,PCR)技术、基因芯片、等温扩增技术和基因测序技术,但这些技术存在操作复杂、设备昂贵或灵敏度低等局限[1-2]。因此,迫切需要开发更为简便快捷、灵敏度高、特异性强的新一代核酸检测技术。
成簇规律间隔短回文重复序列及其相关基因(Clustered regularly interspaced short palindromic repeats/CRISPR associated gene,CRISPR/Cas)系统是存在于细菌和古菌中的一种适应性免疫系统,能在单链向导RNA(Single guide RNA,sgRNA)指引下将Cas核酸酶与靶序列相结合并对其进行切割[3]。该系统中的CRISPR/Cas13是目前CRISPR/Cas家族中唯一只靶向单链RNA(Single-stranded RNA,ssRNA)的系统,自2016年6月报道[4]以来,CRISPR/Cas13系统就备受全球研究人员的关注和重视,这不仅因为它是一种只靶向RNA的新型CRISPR系统,更重要的是其具有特异性切割和“附带切割”能力。高的靶向效率和优异的酶切能力使CRISPR/Cas13系统在核酸检测方面具有广阔的应用前景。本文综述了基于CRISPR/Cas13的核酸检测系统的研究现状,以期为相关领域的进一步研究提供参考。
1 CRISPR/Cas13在CRISPR系统中的类别归属及其亚型
目前已知的CRISPR/Cas系统有6型和30多种亚型[5],根据Cas的蛋白组成及发挥作用的方式,CRISPR/Cas系统可分为1类系统(Class 1)和2类系统(Class 2)两大类群。Class 1的Cas是一种多酶复合物,包括Ⅰ、Ⅲ和Ⅳ型;Class 2则仅含单个多结构域的Cas蛋白[6],包括Ⅱ(Cas9)、Ⅴ(Cas12)和Ⅵ(Cas13)型[7-8]。Cas13属于2类CRISPR/Cas系统的Ⅵ型,包含单一的效应蛋白质Cas13,CRISPR/Cas13系统类似于CRISPR/Cas9系统,但Cas9靶向的是DNA,而Cas13仅靶向切割ssRNA[4]。
CRISPR/Cas13系统根据Cas蛋白的系统发育可分为 4 种亚型[6](图1),即VI-A、VI-B(VIB1、VI-B2)、VI-C和VI-D[9-10],这4个亚型同源性不高,同源序列仅限于Cas13上的高等真核生物和原核生物核苷酸结合域(Higher eukaryotes and prokaryotes nucleotide-binding,HEPN)位点。VI-A 亚型具有Cas1和Cas2,其Cas13蛋白称为Cas13a,目前科学家已经从Leptotrichia buccalis、Leptotrichia wadei、Leptotrichia shahii和Lachnospiraceae bacterium等多种细菌中解析出了Cas13a结构,根据其来源不同分别称为LbuCas13a[11]、LwaCas13a[12]、LshCas13a[13]和LbaCas13a[14]。VI-B亚型缺少Cas1和Cas2,具有Csx28和Csx27,Csx28能增强Cas13b活性,Csx27对其有抑制作用,从而进一步分成VI-B1 和VIB2[15]。绝大多数VI-D亚型都有相关的含WYL结构域的辅助蛋白,这个结构域通常与原核防御系统有关[16]。VI-D亚型的Cas13d比较小,平均长度比Cas13a和Cas13c短190~300个氨基酸序列,这为RNA的调控和检测提供了便利[16]。对于VI-C亚型,目前相关研究较少[6]。
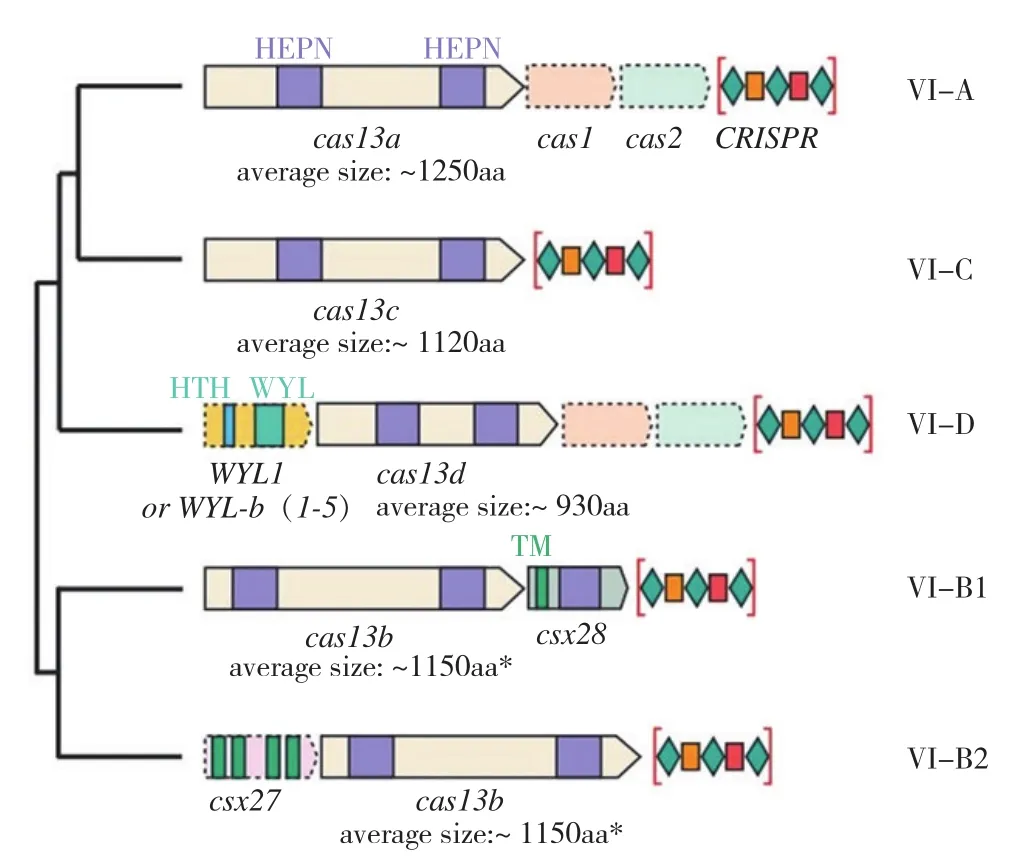
图1 CRISPR/Cas13系统的4 种亚型[6]Fig. 1 Four subtypes of CRISPR/Cas13 system[6]
2 CRISPR/Cas13系统的组分特征及其分子作用机制
2.1 Cas13蛋白
2017年,中国科学院生物物理研究所解析了LbuCas13a与CRISPR RNA(crRNA)二元复合物的晶体结构和LbuCas13a蛋白的晶体结构[13]。LbuCas13a具有“双瓣叶”球状蛋白质结构,由1个 crRNA识 别 瓣 叶(Recognition lobe,REC)和1个核酸酶瓣叶(Nuclease lobe,NUC)组成。REC叶片包含NTD(N-terminal domain,NTD)和Helical-1结构域,NUC叶片包含两个HEPN结构域、Helical-2结构域以及连接两个HEPN结构域的连接结构域[13](图2)。负责切割crRNA前体和靶RNA的活性位点分别位于Helical-1和HEPN结构域。HEPN催化切割位点位于Cas13a蛋白的外表面,Cas13a蛋白一旦被靶RNA活化,即可行使非特异性RNA酶功能,裂解附近的其他ssRNA[11]。

图2 Cas13a与crRNA复合物的晶体结构及其催化活性中心[13]Fig. 2 Crystal structure of Cas13a in complex with crRNA and its catalytic active sites[13]
HEPN催化切割位点中存在一些高度保守的氨基酸残基,对靶RNA的切割起主要作用,分别是HEPN1结构域中第597位精氨酸(Arg597)、第602位组氨酸(His602)和HEPN2结构域中第1 278位精氨酸(Arg1278)、第1 283位组氨酸(His1283)。活化的HEPN催化切割位点形成1个含R-X4-6-H 基序的“X”形三维空间结构,上述4个关键氨基酸残基位于外表面,从而对RNA酶切发挥关键作用[13,17](图 2)。此外,HEPN1结构域中第598位天冬酰胺(Asn598)和HEPN2结构域中第1 279位天冬酰胺(Asn1279),对Cas13a的酶切活性也起着重要作用[13,17]。Cas13b和Cas13d也包含2个HEPN结构域,有类似 Cas13a的功能[18-19]。
2.2 crRNA
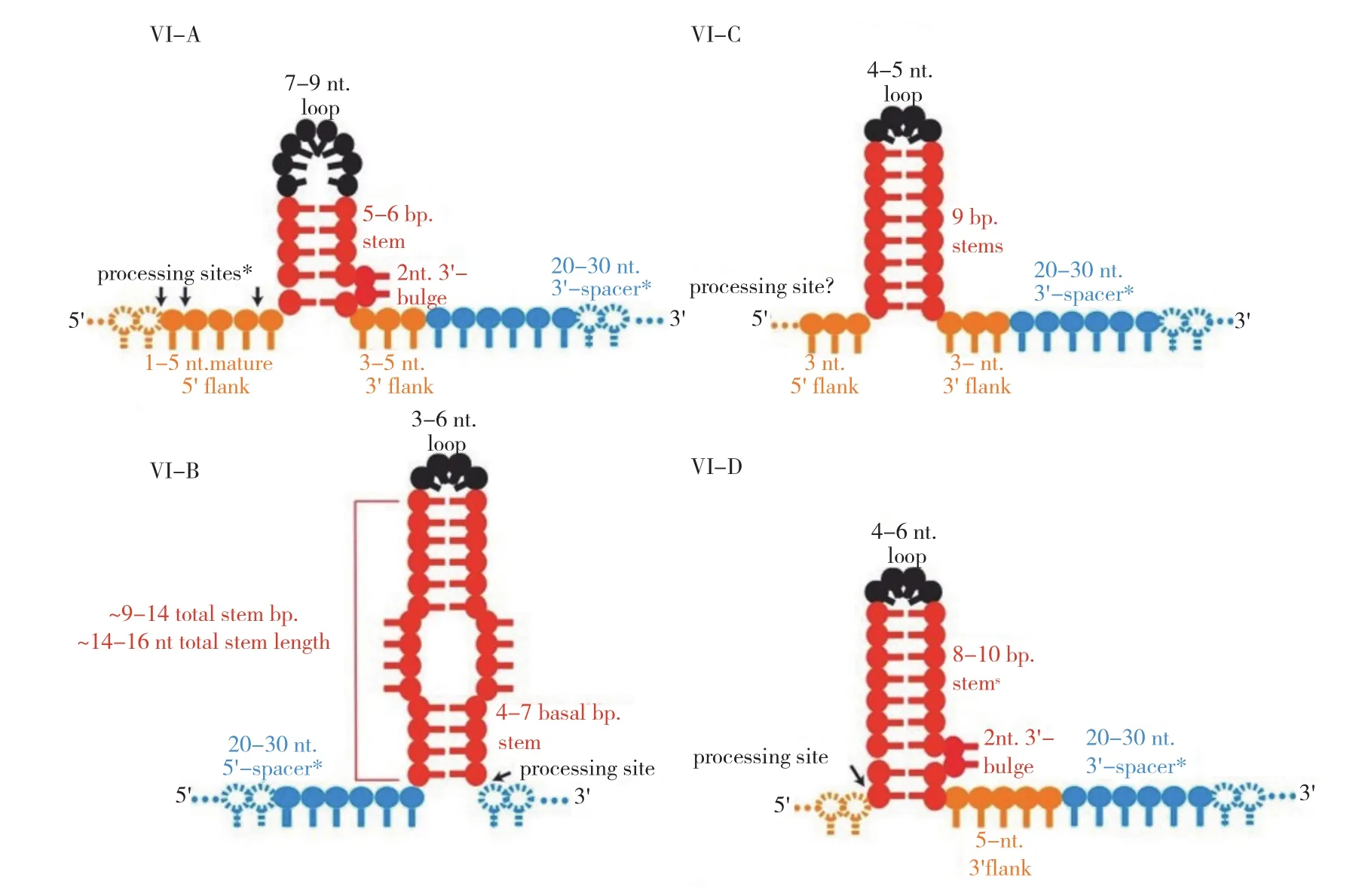
图3 CRISPR/Cas13系统4种亚型的crRNA结构[6]Fig. 3 crRNA structure of four subtypes of CRISPR/Cas13 system[6]
crRNA是CRISPR/Cas13系统的另一个重要组成元件,由2个区域组成,即重复区域和引导区域(间隔区域)。CRISPR/Cas13系统4个亚型的crRNA 结构略有不同[6](图3)。CRISPR/Cas13a中的crRNA[19]的重复区域有31个碱基,位于5'端,其二级结构是 1个茎环结构,包含1个由5个碱基配对形成的茎(茎上有2个碱基AC或AA的凸起)、1个由7~9个碱基形成的环,以及茎环结构两端的邻近基序。重复区域能在Cas13a酶切靶RNA时保护自身不被切割,而且在促进crRNA与Cas13a紧密结合方面起关键作用。引导区域有28个碱基,位于3'端,其序列可与靶RNA序列互补形成1个28 bp形似A-DNA螺旋的引导-靶RNA二聚体。在CRISPR/Cas13b系统中,crRNA前体被加工成一个66 nt 的成熟crRNA,含36 nt的重复区域和30 nt的引导区域[15]。二级结构分析显示,与其他3个亚型相比,其crRNA具有更长的重复序列茎(9~14 bp),茎上具有几个不成对的区域和凸起,茎环更小[20]。在CRISPR/Cas13d 系统中,crRNA具有36 nt的重复区域,包含 8~10 nt的茎和 4~6 nt的 环,1个末端含AAAAC基序的3'端侧翼单链区[9,16]。
2.3 CRISPR/Cas13系统的分子作用机制
2.3.1 CRISPR/Cas13系统在体内的防御分子机制CRISPR/Cas13系统在体内的防御分子机制主要体现在4个阶段(图4):(1)外源核酸序列的获取[21]。获取外源核酸序列(如噬菌体和质粒)并整合在 CRISPR 阵列的“间隔”序列中形成新的间隔,研究认为Cas1、Cas2是新间隔形成的主要功能蛋白[22]。(2)crRNA 的表达与加工[14]。pre-crRNA是CRISPR基因座转录表达的初产物,而Cas13具有处理自身pre-crRNA为成熟crRNA的RNase活性[9,17],pre-crRNA与Cas13蛋白结合,引起Cas13蛋白构象变化而形成一个酸碱催化中心,催化酶切pre-crRNA形成成熟的crRNA[23-24]。(3)HEPN-RNase活性激活。靶ssRNA与Cas13-crRNA复合物结合,并与crRNA碱基互补配对,从而使Cas13蛋白发生协同构象变化,在HEPN结构域形成催化反应中心,激活了Cas13蛋白的HEPNRNase的酶切活性。(4)酶切反应阶段。激活的Cas13蛋白能特异性切割靶ssRNA,还具有“附带切割”的RNase活性,导致原核细胞中其他ssRNA被降解[4,11]。

图4 CRISPR/Cas13系统的防御分子作用过程[6]Fig. 4 Molecular interaction process of CRISPR/Cas13 system[6]
2.3.2 CRISPR/Cas13系统的靶向特异性分子机制 激活的Cas13蛋白能特异性切割靶ssRNA,其靶向特异性主要由以下3个因素决定(图5):(1)crRNA和靶RNA之间碱基的准确配对。Cas13-crRNA复合物在与靶RNA结合之前处于无活性状态,只有靶RNA与crRNA互补配对形成稳定结合从而诱发Cas13的协同构象变化,才能激活Cas13的酶切活性,导致Cas13对靶RNA的高度靶向特异性[13,24]。而非配对 ssRNA无法稳定地与Cas13-crRNA复合物相结合,不能激活Cas13的酶切活性。(2)crRNA与靶RNA形成的二聚体中,有个对错配十分敏感的区域,如果此处发生错配则Cas13a不能切割靶RNA[6,11]。(3)前间隔序列侧翼位点(Protospacer-flanking site,PFS),其作用如同CRISPR/ Cas9系统靶位点侧翼的原间隔子相邻基序(Protospacer adjacent motif,PAM)[25-26]。研究发现,LshCas13a的PFS为protospacer-3' 侧翼的A、U或C(H)而不是G[2]。如果为G,则会显著降低 HEPN 核酸酶的活性[27]。Gootenberg等[28]通过体外裂解试验,证明LwaCas13a具有轻微的“H”PFS偏好,但对细菌筛选[12]或人类细胞系质粒文库筛选[20]PFS时,没有检测到LwaCas13a的PFS偏好。不同来源的Cas13b的PFS也有差别,利用来自Bergeyella zoohelcum和Prevotella buccae的Cas13b在细菌中进行靶标文库筛选时,PFS为5'和3'端的双向PFS,其中5'端的一般为D(A/U/G),3'端的一般为NAN或NNA[15],但对PspCas13b进行细菌中错配的目标文库实验时,则不需要PFS[20]。对于Cas13d,使用细菌筛选策略均未检测到PFS序列。
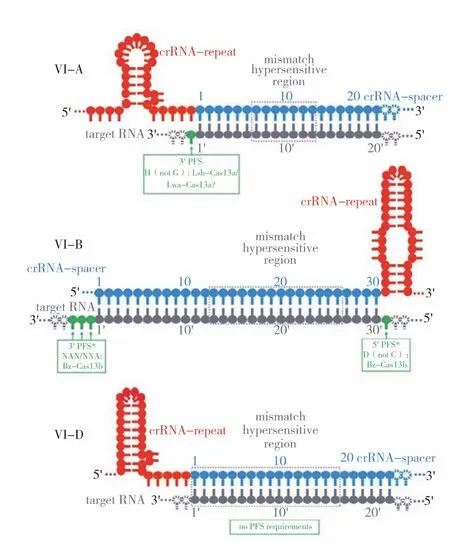
图5 CRISPR/Cas13系统的靶向特异性分子机制[6]Fig. 5 Molecular mechanism of the target specificity of CRISPR/Cas13 system[6]
3 基于CRISPR/Cas13系统的特异性高灵敏度酶报告解锁技术的产生和发展
2016年,East-Seletsky等[17]通过引入 RNA荧光报告分子,开发出基于CRISPR/Cas13a检测不同靶RNA的新方法。RNA荧光报告分子上连接荧光基团和淬灭基团,激活的Cas13a除了进行靶RNA特异性切割外还“附带切割”RNA荧光报告分子,随着荧光基团和淬灭基团之间的连接RNA链断裂而发出荧光,而通过检测荧光信号即可进行特定核酸检测。该研究显示,检测1~10 pmol /L的靶RNA可在30 min内产生十分明显的核酸降解信号,但pmol /L级别的检测灵敏度不能满足临床检测需求,因此仅引入RNA荧光报告分子仍不够,还需要更多的设计策略来提高检测的灵敏度。
2017年,张峰研究团队[28]设计研发出基于CRISPR/Cas13系统的特异性高灵敏度酶报告解锁(Specific high-sensitivity enzymatic reporter unlocking,SHERLOCK)技术(图6)。该技术除了加入RNA荧光报告分子,还进行了重组酶聚合酶扩增(Recombinase polymerase amplification,RPA),即对靶DNA或RNA进行RPA或RT-RPA扩增,扩增后的DNA产物用T7核糖核酸聚合酶转录为RNA,然后在crRNA引导下激活Cas13a, 激活的Cas13a切割RNA荧光报告分子从而能检测到荧光信号。SHERLOCK技术能够检测到amol /L级(10-18mol/L)浓度的RNA或DNA,实现了单分子灵敏度和单碱基特异性检测。而且SHERLOCK所用检测试剂可冻干制备成滤纸片,成本低廉,使用方便,非常适用于即时检测。研究发现,SHERLOCK具有多种功能:(1)短时间内检测患者血液或尿液样本中Zika病毒的存在并区分非洲和美国Zika病毒株的基因序列;(2)识别特定的细菌类型,如大肠杆菌;(3)检测抗生素耐药性基因;(4)在模拟的游离DNA中识别癌症突变;(5)识别人基因组上的SNP。虽然SHERLOCK具有高灵敏度和高特异性,但检测通量低且不能定量。为了进一步提升SHERLOCK的性能,2018 年张峰研究团队[29]对SHERLOCK技术进行了优化升级,称之为第二代SHERLOCK(SHERLOCKv2)。第一代SHERLOCK只能每次检测一种核酸序列,但SHERLOCKv2一次分析可同时提供多达4种不同目标的荧光信号,可同时测试多个目标。除了检测目标数量的升级外,SHERLOCKv2也使用了额外的CRISPR相关酶(Csm6)来放大其检测信号,从而使得灵敏度提高了100倍。SHERLOCKv2还能够进行定量测定,检测限可低至2 amol/L。SHERLOCKv2有效解决了第一代SHERLOCK检测通量低、不能定量的问题,而且检测时使用了侧向层析试纸条检测,使检测更加便捷。虽然SHERLOCK技术使检测摆脱了设备及人员的局制,但检测样本遗传物质提取成为即时检测的限制因素,同年,张锋研究团队[30]研发了一种加热未提取诊断样品以消除核酸酶(Heating unextracted diagnostic samples to obliterate nucleases,HUDSON)的方法,该方法仅需对临床样本进行核酸酶灭活和加热等快速处理,即可进行SHERLOCK反应,而且2 h内便可肉眼观测结果,如在全血、血清和唾液的病毒检测中,以极高的灵敏度(1 copy/μL) 检测并区分出4种DENV血清型以及地区性ZIKV毒株。
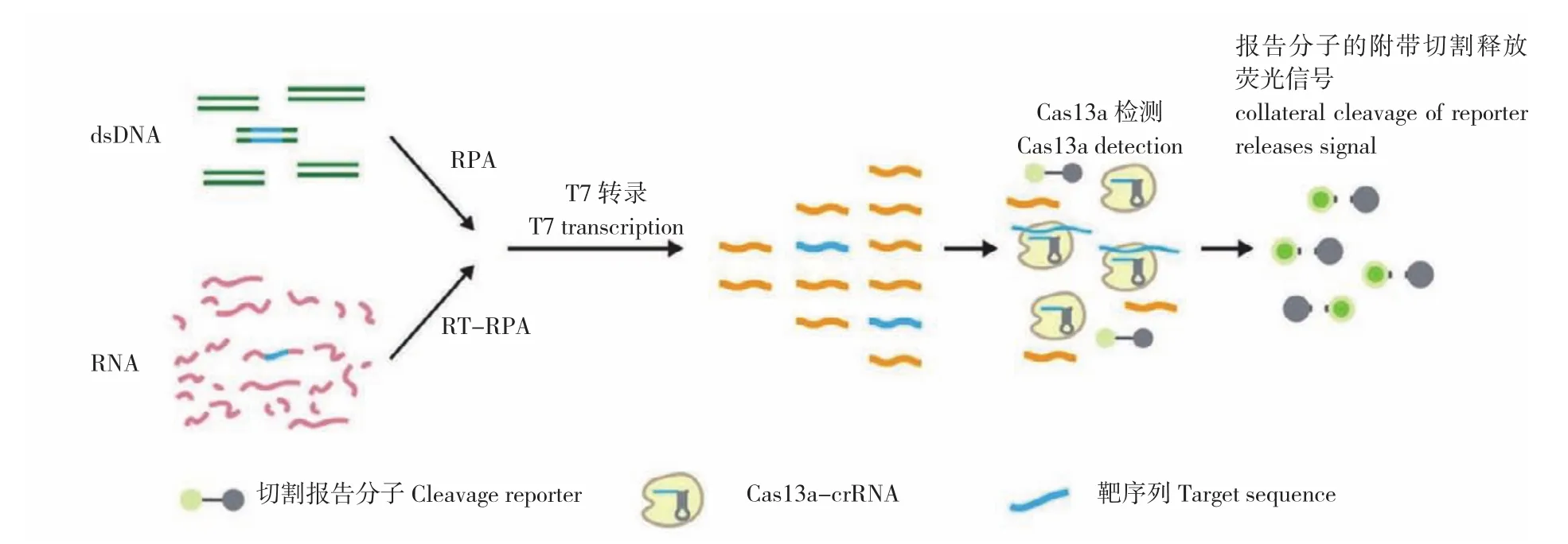
图6 基于CRISPR/Cas13的SHERLOCK核酸检测示意图[25]Fig. 6 Schematic diagram of SHERLOCK nucleic acid detection based on CRISPR/Cas13[25]
4 CRISPR/Cas13系统在核酸检测中的应用
CRISPR/Cas13系统能特异切割靶ssRNA,且具有非特异性的“附带切割”能力[4],这些优良特性以及SHERLOCK技术的产生和发展为CRISPR/Cas13系统在核酸检测领域的应用提供了技术支撑和设计思路。
4.1 CRISPR/Cas13系统在病原体检测中的应用
Chang等[31]利用基于CRISPR/Cas13的SHERLOCK技术在37℃下成功检测了猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV),检测限为172 copies/μL,而且与猪圆环病毒2型、猪细小病毒、猪瘟病毒、伪狂犬病病毒无交叉反应。Liu等[32]以H7N9的HA基因的体外转录RNA为靶点设计特异性crRNA,与RT-RPA和T7转录系统结合,成功建立了基于CRISPR/Cas13a的H7N9快速检测方法。此外,CRISPR/Cas13系统也成功用于EB病毒[33]、埃博拉病毒[34]等的准确、快速检测。最近的新型冠状病毒SARS-CoV-2疫情给全人类的健康带来了巨大冲击。张峰[35]使用合成的2019-nCoV RNA片段,设计并测试了两种crRNA,每种crRNA均能特异性识别2019-nCoV的一种特征性核酸片段,通过基于CRISPR/Cas13的SHERLOCK技术,可以检测出仅10~100 copies/μL的病毒。2020年2月,张峰研究团队[36]向全球公布了该技术的详细操作流程,为方便快速准确地检测新型冠状病毒感染者提供了有力的技术支撑。Patchsung等[37]使用SHERLOCK技术对154个鼻咽和咽喉拭子样本的SARS-CoV-2进行检测,在每个反应42个RNA拷贝的检测限内,荧光读数法100%特异和100%敏感,而用侧流层析法是为100%特异和97%敏感。为了能同时测试多个病原体,Ackerman等[38]开发了可同时测试多个样本的核酸多元评价组合阵列反应(Combinatorial arrayed reactions for multiplexed evaluation of nucleic acids,CARMEN),CARMEN和Cas13检测结合(CARMEN-Cas13)使用,可以在单个阵列上对4 500多个crRNA目标进行可靠的测试,并且实现了对甲型流感病毒的全面分型。
CRISPR/Cas13系统不仅成功应用于病毒检测,还可检测食品和临床样本中少量病原菌。Shen等[39]将核酸变构探针和CRISPR/Cas13a组合,研发了APC-Cas检测系统,该系统能特异灵敏地定量检测牛奶等各类样品中的肠炎沙门氏菌细胞,而且还可以识别小鼠血清中低数量的肠炎沙门氏菌细胞,将早期和晚期感染的小鼠与未感染的小鼠区分开。Zhou等[40]开发了一种基于CRISPR/Cas13a的细菌检测(CRISPR/Cas13a-based bacteric detection,CCB)方法,能够特异检测到低至100 amol/L的金黄色葡萄球菌基因组DNA,其性能与传统的培养计数法相当,但检测时间短且灵敏度高。
4.2 CRISPR/Cas13系统在耐药突变检测中的应用
除了病原体的检测,CRISPR/Cas13系统在耐药突变检测方面也发挥了重要作用。Wang等[41]建立了一种基于PCR的CRISPR/Cas13a检测系统(PCR-CRISPR),可用于乙型肝炎病毒(HBV)及其YMDD(酪氨酸-蛋氨酸-天冬氨酸)耐药突变的检测,每次可检测到1个拷贝,对临床上低水平的HBV DNA和耐药突变的检测具有重要价值。此外,Ackerman等[38]通过CARMEN结合Cas13检测实现了对数十种HIV耐药突变的多重鉴定。
4.3 CRISPR/Cas13系统在物种识别和转基因鉴定中的应用
准确的物种识别是生态学研究和监测基本的方面,也是农业生产中必须明确的重要部分。Baerwald等[42]使用基于 CRISPR/Cas13的 SHERLOCK 技术,成功鉴定了3种现场极易被误认的鱼类物种,充分证明SHERLOCK技术能够实现高度精确的物种分类鉴定。转基因生物及其产品的有效识别是农业转基因生物产业链条全过程监管的有效保障。张峰研究团队[43]成功利用基于CRISPR/Cas13的SHERLOCK技术在30 min内即可检测出转基因大豆中的抗草甘膦基因,并能对大豆混合物中抗草甘膦基因的水平进行量化。
4.4 基于CRISPR/Cas13的核酸检测技术存在的问题
相对于传统的PCR技术,基于CRISPR/Cas13的核酸检测技术具有更高的灵敏度,更好的特异性,而且无需昂贵设备和专业操作人员,方便快捷,成本低廉,因此成为生物检测领域的耀眼新星[1,44-45]。然而,目前所使用的基于CRISPR/Cas13系统的核酸检测技术还存在一些不足,主要体现在以下方面:(1)基于CRISPR/Cas13系统的核酸检测技术一般需使用RNA荧光报告探针,但RNA容易降解,致使可能出现假阳性的检测结果;(2)DNA或RNA的有效获取是核酸检测的基础,简便快捷无需依靠仪器即可有效获取DNA或RNA,是CRISPR/Cas13核酸检测技术能在即时检测中应用的保障,因此,需要进一步开发特别是针对植物或动物组织DNA或RNA 的简便获取技术;(3)由于单独使用Cas13检测的灵敏度偏低,基于CRISPR/Cas13的核酸检测技术一般需要两个反应步骤,第一个步骤是扩增反应,第二个步骤是将扩增的样本加入到包含Cas13蛋白和其他反应试剂的试管中进行检测反应,这不但增加了检测流程的复杂性,而且样本在转移步骤可能被污染。因此,需要进一步开发更为简便的检测手段,让扩增RNA或DNA的步骤和Cas13蛋白检测的化学反应能够在同一个试管中进行,或挖掘更多新型Cas并建立更为简单高效的无需扩增的CRISPR/Cas检测方法。
5 展望
基于CRISPR/Cas13系统的核酸检测技术的灵敏性和特异性非常突出,已经达到amol/L甚至zmol/L的范围,并能检测点突变[29],这必将在核酸检测领域发挥举足轻重的作用。对于检测速度,最快的分析(如SHERLOCKv2)至少需要15 min[29],以后可以通过鉴定新的Cas蛋白和工程改造已存在的Cas蛋白,以及优化信号放大系统,以进一步提高检测速度。基于CRISPR/Cas13系统的核酸检测技术使用了无需核酸提取的病原体检测(HUDSON)[30]、等温扩增以及试纸条检测,为了检测更加便捷,今后应发展一步诊断法,包括病原体核酸释放、预扩增、CRISPR-Cas诱导反应和信号读出等。未来还可以将人工智能(Artifificial intelligence,AI) 与 CRISPR-Cas13诊断测试相结合,构建一个快速、准确和更智能的感染性病原体诊断预警系统。
随着CRISPR/Cas系统在细菌、古菌和细菌大病毒中的不断发现,基于CRISPR/Cas系统的核酸检测技术得以不断丰富发展。如CRISPR基因编辑先驱蛋白Cas9,失去切割活性的变体dCas9也可被固定在石墨烯纳米材料上,成为核酸检测芯片[46]。Cas phi是新近发现的具有功能的最小分子量的Cas12类蛋白,识别和切割dsDNA被激活后,同样具有ssDNA附带切割活性[47]。因此以CRISPR/Cas系统为基础的核酸检测技术,必将弥补以PCR为基础的传统核酸检测技术的不足,在医学、农业和食品等领域发挥重要作用。
