婴儿血管瘤长链非编码RNA与mRNA表达谱分析
2020-08-18杨开颖代诗懿邱桐周江元陈思源吉毅
杨开颖 代诗懿 邱桐 周江元 陈思源 吉毅
1四川大学华西医院小儿外科,成都610041;2四川大学华西医院重症医学科,成都610041
婴儿血管瘤(infantile hemangioma,IH)是婴幼儿最常见的良性肿瘤,发病率为4%~5%[1]。绝大多数IH 可自然消退,但仍有10%~15%的IH 可引起严重并发症[2]。研究表明,血管发生与血管生成均参与IH的发病过程,但确切机制尚不清楚[3]。目前,长链非编码RNA(long noncoding RNA,lncRNA)已被证实在内皮细胞分化及血管生成等方面发挥重要调控作用[4]。本研究旨在通过基因芯片技术分析增殖期与消退期IH的lncRNA差异表达情况,并利用生物信息学技术分析lncRNA 参与调控IH发病的机制。
对象与方法
一、对象
2019年1-3月在四川大学华西医院小儿外科行手术切除治疗(在向所有患儿家属介绍如口服普萘洛尔等非手术治疗的前提下,家属综合考虑后首先选择手术切除治疗)的8 例IH 组织(表1),所有患儿在术前均未采取过任何治疗措施。术中将切下标本组织分成两份,一份立即转运至-80 ℃冰箱长期储存;另一份用于病理诊断及分期。经HE 染色(图1)和免疫组化葡萄糖转运蛋白1(GLUT-1)染色(图2)分析,结合临床特征,依据文献[5]确诊增殖期与消退期各4 例。其中,增殖期IH 颜色鲜艳,瘤体会逐渐生长并凸出体表,表面张力大;消退期IH颜色暗红,瘤体逐渐缩小变软,中心可以缓慢退化变白。本研究获得四川大学华西医院伦理委员会批准(批件号:2017414),取材前所有患儿家属签署知情同意书。
二、方法
1.RNA提取和lncRNA与mRNA表达谱芯片制备:采用Trizol试剂(美国Thermo Fisher Scientific公司)提取组织中总RNA,采用miRNeasy Minikit试剂盒(美国Qiagen 公司)将RNA 提纯,使用Nano Drop 2000(美国Thermo Fisher Scientific 公司)分光光度计对RNA 进行定量,同时进行琼脂糖凝胶电泳质检,最终将制备的RNA样本储存于-80 ℃液氮中备用。采用Affymetrix GeneChip Human Transcriptome Array 2.0二代高通量芯片(美国赛默飞世尔科技公司)分析增殖期与消退期IH lncRNA与mRNA的差异表达谱,包含245 000余条mRNA探针和40 000余条lncRNA探针。每个标本都进行标准化的芯片上样处理。基因芯片探针设计由上海其明科技有限公司完成。

表1 8例婴幼儿局灶性混合型血管瘤临床相关资料

图1 婴儿血管瘤皮损病理表现(HE×400) 1A:增殖期血管瘤内皮细胞高度增殖,血管管腔密集,罕见脂肪组织;1B:消退期血管瘤内皮细胞逐渐成熟,血管团块逐渐形成管腔结构,血管管腔粗大肥厚,脂肪组织浸润增多 图2 免疫组化检查(葡萄糖转运蛋白1 染色×400) 2A:增殖期血管瘤血管内皮细胞染色阳性且丰富表达;2B:消退期血管瘤血管内皮细胞表达葡萄糖转运蛋白1,但表达强度减少
2.生物信息学分析:①通过基因芯片筛选得到差异表达的lncRNA 与mRNA(筛选标准:P <0.05,差异倍数>1.5);②对差异表达mRNA 进行GO 功能和KEGG 通路富集分析;③构建lncRNA-mRNA共表达网络,以相关系数>0.97 或<-0.97 及P <0.05 为标准进行lncRNA 靶基因筛选,并用Cytoscape 软件对其进行可视化处理;④对lncRNA靶基因进行GO和KEGG分析,以预测lncRNA功能作用。以上分析在上海其明公司GCBI(https://www.gcbi.com.cn/)平台完成。
3. 实时荧光定量PCR(qRT-PCR)验证:采用SYBR Green qPCR方法,验证增殖期与消退期IH组织中部分差异lncRNA 与mRNA 的表达,重复3次。采用TRIzol 试剂提取组织中总RNA 后进行核酸定量,参照cDNA 合成试剂盒说明书进行反转录,选用甘油醛-3-磷酸脱氢酶(GAPDH)作为内参基因,引物序列详见表2。qPCR(美国赛默飞世尔科技公司)实验反应条件为:95 ℃30 s;95 ℃15 s,60 ℃30 s共40个循环,最后做熔解解曲线分析。每份样品重复检测3次,采用2-△△Ct法计算差异lncRNA 与mRNA的相对表达量。
4.统计学分析:采用SPSS 23.0 软件进行数据统计分析,连续性变量用±s 表示,采用独立样本t 检验比较组间差异(P <0.05,差异倍数≥1.5)。P<0.05认为差异有统计学意义。
结 果
一、增殖期和消退期IH差异表达的lncRNA与mRNA
以消退期IH 组织为参照组,增殖期IH 中共筛选出405条差异lncRNA,其中108条下调,297条上调,同时筛选出772 条差异mRNA,其中107 条下调,665 条上调(图3)。前20 条差异lncRNA 与前30条差异mRNA分别见表3和表4。
二、增殖期和消退期IH差异mRNA的GO功能与KEGG通路富集分析
GO 功能分析显示,差异mRNA 主要参与血管凝固、轴突导向、血管生成和细胞黏附以及对缺氧反应、凋亡过程、细胞增殖负调控等生物过程;KEGG 通路分析发现,差异mRNA 主要富集在代谢通路、细胞局部黏附、肌动蛋白细胞骨架调控、白细胞跨内皮迁移、磷脂酰肌醇-3-激酶/丝苏氨酸蛋白激酶(PI3K-Akt)、血管平滑肌收缩等信号通路(图4)。
三、增殖期和消退期IH lncRNA-mRNA 共表达网络
经Cytoscape 可视化处理后生成的lncRNAmRNA 共表达网络由370 个节点及1 244 条关系组成。为更好地展示lncRNA-mRNA 共表达网络关系,选取度值(degree,一个点的度指图中该点所关联的边数)≥15的差异lncRNA和mRNA构建相互作用网络,该网络由81个节点(23条mRNA和58条lncRNA)及269条关系组成。从此网络中可知,1条lncRNA 可同时与多条mRNA 发生相互作用关系(图5)。
四、增殖期和消退期IH lncRNA靶基因预测
结合lncRNA-mRNA共表达网络,对lncRNA进行靶基因顺式作用(cis)预测。通过寻找lncRNA上下游10 kb 范围之内的mRNA,以相关系数>0.97或<-0.97 及P <0.05 为标准共筛选出18 对lncRNA-mRNA(表5)。对这些lncRNA预测的靶基因进行GO 功能及KEGG 通路分析,发现这些基因主要富集在“正向调控神经元分化”、“正向调控细胞分化”及“细胞膜电位调控”等生物过程以及“胰腺分泌信号通路”与“环腺苷酸信号通路”等。

表2 实时荧光定量PCR引物序列

图3 增殖期和消退期婴儿血管瘤差异表达的lncRNA(3A)与mRNA(3B)聚类图 P:增殖期;I:消退期。在增殖期血管瘤中表达上调的lncRNA或mRNA均要比消退期多

表3 增殖期和消退期婴儿血管瘤前20条差异(P <0.001)表达的lncRNA

表4 增殖期和消退期婴儿血管瘤前30条差异(P <0.001)表达的mRNA
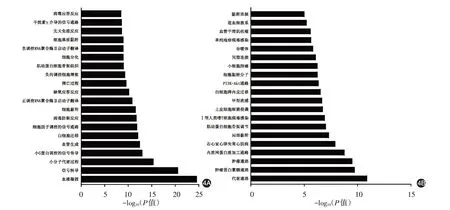
图4 增殖期和消退期婴儿血管瘤前20条差异表达的mRNA GO功能(4A)及KEGG通路(4B)富集结果

图5 度值(degree)≥15 的lncRNA-mRNA 共表达网络图●代表mRNA,代表lncRNA;红色代表上调,黄色代表下调。1条lncRNA可同时与多条mRNA发生相互作用关系
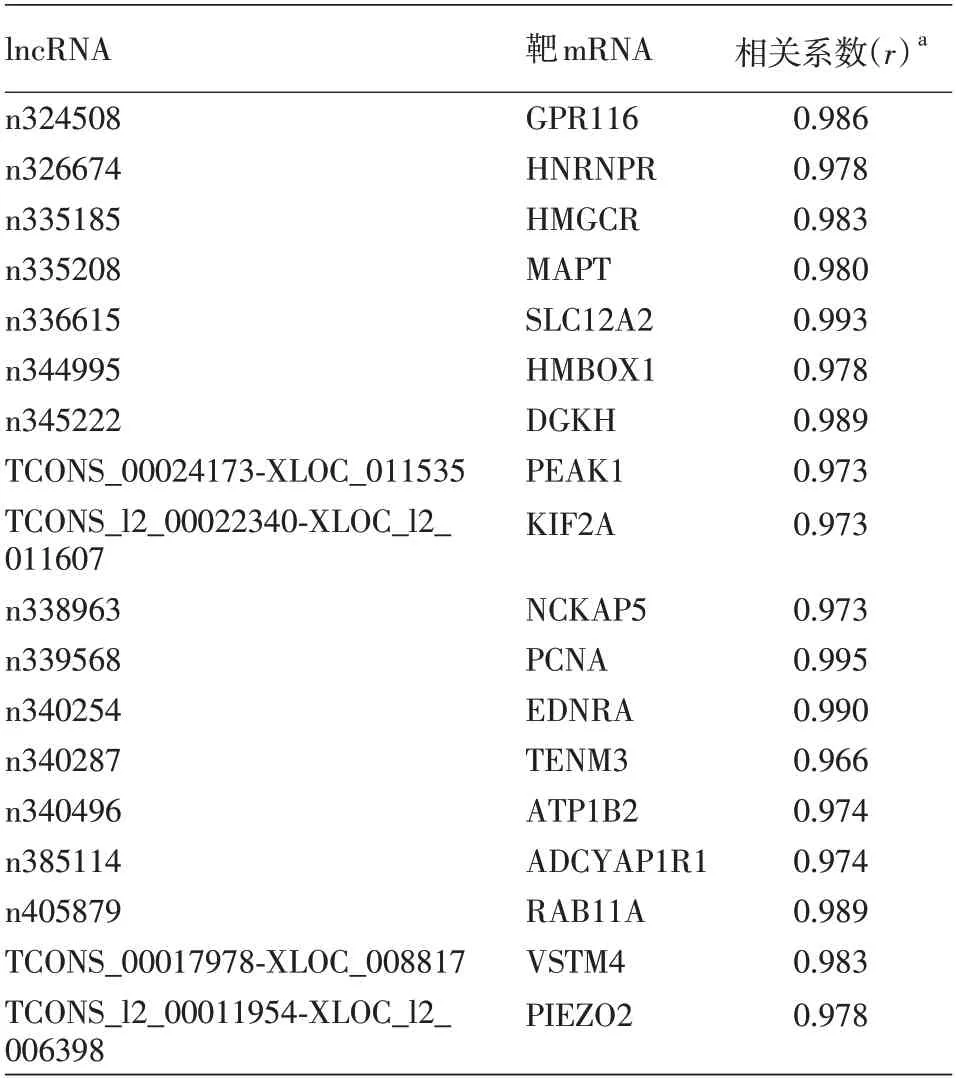
表5 增殖期和消退期婴儿血管瘤差异表达的lncRNA靶基因预测
五、qRT-PCR验证结果
随机选择差异表达的4 条lncRNA(n335248、ENST00000450864、n333319 和n335185)与4 条mRNA(EDNRA、IFI6、HK2 与ITGA1)进行qPCR 验证,结果与芯片检测结果一致。见图6、表6。
讨 论

图6 qRT-PCR 结果验证增殖期和消退期婴儿血管瘤差异表达的lncRNA 与mRNA 1:IFI6;2:HK2;3:ITGA1;4:EDNRA;5:n335248; 6:n333319; 7:n335185; 8:ENST00000450864。Microarray:基因芯片;qRT-PCR:实时荧光定量PCR
表6 实时荧光定量PCR检测增殖期和消退期婴儿血管瘤差异表达的lncRNA与mRNA(±s)

表6 实时荧光定量PCR检测增殖期和消退期婴儿血管瘤差异表达的lncRNA与mRNA(±s)
注:n=3
mRNA/lncRNA IFI6 HK2 ITGA1 EDNRA n335248 n333319 n335185 ENST00000450864增殖期1.25±0.20 0.93±0.14 0.47±0.38 1.20±0.19 0.54±0.46 0.50±0.36 1.16±0.21 1.33±0.30消退期0.68±0.33 1.51±0.83 0.29±0.04 0.66±0.17 0.18±0.09 0.25±0.21 0.98±0.46 2.32±0.99 t值3.13-1.39 0.80 4.12 1.70 1.11 0.58-2.37 P值0.020 0.254 0.455 0.006 0.126 0.304 0.583 0.398
IH 是婴幼儿时期最常见的良性肿瘤,具有典型的生长特征,即先快速增殖后缓慢消退[2]。研究表明,多条通路及多种基因参与IH 的发病过程[6],但是IH 从增殖期向消退期演化的机制仍然不明。随着二代测序技术的发展,基因芯片越来越广泛地用于辅助临床疾病的诊断与治疗。lncRNA 是长度>200 个核苷酸的分子,不具有编码蛋白质功能。研究表明lncRNA 可以参与多种生物学功能,如在转录前、转录后调控mRNA 表达,从而影响细胞增殖、分化、凋亡和迁移,发挥调控血管生成的作用[7-8]。然而,lncRNA在IH中的表达情况及其所发挥的功能目前仍不清楚。为了更好地研究IH 中lncRNA 的作用,我们通过对比增殖期与消退期IH组织中lncRNA 与mRNA 的差异表达情况,结合生物信息学技术,筛选出与IH 发生发展相关的lncRNA 与mRNA,同时构建lncRNA-mRNA 共表达网络。该共表达网络表明,lncRNA 与mRNA 之间的联系并不是简单的一一对应关系。1 条mRNA可以由多条lncRNA共同调节,同样地,1条lncRNA也可以作用于多条mRNA。这进一步佐证了IH 发病机制及发生发展过程的复杂化。通过lncRNAmRNA 共表达网络,我们对lncRNA 靶基因进行预测,如lncRNA n405879靶基因RAB11A可以通过调控表皮生长因子的表达影响细胞分化[9],这为进一步深入探讨血管瘤的发病机制提供了新方向。
本研究中,共筛选出445 条差异lncRNA 与772 条差异mRNA,这些差异基因不仅包括已经被证实参与调控IH 发病机制的重要基因,如DLL4、HIF1A、JAG1、HEY1 及PDGFRB 等[10-11],可参与Notch 信号通路,调控血管内皮细胞的增殖与迁移[6],还包括许多尚未发现与IH 相关的基因,如与血管生成相关的基因LEPREL1、RAMP2 及SERPINE1 等[12-14],它们可能在IH 发生发展过程中调控血管瘤内皮细胞的增殖、分化等,从而调控IH血管生成。GO 功能富集显示,差异基因除了富集在血管生成、细胞黏附、对缺氧刺激反应等所熟知的参与IH发病机制的功能外[3],还富集在一些尚未在IH 领域内被深入研究的新的生物功能,如血液凝固与血小板激活及肌动蛋白细胞骨架等。既往研究显示,消退期IH 比增殖期IH 中Ⅲ型胶原蛋白和层黏连蛋白大量沉积[15],普萘洛尔可以通过降低细胞外基质蛋白(基质金属蛋白酶9)的表达,从而抑制血管瘤内皮细胞血管生成[16],这些功能均有报道与肿瘤生长存在联系[17-18]。
同样,本研究中KEGG 通路分析显示,差异基因除富集在局部黏附通路、PI3K-Akt信号通路及细胞黏附分子通路等已知的与IH发生发展相关的通路外,还富集在代谢通路、肌动蛋白骨架调控通路、血管平滑肌收缩通路及胰岛素信号通路等尚未在IH发病机制中被深入研究的通路。如参与代谢通路的HK2基因,其作为糖酵解通路的关键酶之一,可以通过促进乳酸产生从而调控肿瘤生长与迁移[19],同时研究显示,PI3K-Akt 信号通路可以通过调控HK2的表达发挥抑制细胞凋亡和促进肿瘤生长的作用[20],这表明HK2 所参与的糖代谢通路很有可能也在IH发生发展过程中发挥作用。以上结果表明,多种差异基因可能参与多个生物过程以及多条信号通路,共同发挥对IH 发生发展过程的调控。
利益冲突所有作者均声明不存在利益冲突
