化疗联合免疫检查点抑制剂对局部晚期或转移性胃和胃-食管结合部癌患者的疗效及安全性分析
2020-07-08刘婷婷张素洁
李 涛,陶 然,张 帆,刘婷婷,张素洁,胡 毅
1解放军总医院第一医学中心 肿瘤内科,全军肿瘤学重点实验室,肿瘤靶向治疗和抗体药物教育部重点实验室,北京 100853;2解放军总医院研究生院/解放军医学院,北京 100853;3解放军总医院第二医学中心 呼吸科,北京 100853
胃和胃-食管结合部癌(gastric cancer or gastroesophageal junction cancer,GC/GEJC,以下简称胃癌)是世界范围内发病率和死亡率较高的恶性肿瘤。依据全国癌症登记中心(National Central Cancer Registry of China,NCCR)/中国医学科学院肿瘤发布的《2015中国癌症统计数据》等相关流行病学资料显示,2015年我国新发GC/GEJC约67.91万例,死亡49.80万例,发病率位居同期男性恶性肿瘤第2位,女性第4位,死亡率位居男性恶性肿瘤第3位,女性第2位[1-2]。目前,对于不可手术的局部晚期或转移性GC/GEJC缺乏较为有效的治疗和控制手段。近年来,以程序性死亡受体-1/死亡受体配体 -1(programmed death-1,PD-1/ligand 1,PDL1)为代表的免疫检查点抑制剂(immune checkpoint inhibitor,ICI)登上了肿瘤治疗的舞台,特别是在恶性黑色素瘤、头颈部肿瘤、非小细胞肺癌领域取得了突破性进展[3-4]。但目前PD-1抑制剂联合治疗对GC/GEJC效果的数据尚不成熟,特别是在中国晚期GC/GEJC患者中的临床数据仍十分有限[5-6]。本研究系统回顾了化疗或联合PD-1抑制剂治疗71例不可手术切除的局部晚期和转移性GC/GEJC患者的疗效及安全性,旨在为中国人群的胃癌诊治提供更多的临床参考。
资料和方法
1 资料 收集解放军总医院第一医学中心肿瘤内科2015年5月- 2019年5月住院治疗的晚期GC/GEJC患者。其中单纯化疗的患者37例为化疗组,治疗以氟尿嘧啶类(5-FU/卡培他滨/替吉奥)联合铂类或紫杉类为基础;上述化疗药物同时联合PD-1抑制剂纳武单抗(Nivolumab)或派姆单抗(Pembrolizumab)的患者为联合组,共34例,其中一线联合有13例,二线联合有21例。纳入标准:经过临床病理确诊的GC/GEJC腺癌患者,局部晚期或远处转移且经确认不可手术;有可测量和评价的相关影像学资料,且既往生存期≥3个月,在开始治疗前均签署相关知情同意书。排除标准:治疗前有明确的严重心肺功能疾病、遗传性/获得性免疫缺陷疾病、自身免疫性紊乱/疾病,以及治疗前血常规、血生化、凝血功能存在明显异常。
2 治疗方法 联合组接受以氟尿嘧啶类(5-FU/卡培他滨/替吉奥)联合铂类或紫杉类为基础的双药化疗,同时联合Nivolumab(3 mg/kg静脉输注,每2周1次)或Pembrolizumab(2 mg/kg静脉输注,每3周1次)。化疗组采用上述双药联合方案,不采用免疫治疗。特殊患者:对于经免疫组化(immunohistochemistry,IHC)确认为3+或2+经荧光原位杂交(fluorescence in situ hybridization,FISH)确证为HER2存在扩增的患者,在两组中均会采用曲妥珠单抗(trastuzumab)靶向治疗,但联合组中免疫治疗药物不与曲妥珠单抗在同一治疗线数中使用。以上治疗均以21 d为一个治疗周期。
3 疗效评价 疗效评价标准:患者每2周期进行治疗相关影像学检查,以实体瘤疗效评价标准(response evaluation criteria in solid tumors,REIST)1.1版作为疗效评价依据,影像资料均有至少2名临床肿瘤医师予以确认。综合疗效评价分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、病情稳定 (stable disease,SD)或病情进展(progressive disease,PD)。其中以CR+PR为客观缓解率(objective response rate,ORR),以CR+PR+SD为疾病控制率(disease control rate,DCR)。治疗评估为CR、PR或SD的患者在治疗完成后,联合组以氟尿嘧啶类单药联合免疫治疗药物维持治疗,化疗组以氟尿嘧啶类单药维持治疗。主要观察指标:1)无进展生存期(progressionfree survival,PFS):指从患者开始接受治疗的第1天起,至疾病进展或因任何原因死亡为止;2)总生存期(overall survivsal,OS):从患者开始接受治疗的第1天起,至因任何原因死亡为止;3)治疗不良反应。2017年9月美国卫生及公共服务部(U.S. Department of Health and Human Services)颁布的常见不良反应事件评价标准(common terminology criteria for adverse events,CTCAE)5.0版,为本研究治疗期间不良反应的评价标准,共Ⅰ~Ⅴ级,级别越高代表不良反应越严重。所有信息的统计截止时间为2019年5月31日。
4 统计学处理 使用SPSS22.0进行研究资料分析。观测资料中的年龄为偏态计量数据,以中位数和范围描述,两组间的比较采用秩和检验。计数资料以例数及百分比描述,两组间比较采用χ2检验或校正χ2检验。此外,生存等时间队列资料建立Kaplan-Meier乘积限生存曲线模型,组间生存率比较采用log-rank检验。检验水准α=0.05。
结 果
1 两组基线资料比较 两组患者的基线特征及均衡性匹配,见表1。两组患者性别、年龄、肿瘤类别、分化程度、HER-2是否扩增等指标差异无统计学意义(P>0.05),而ECGO评分、转移灶数目等指标差异有统计学意义。
2 两组疗效比较 随访截止时间为2019年5月31日,中位随访时间为18.4个月。联合组PR 8例,SD 19例,PD 7例。化疗组达到PR 7例,SD 21例,PD 9例。两组患者均无达到CR的病例,临床疗效评估见表2。
3 两组生存期比较 所有患者、联合组和化疗组的中位 PFS 分别为 4.90 个月 (95%CI:3.48 ~ 6.32)、3.93个月 (95%CI:1.56 ~ 6.30)和 4.97个月 (95%CI:3.36 ~ 6.58),中位 OS分别为 13.74个月 (95%CI:9.67 ~ 17.81)、14.37 个月 (95%CI:8.17 ~ 20.57)和12.52个月(95%CI:9.82 ~ 15.22)。两组及所有患者的Kaplan-Meier生存曲线分别见图1和图2。Log-rank法检验,两组PFS、OS差异均无统计学意义(P>0.05)。

表1 两组胃癌患者基线特征比较Tab. 1 Demographic and clinical characteristics of patients in the two groups (n, %)
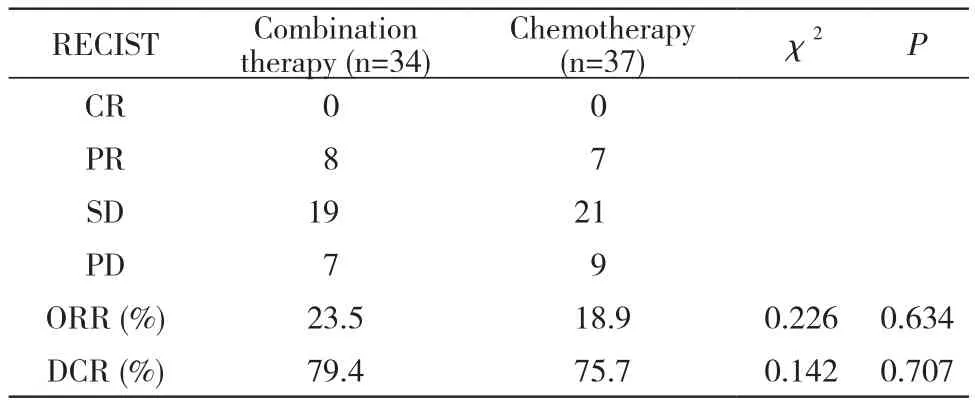
表2 两组临床疗效比较Tab. 2 Clinical eff i cacy comparison between the two groups (n)
4 两组不良反应比较 两组常见的不良反应为血液学毒性、消化道反应、周围神经毒性和肝毒性等,大部分处于Ⅰ~Ⅱ级。其中在联合组中观察到可能与免疫治疗相关的胃肠道穿孔致死亡1例。见表3。

图1 患者无进展生存曲线Fig. 1 Progress-free survival curves of patients in the two groups
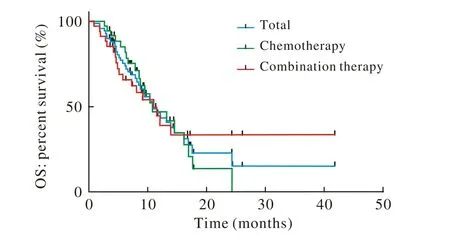
图2 患者总生存曲线Fig. 2 Overall survival curves of patients in the two groups

表3 两组药物不良反应比较Tab. 3 Comparison of adverse drug reactions between the two groups (n, %)
讨 论
肿瘤的发生与发展离不开肿瘤本身逃避机体的免疫监视机制,其主要是通过肿瘤细胞本身、肿瘤微环境与机体免疫系统之间的相互作用,分泌免疫抑制因子,表达免疫检查点配体,最终导致肿瘤细胞逃避免疫监测和免疫杀伤[7-8]。目前上市且较为成熟的免疫治疗药物主要是通过阻断免疫抑制信号,也就是阻断免疫检查点通路,增强抗原呈递细胞和细胞毒性T细胞的附着,从而激活自身免疫细胞杀伤肿瘤[9-10]。免疫治疗作为外科手术、放疗、分子靶向治疗之外的治疗模式,其疗效和安全性已逐渐在多种肿瘤中得到验证和认可[11]。
胃和胃-食管结合部癌具有恶性程度高、侵袭性强、预后差等特点,约有近70%的患者于发现时已处于疾病的进展期,约50%的患者一经发现就已失去了手术机会,需要接受以化疗为基础的多手段系统性综合治疗[12]。即使目前治疗手段较多,但总体预期生存仍低于1年,5年生存率不到20%[13]。既往在GC/GEJC三线治疗的临床研究中,ATTRACTION-2研究结果显示Nivolumab与安慰剂相比,患者死亡风险显著降低,两组1年总生存率分别为26.2%和10.9%,2年OS率为10.6%和3.2%,显著优于安慰剂组[14]。KEYNOTE-059研究显示Pembrolizumab在三线对于PD-L1综合阳性评分(combined positive score,CPS)≥1%的GC/GEJC患者中位PFS为2个月,OS为6个月,ORR为12%[15]。基于以上结果两药分别获批三线治疗。在二线治疗方面,KEYNOTE-061[16]研究表明与紫杉醇单药标准化疗相比,Pembrolizumab在PD-L1 CPS≥1%的人群中未显著改善其总生存期,但在PD-L1 CPS≥10%的亚组分析中观察到了OS的获益趋势,提示这类患者可能是免疫治疗潜在的优势获益人群。目前一线的临床研究正在进行之中:ATTRACTION-4研究以Nivolumab联合SOX或XELOX方案初治HER-2阴性GC/GEJC患者的安全性和有效性研究中有效率分别为67%和71%,PFS为9.9个月和7.1个月,而与PD-L1表达无关[17]。Ⅲ期随机对照的KEYNOTE-062评估了一线Pembrolizumab单药或联合化疗对GC/GEJC的效果,在PD-L1 CPS≥1%的人群中免疫单药相对于化疗并没有改善患者总生存,在PD-L1 CPS≥10%的人群中改善了患者生存,OS提高了6.6个月[18]。在本研究中,联合组所得出的PFS 3.93个月与化疗组的患者有差距,但联合组ORR和DCR相比化疗组存在一定优势。所得结果与2019年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)所公布的最新KEYNOTE-062研究结果相似,免疫治疗在一线GC/GEJC治疗中的数据基本一致。但所得结果仍可看出一定程度OS的临床获益,侧面印证了免疫治疗需要较长起效时间,持续时间较长,存在一定程度的“拖尾“效应,这与既往其他肿瘤报道的一致[19]。在联合治疗组中,美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分≥2分的患者占该组人数的32.4%,且存在两组的不均衡性差异,故在一定程度上导致联合组的治疗效果并没有较化疗组PFS有明显优势。联合组OS可能存在一定的临床获益,但统计分析未能显示出明显差异,可能是由于样本数不足影响了统计效能所致。
在药物的安全性方面,药物的临床安全性与上述临床研究的结果基本一致。在联合组中,1例患者出现致死性的胃肠道穿孔。查阅既往就诊资料,在治疗开始前一段时期,该患者已表现出胃肠道穿孔症状,经积极的治疗有较为明显的缓解,但在后续联合PD-1期间再次出现胃肠道穿孔,提示可能与化疗联合免疫治疗有一定关系。此外,无其他较为严重或与既往报道不一致的不良反应出现。
以上结果充分说明在GC/GEJC治疗中,免疫治疗特别是免疫治疗联合化疗的临床疗效在真实世界中并没有达到较为满意的临床获益,总体有效率欠佳,需进一步探索可能存在的原因,如肿瘤本身是否能够产生足够免疫应答、肿瘤间质的成分差异、较为有效的生物预测标记物、筛选免疫治疗特定的获益人群等[20]。2014年,癌症和肿瘤基因图谱(Cancer Genome Atlas,TCGA)将胃癌分为四种亚型:EB病毒感染型(epstein-barr virus positive,EBVaGC),微卫星不稳定型(microsatellite unstable,MSI),基因组稳定型(genomically stable,GS)和染色体不稳定型(chromosomal instability,CIN)[21]。寻找指导免疫治疗的相关生物标记物,继而发现免疫治疗的优势获益人群,在以化疗为基础的肿瘤综合治疗中显得尤为重要,因为在没有经有效生物标记物筛选的情况下,免疫治疗的反应率也仅为10% ~ 26%[22]。目前,对于GC/GEJC患者而言,指导免疫治疗的相关生物标记物尚存争议。以错配修复缺陷(deficient mismatch repair,dMMR)、高度微卫星不稳定性(microsatellite instability high,MSI-H)、肿瘤突变负荷(tumor mutation burden,TMB)、PD-L1表达阳性、循环肿瘤 DNA(circulating tumor DNA,ctDNA)以及是否存在EB病毒感染等为代表的特征人群,在既往临床研究中显示出可能与免疫治疗疗效及临床获益相关[23-29]。既往KEYNOTE-012研究不仅拉开了GC/GEJC免疫治疗的时代序幕,而且通过筛选出PD-L1阳性表达的特定人群,表明其可能是一个真实有效的生物标记物[30]。在错配修复基因发生种系突变或散在突变,无法修复DNA重复序列中的复制错误或不稳定性而出现以MSI-H为带代表的特征,已经在结直肠癌中提示与免疫治疗有一定的相关性[31],在胃癌中仍需进一步探索。此外,EB病毒相关性胃癌(EBV associated gastric carcinoma,EBVaGC)也可能是胃癌免疫治疗的优势获益人群[32-33]。目前,上述结果也仅是一部分应用于临床作为免疫治疗的参考,尚无公认的、较为可靠的生物标记物[34-35]。本研究为回顾性分析,对上述结果并没有更深一步的探寻,这也是本文局限性所在。
综上所述,在GC/GEJC治疗中,以化疗为基础联合免疫治疗的策略希望与失望并存,并没有像在肺癌领域那样取得的巨大成功[36]。如何凭借免疫治疗的东风,让“胃”来之路走的更远、更好,就需要我们进一步探寻肿瘤细胞、肿瘤微环境及其间质特征,从既往的临床和基础研究中寻找潜在的分子生物和药物作用机制之间可能的联系和作用靶点。本研究作为我国在该领域紧跟国际肿瘤治疗前沿的一项真实世界的回顾分析,有一定的临床借鉴和参考意义。
