白及多糖脂质体的制备及对酪氨酸酶活性的影响
2020-07-03孔令悦唐克华董爱文唐忠海
孔令悦 向 华 唐克华 董爱文 唐忠海
(1. 湖南农业大学生物科学技术学院,湖南 长沙 410128;2. 湖南农业大学食品科学技术学院,湖南 长沙 410128; 3. 吉首大学林产化工工程湖南省重点实验室,湖南 张家界 427000)
白及多糖(Bettila striata polysaccharde,BSP)为无味白色细纤维状,易溶于热水,不溶于高浓度有机溶剂。具有止血[1]、抗肿瘤[2]、抗菌[3]等生物活性。其提取物对光敏感、易氧化、易醇沉。现有的白及多糖修饰方法主要为通过有机酸(胆甾醇琥珀酸、硬脂酸、磷酸、叶酸等)对其进行酯化和醛化等化学修饰法,该方法降低了白及多糖的还原性。酪氨酸酶是一种氧化酶,可通过氧化L-多巴的羟基,调控人体黑色素和瓜果褐变的生成[4]。
脂质体是由与皮肤结构相似的双亲性分子组成[5],可以使白及多糖更好地透过人体表皮,并在皮肤细胞中积累,达到美白效果。试验拟采用纳米脂质体法制备高含量白及多糖脂质体,并研究其对酪氨酸酶的影响,旨在为白及多糖在美白化妆品、保健食品、食品添加剂等方面的应用提供依据。
1 材料与方法
1.1 仪器与试剂
1.1.1 材料与试剂
白及块茎:广州民信药业连锁有限公司;
酪氨酸酶:上海源叶生物科技有限公司;
辛酸/癸酸甘油三酯PEG-8辛酸/癸酸甘油酯类:广州市衡拓贸易有限公司;
鲸蜡硬脂醇聚醚-25:广州合孚化工有限公司;
月桂醇聚醚-23:广州市奥源贸易有限公司;
乙氧基二甘醇:上海蒲恩生化科技有限公司;
PEG-30二聚羟基硬脂酸酯:广州利美达进出口商贸有限公司;
辛酸/癸酸甘油三酯:美国英狄士公司;
1,2戊二醇:广州艾比特贸易有限公司;
1,2己二醇:广州露途化工有限公司;
对羟基苯乙酮:广州欣浪生物化工有限公司;
生理盐水:辰欣药业股份有限公司。
1.1.2 仪器与设备
中草药破碎机:1000Y型,天向九太(大连)商贸有限公司;
电子分析天平:FA2204N型,上海力辰仪器有限公司;
旋转蒸发仪:RE-52A型,上海亚荣生化仪器厂;
台式离心机:TGL-16B型,上海圣科仪器设备有限公司;
紫外—可见分光光度计:722S型,上海菁华科技仪器有限公司;
电动搅拌机:GZI20型,江阴科研器械有限公司;
均质机:500W型,北京海福达科技有限公司;
激光粒度仪:3000 HSA型,英国马尔文仪器公司;
全自动酶标仪:MR-96A型,南京贝登医疗股份有限公司;
荧光分光光度计:F-380型,天津港东科技发展股份有限公司。
1.2 试验方法
1.2.1 白及多糖的提取与纯化 采用热水回流提取法提取、醇沉法纯化[6]。
1.2.2 白及多糖脂质体的制备 将油相(1%~10%辛酸/癸酸甘油三酯PEG-8辛酸/癸酸甘油酯类、1%~10%鲸蜡硬脂醇聚醚-25、1%~10%月桂醇聚醚-23、1%~10%乙氧基二甘醇、5%~25% PEG-30二聚羟基硬脂酸酯、5%~20%辛酸/癸酸甘油三酯)与水相(水、25%白及多糖)分别加热至85~90 ℃,12 000 r/min下将油相快速倒入水相中均质3 min;搅拌降温至70 ℃时加入防腐剂(1, 2戊二醇,1, 2己二醇,对羟基苯乙酮),冷却,即制得25%白及多糖脂质体。
1.2.3 透皮渗透行为 猪腹部皮肤(未经开水烫,去除毛发)裁剪成适当大小,皮肤角质层朝上,固定于Franz-type扩散池中。用去离子水配制0.50 mg/mL白及多糖溶液和100 mg/mL白及多糖脂质体溶液。取待测样品100 mL均匀涂布于皮肤上,接受池中加入100 mL生理盐水,37 ℃恒温水浴并搅拌。分别于涂布后定时吸取接受液1 mL,采用苯酚—硫酸法测定白及多糖浓度。待测样品为白及多糖脂质体、白及多糖,去离子水为对照。
1.2.4 酪氨酸酶活力及其抑制率的测定
(1) 白及多糖脂质体溶液的配制:将128 mg白及多糖脂质体溶于10 mL 0.2 mol/L的磷酸缓冲溶液中,再分别稀释成6.4,3.2,1.6 mg/mL溶液。
(2) 酪氨酸酶抑制率的测定:参照文献[7]的方法并稍作改动。取3 mL 0.2 mol/L的磷酸缓冲溶液于10 mL试管中,加入0.1 mg/mL酪氨酸酶溶液(用0.2 mol/mL pH 7.5的磷酸缓冲溶液溶解)1 mL。加入浓度为12.8,6.4,3.2,1.6 mg/mL的白及多糖脂质体溶液各1 mL,混匀,以1 mL磷酸缓冲溶液为空白组,37 ℃孵育30 min。用酶标仪测定OD475 nm值,并按式(1)计算抑制率。
(1)
式中:
R——酪氨酸酶抑制率,%;
Fco——白及多糖脂质体的OD475 nm值;
Fob——空白组的OD475 nm值。
(3) 半抑制浓度的测定:以白及多糖脂质体浓度为横坐标,酪氨酸酶抑制率为纵坐标,绘制回归曲线,并计算半抑制浓度IC50[8]。
1.2.5 荧光光谱分析 向10 mL试管中加入2 mg/mL的酪氨酸酶溶液1 mL,加入浓度为0.0,1.6,3.2,6.4,12.8 mg/mL的白及多糖脂质体溶液各1 mL,混匀,分别加入20,15,10,5 mg多巴粉末,用3 mL磷酸缓冲溶液(0.2 mol/L)进行溶解。37 ℃孵育30 min,于荧光分光光度计上进行荧光谱扫描和测定。光谱条件:扫描温度25 ℃,激发波长295 nm,扫描范围295~400 nm,激发狭缝2.5 nm,扫描速度240 nm/min,发射狭缝2.5 nm。
1.2.6 荧光猝灭机制分析 按式(2)确定荧光猝灭类型。
Fo/Fc=1+Ks[Q]=1+Kqτ0[Q],
(2)
式中:
Fo——荧光体不含抑制剂时的最大荧光强度;
Fc——荧光体含白及多糖脂质体的最大荧光强度;
Ks——Stern-Volmer猝灭常数;
[Q]——抑制剂浓度,mg/mL;
Kq——双分子猝灭过程速率常数,L/mol;
τ0——生物大分子的荧光寿命,约为10-8s。
当小分子与大分子结合时,其结合位点数n与结合常数Ka按式(3)计算。
lg[(Fo-Fc)/Fc]=nlgKa-nlog{1/〔[Qd]-(Fo-Fc)[Qp]/Fo〕},
(3)
式中:
n——药物小分子与生物大分子相互作用的结合位点数;
Ka——结合常数,L/(mol·s);
[Qd]——猝灭剂浓度,mg/mL;
[Qp]——L-多巴浓度,mg/mL。
1.2.7 紫外光谱分析 取浓度为2 mg/mL的酪氨酸酶溶液1 mL,加入浓度为12.8 mg/mL的白及多糖脂质体溶液1 mL,用磷酸缓冲溶液补齐使溶液总体积为5 mL,混匀,37 ℃孵育30 min,空白组为不加白及多糖脂质体,于420~500 nm处进行紫外吸收光谱扫描。
1.2.8 数据处理 采用Origin 6.1软件进行数据分析处理和绘图。
2 结果与分析
2.1 稳定性
白及多糖脂质体为半透明液体、无味,3 000 r/min离心30 min未出现分层现象。28 d耐热/耐寒试验发现,白及多糖脂质体未出现变色、变味、分层、浑浊等异常现象,自然光照条件下连续放置28 d也未出现变色、变味、分层、浑浊等异常现象。初步判断制得的白及多糖脂质体稳定性良好。
2.2 粒径和包封率
由图1可知,样品径粒分布均匀,分布范围适当。经动态光散射处理,制备的脂质体平均粒径为5.72 μm。
试验发现,脂质体包封率数据离散度较小,平均包封率为87.15%,说明该工艺重现性良好。
2.3 透皮吸收情况
颗粒进入皮肤的方式主要有3种:① 粒径>10 μm的颗粒不能渗入,保留在皮肤表面;② 粒径为3~10 μm的颗粒适合渗入皮脂腺—毛囊单元;③ 可通过在毛干周围开口的毛囊漏斗渗入,粒径<3 μm的颗粒可渗入角蛋白细胞胞间。由图2可知,当透皮吸收时间为8 h 时,白及多糖达最大透过量,其透皮效果较差。白及多糖脂质体粒径为3~10 μm,显著增加了白及多糖的透皮渗透效果,其透过量为白及多糖的3倍,当透皮吸收时间为16 h时接近最大透过量,说明该脂质体已渗入皮脂腺—毛囊中。
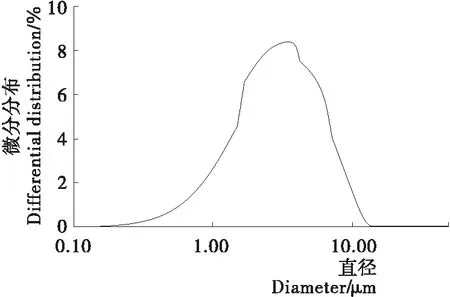
图1 25%白及多糖脂质体的粒径分布图
Figure 1 Particle size distribution of 25%Bettilastriatapolysaccharde liposomes
2.4 白及多糖脂质体对酪氨酸酶抑制率的影响
由图3可知,白及多糖脂质体对酪氨酸酶的抑制率随脂质体浓度的增加而增大,且具有一定的线性关系,当白及多糖脂质体浓度为2 mg/mL时,抑制率达40%,说明脂质体保留了白及多糖的还原性。白及多糖的IC50为11.56 mg/mL。

图2 白及多糖及其脂质体透皮吸收效果
Figure 2 Transdermal absorption ofBettilastriatapolysaccharde and their liposomes

图3 白及多糖脂质体对酪氨酸酶抑制率的影响
Figure 3 Inhibition rates of tyrosinase byBettilastriatapolysaccharde liposomes at different concentrations
2.5 紫外吸收光谱分析
由图4可知,随着白及多糖脂质体含量的增加,酪氨酸酶紫外吸收最大波长向右偏移,波峰由282 nm漂移至286 nm,属于红移,表明该脂质体与酪氨酸酶位点结合,使酪氨酸酶发生了变化。282,286 nm处出现新物质,而白及多糖脂质体的位于282 nm处,说明此处为白及多糖和酪氨酸酶的结合物。
2.6 荧光光谱分析
由图5可知,酪氨酸酶的最大荧光峰出现在334 nm处。加入白及多糖脂质体后,酪氨酸酶的荧光强度逐渐降低,说明白及多糖脂质体对酪氨酸酶的荧光具有猝灭作用,且猝灭作用随酪氨酸酶浓度的增加而变强;同时也表明白及多糖脂质体与酪氨酸酶发生了相互作用,改变了酪氨酸酶构象。

图4 紫外吸收光谱
Figure 4 Ultraviolet absorption spectrum ofBettilastriatapolysaccharde liposomes on tyrosinase

图5 荧光猝灭图
Figure 5 Fluorescence quenching of tyrosinase byBettilastriatapolysaccharide liposomes
2.7 白及多糖脂质体对酪氨酸酶的荧光猝灭机制
以速度倒数1/v为纵坐标,底物浓度倒数1/[s]为横坐标作LINEWEAVER-BWK双倒数法图如图6所示。
抑制类型的判断标准为:① 竞争性,Vmax不变,Km值增加;② 非竞争性,Vmax增加,Km值不变;③ 混合性,Vmax增加,Km值减小;④ 反竞争性:Vmax减小,Km减小。由表1可知,随着白及多糖脂质体浓度的增加,Vmax基本保持不变,Km值逐渐增大,说明白及多糖脂质体为竞争性抑制。白及多糖类似于底物,可与底物竞争酪氨酸酶活性中心的结合位点,从而抑制酪氨酸酶活性。

图6 白及多糖脂质体对酪氨酸酶抑制的LINEWEAVER-BWK图
Figure6 LINEWEAVER-BWK diagram of tyrosinase inhibition byBettilastriatapolysaccharde liposomes
表1 白及多糖脂质体抑制酪氨酸酶活性的动力学参数
Table 1 Kinetic parameters of the inhibition of tyrosinase activity byBettilastriatapolysaccharide liposomes

浓度/(mg·mL-1)KmVmax0.00.940 50.292 61.61.107 70.307 63.21.270 70.298 46.41.548 30.298 712.81.796 80.289 6
假设抑制剂对酪氨酸酶荧光猝灭机制为动态猝灭,以Fo/Fc为纵坐标,白及多糖脂质体浓度为横坐标作图,分析猝灭机制。
由图7可知,白及多糖脂质体Kq为5×1012L/(mol·s),各类猝灭剂对生物大分子的最大扩散常数为2.0×1010L/(mol·s);白及多糖脂质体对酪氨酸酶的荧光猝灭可能不是通过扩散进行的动态猝灭,而是静态猝灭,说明白及多糖脂质体与酪氨酸酶的相互作用为非共价反应,形成了特定结构的化合物。
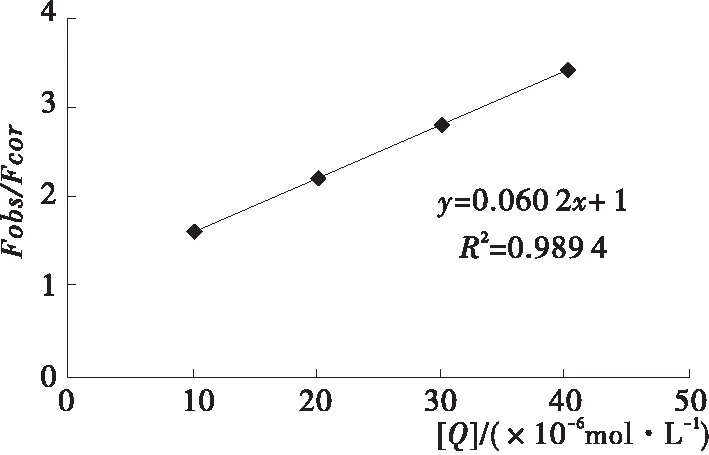
图7 白及多糖脂质体对酪氨酸酶荧光猝灭的Stern-Volmer图
Figure 7 Stern-Volmer diagram of tyrosinase fluorescence quenching byBettilastriata polysaccharide liposomes
由图8可知,线性方程为y=-1.071 1x+5.160 9,R2=0.999 8,斜率即白及多糖脂质体与酪氨酸酶的结合位点数n=1.071 1,截距即结合常数Ka=6.58×105L/mol。
3 结论
通过纳米脂质体制备技术制备了白及多糖脂质体,其粒径分布均匀,稳定性良好。该脂质体保留了白及多

图8 白及多糖脂质体对酪氨酸酶的双倒数图
Figure 8 Double reciprocal plot of tyrosinase toBettilastriatapolysaccharide liposomes
糖抑制酪氨酸酶活性的特征,通过竞争酪氨酸酶的结合点(n=1.071 1),从而抑制酪氨酸酶活性,能有效地渗入皮肤且其输送能力强于传统基质介质的。后续可利用白及多糖打造新型的保健食品或美白功效的化妆品。
